山西老陈醋中优良酵母菌株筛选及其在木枣果酒发酵中的应用
邢晓莹,刘 毅,霍乃蕊,武晓英*
(1.太原师范学院生物系,山西太原 030619;2.山西农业大学园艺学院(山西省农科院园艺研究所),山西晋中 030031;3.山西农业大学动物科技学院,山西晋中 030801)
枣(Ziziphus jujubaMill.)为鼠李科枣属植物[1],落叶灌木或小乔木,原产于中国,已有3 000多年的栽培历史[2]。木枣为枣的一个品种,主要分布于陕晋黄河沿岸的夹谷地带[3]。其中,吕梁地区是我省木枣的主要栽培区,种植面积约13.33×104hm2,占全省红枣种植面积的40%;年产量约3×108kg,约占全省红枣产量的60%[4]。枣果实不仅味道甘甜、营养丰富,同时也是补中益气、养血安神的常用中药,其果实中除了含有较多的矿元素和多种维生素外,还含有丰富的氨基酸、黄酮类化合物、酚类化合物、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、多糖类(水溶性的中性多糖、酸性多糖)等功能性物质,具有清除自由基、延缓衰老的功效,提高机体细胞的免疫活性和抗补体等生理活性。
果酒是以新鲜水果(葡萄、苹果、梨、山楂、柿子等)或果品加工下脚料为主要原料,利用微生物发酵技术酿制的一种营养丰富、风味优良的酒精饮料,酒精度通常在15%vol以下[5]。果酒不仅保留了各类水果中原有的营养成分,在发酵过程中还能生成多种新的功能性成分(如阿洛糖、阿洛酮糖等)[6-10],兼具营养和保健功能。与白酒和啤酒相比,果酒的果香浓郁、色泽鲜艳,消费市场前景广阔。吕梁的木枣在丰收之年,常会面临着产品滞销、销售价格低、入不敷出等问题,大量的木枣甚至无人采摘而烂在了地里,严重影响了枣农种植、管理木枣的积极性。木枣鲜果中的含糖量在40%以上,干果中的含糖量达85%左右[11],如能将其酿制成果酒或果醋,不仅能充分利用木枣资源,解决果品产能过剩、损伤及残次果滞销等问题,还能提高水果附加值及利用率,增加农民收入,辐射周边经济发展及提高企业收入,均具有重要意义。
山西老陈醋是我国传统的谷物酿造醋,其发酵过程中含有丰富的微生物资源,主要酿造微生物除醋酸菌外,还有乳酸菌、芽孢杆菌、酵母菌和霉菌等。参与发酵的酿造微生物经过长期的高温、高酒精度和高酸驯化,分离得到功能菌种,具有耐受性好、致病率低等特点。基于此,本研究采用风味导向的方法,从山西老陈醋酒醪中筛选产酯能力强的功能酵母菌,结合形态观察、生理生化试验及26S rDNA基因序列分析技术对菌株进行鉴定。通过研究目标菌株的生物学特性(环境耐受性)及其在枣果酒发酵过程中的实际产酯效果,探究该菌株的商业价值,为枣酒的纯种发酵或强化发酵提供优质的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料及菌株
酒醪(发酵3 d、5 d、15 d的酒醪):山西老陈醋集团有限公司;安琪生香活性干酵母(多形汉逊酵母(Hansenula polymorpha))Y24、安琪果酒专用酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司;木枣:产自吕梁地区。
1.1.2 培养基
孟加拉红筛选培养基[12]:蛋白胨0.5%,葡萄糖1%,磷酸二氢钾0.1%,硫酸镁0.05%,琼脂1.5%,孟加拉红0.003 3%,氯霉素0.01%,pH自然,121 ℃灭菌15 min。
产酯发酵液[13]:葡萄糖8%,酵母膏1%,蛋白胨2%,pH 4.5±0.2,121 ℃灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[13]:蛋白胨2%,葡萄糖2%,酵母浸粉1%,pH 6.5±0.2,121 ℃灭菌15 min。固体培养基中添加1.5%的琼脂粉。
麦芽汁液体培养基[14]:氯霉素0.01%,麦芽膏粉13%,pH 6.0±0.2,121 ℃灭菌15 min。固体培养基中添加1.5%的琼脂粉。
1.1.3 主要试剂
酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:生工生物工程(上海)股份有限公司;孟加拉红培养基、氢氧化钠、无水葡萄糖、浓盐酸、氯化钠、酵母浸粉、蛋白胨、琼脂、无水乙醇、偏重亚硫酸钾、抗坏血酸:北京索莱宝科技有限公司;LALLZYME HC果胶酶(20 000 U/g):法国LAFFORT公司;所用试剂均为生化试剂或分析纯。
1.2 仪器与设备
DL-CJ-1ND型无菌超净工作台:北京东联哈尔滨仪器设备有限公司;LS-35LJ型立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;ZQPL-200型立式恒温振荡培养箱:天津莱玻特瑞设备有限公司;DyNA-Quant-200型荧光计:通用电气医疗集团生命科学部;UVP凝胶成像系统:上海书俊仪器设备有限公司;5424R高速冷冻离心机:德国Eppendorf公司;7500聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;CX41型生物显微镜:日本奥林巴斯公司。
1.3 试验方法
1.3.1 酵母菌的分离
参照文献[15]采用传统纯培养方法进行分离。
1.3.2 产酯酵母菌的筛选
将保存在斜面上的菌株接种于YPD液体培养基中,28℃、130 r/min条件下活化培养24 h。按2%接种量将活化后的菌株(107CFU/mL)接种于产酯发酵液中,28 ℃静置培养7 d,按国标GB 19777—2005《原产地域产品山西老陈醋》附录C中的方法测定发酵液中的总酯含量[16],试验重复3次。
1.3.3 产酯酵母菌的鉴定
形态观察:将筛选菌株划线接种于麦芽汁琼脂培养基,28 ℃培养48 h,观察单菌落特征,记录菌落的形状大小、菌落颜色、表面情况(粗糙或光滑、有无光泽)、隆起程度、边缘情况等[14]。将筛选菌株接种于麦芽汁液体培养基中,28 ℃培养3 d,通过光学显微镜观测其细胞形态(大小、形状、菌丝等,×400倍)[17]。
生理生化试验[18-19]:对其进行糖发酵试验、碳源同化试验和氮源同化试验。
分子生物学鉴定[20]:采用酵母基因组DNA抽提试剂盒提取筛选菌株的基因组,以其为模板,采用引物NL1和NL4对菌株的26S rDNA D1/D2区域基因序列进行PCR扩增,PCR扩增产物经1%琼脂糖凝胶检测合格后委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)检索,选取同源性较高的模式菌株的26S rDNA D1/D2基因序列,采用MEGA 7.0生物学软件中的邻接(neighbor-joining,NJ)法构建系统发育树,自展值1 000。
1.3.4 产酯酵母的环境耐受性分析[21-22]
以YPD液体培养基为基础,按2%接种量将活化后的菌液(107CFU/mL)接种于相应培养基中,28 ℃培养3 d,采用紫外分光光度计测定发酵液在波长600 nm处的吸光度值。依次考察产酯酵母对乙醇体积分数(0、6%、8%、10%和12%)、培养温度(30 ℃、33 ℃、36 ℃、39 ℃、42 ℃、45 ℃)、pH(4.5、4.0、3.5、3.0、2.5、2.0)、糖度(10°Bx、15°Bx、20°Bx、25°Bx、30°Bx、35°Bx)及SO2添加量(100 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L)的耐受能力。
1.3.5 木枣果酒酿造工艺

操作要点:称取无病虫害的、去核后的木枣5 kg,加入木枣质量3倍的水以及0.01%的偏重亚硫酸钾和0.1%的抗坏血酸组成的复合护色液打浆,80 ℃热处理10 min。冷却至室温后转入20 L的发酵罐中,加入果胶酶,酶制剂用量为果浆质量的0.01%,搅拌均匀,在25~30 ℃的条件下静置8~10 h。将蔗糖熔化成的糖浆煮沸杀菌后加入果浆中,调整初始糖度为15°Bx。先接种产酯酵母有氧发酵24 h,再接种安琪果酒专用酵母有氧发酵24 h,之后封口发酵7 d。发酵结束的果酒上清液经0.22 μm的滤芯除菌过滤,在60~70 ℃条件下加热15~20 min进行巴氏杀菌,最后静置陈酿一段时间,经检验合格进行无菌灌装,得到木枣果酒样品。
1.3.6 木枣果酒酿造工艺优化
(1)单因素试验
以总酯含量作为主要评价指标,固定基本条件为料液比1∶3(g∶mL),初始发酵糖度调整至15°Bx,顺序接种6%的产酯酵母和0.5%安琪果酒专用酵母,28 ℃酒精发酵7 d。每天取样检测发酵液的糖度、酒精含量和总酯含量。在此基础上,采用单因素轮换法,分别考察并确定出料液比(1∶2、1∶3、1∶4、1∶5、1∶6(g∶mL))、发酵温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)、产酯酵母接种量(2%、4%、6%、8%、10%)和发酵时间(5 d、6 d、7 d、8 d、9 d)这4个因素的最佳水平。
(2)响应面试验
在单因素试验的基础上,选择料液比(A)、产酯酵母接种量(B)和发酵温度(C)3个影响较大的因素为自变量,以发酵结束时的酒精度(Y1)和总酯含量(Y2)为响应值,利用软件Design-Expert 8.0.6的Box-Behnken试验设计3因素3水平的响应面试验,因素与水平见表1。

表1 木枣果酒发酵工艺优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for fermentation process optimization of jujube fruit wine
1.3.7 酒精度的测定
采用蒸馏法[22]测定酒精度。
1.3.8 风味及口感的测定
选10名食品专业人员参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》[23],分别对木枣果酒产品的风味及口感进行感官评价。
1.3.9 数据处理
采用MEGA 7.0生物学软件和Design Expert 8.0.6软件进行试验设计及数据分析。
2 结果与分析
2.1 酵母菌的分离
从孟加拉红筛选培养基上挑取具有明显酵母菌形态特征的菌落,经纯化后初步筛选出23株酵母,编号为Y1~Y23。
2.2 产酯酵母菌的筛选
以安琪生香活性干酵母Y24为对照,测定23株产酯酵母菌株的产酯能力,结果见图1。由图1可知,与对照菌株Y24相比,菌株Y2、Y5、Y8、Y14和Y18产酯能力较强。其中,菌株Y14的产酯能力最强,为(38.52±0.19)g/L,其次是菌株Y18[(36.04±0.28)g/L]和Y5[(35.32±0.32)g/L]。因此,选择菌株Y14为目标菌株。

图1 24株酵母菌株的总酯产量Fig.1 Total ester production of 24 yeast strains
2.3 产酯酵母菌株Y14的鉴定
2.3.1 形态观察结果
菌株Y14的菌落及细胞形态见图2。由图2可知,菌株Y14在麦芽汁琼脂培养基上培养24 h,菌落呈圆形,浅白灰色,表面平滑,不反光,边缘整齐。在麦芽汁液体培养基中28 ℃培养3 d,细胞大小为(4.6~6.5)×(3.8~6.5)μm,呈卵形、球形,不产生假菌丝。

图2 菌株Y14的菌落(a)及细胞(b)形态Fig.2 Colony (a) and cell (b) microphotographs of strain Y14
2.3.2 生理生化试验结果
菌株Y14的生理生化试验结果见表2。由表2可知,菌株Y14可以发酵或同化利用葡萄糖、D-甘露醇、琥珀酸、乳酸、甘油和KNO3,不能发酵或同化利用L-鼠李糖、可溶性淀粉、柠檬酸、肌醇、核糖醇和纤维二糖等。根据酵母菌的形态特征与生理生化特征,参照文献[19,24],初步鉴定菌株Y14为毕赤酵母属(Pichiasp.)。

表2 菌株Y14的生理生化试验结果Table 2 Results of physiological and biochemical tests of strain Y14
2.3.3 26S rDNA Dl/D2序列分析结果
菌株Y14的系统发育树见图3。由图3可知,菌株Y14与毛榛毕赤酵母(Pichia manshurica)聚于一支,亲缘关系最近。结合形态观察、生理生化试验结果,鉴定菌株Y14为毛榛毕赤酵母(Pichia manshurica)。现保藏于中国普通微生物菌种保藏管理中心(china general microbiological culture collection center,CGMCC),编号为2.5274。

图3 基于26S rDNA基因序列菌株Y14的系统发育树Fig.3 Phylogenetic tree of strain Y14 based on 26S rDNA gene sequence
2.4 毛榛毕赤酵母Y14的环境耐受性分析
2.4.1 乙醇耐受性试验
乙醇是酵母菌的主要代谢产物,是酒精发酵阶段最重要的物质之一。发酵液中乙醇含量的积累也会对参与发酵的微生物产生一定的抑制和毒害作用,菌株的乙醇耐受力与乙醇产率密切相关,可以将其作为筛选高产乙醇酵母的一个参考依据[25]。菌株Y14对乙醇的耐受性见图4。由图4可知,随着乙醇体积分数的增大,菌株Y14的生长逐渐受到抑制。当乙醇体积分数在0~6%之间时,OD600nm值呈缓慢下降趋势,此时的乙醇体积分数对菌株Y14的正常生长影响较小;当乙醇体积分数达到8%时,OD600nm值降为0.68,表明菌株Y14的生长受到抑制,生长较缓慢;当乙醇体积分数>8%后,OD600nm值迅速降低,菌株Y14的生长受到严重抑制,基本不生长。因此,确定菌株Y14的最高耐受乙醇体积分数为8%。
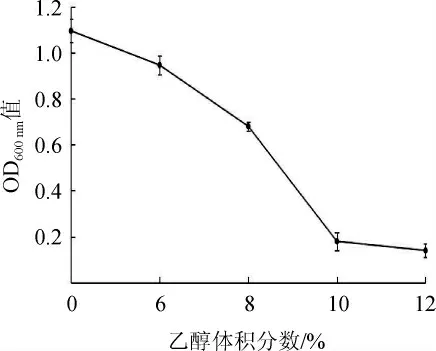
图4 菌株Y14对乙醇的耐受性Fig.4 Ethanol tolerance of strain Y14
2.4.2 pH耐受性试验
山西老陈醋是我国传统的谷物酿造醋,是自然富集的多菌种共同发酵的过程,含有丰富的微生物资源[26]。随着酒化时间的延长,酒醪的pH值逐渐降低,至发酵结束时,pH值由发酵初期的3.92降至3.22,这就要求参与发酵的微生物,必须具有一定的耐酸性。菌株Y14的pH耐受性试验结果见图5。

图5 菌株Y14的pH耐受性Fig.5 pH tolerance of strain Y14
由图5可知,随着pH值的降低,菌株Y14的生物量呈先升高后降低的趋势,适宜菌株Y14生长的最佳pH值为3.5。当pH值在3.5~4.5之间时,OD600nm值呈逐渐上升趋势,且在pH 3.5时达到峰值(OD600nm值1.08),表明该pH值范围适合菌体的生长;当pH值在2.5~3.5之间时,OD600nm值开始降低,表明菌株Y14的生长受到抑制,生长较缓慢;当pH值在2.0~2.5之间时,OD600nm值迅速降低,菌株Y14的生长受到严重抑制,基本不生长。因此,确定菌株Y14的最佳培养pH值为3.5,可以耐受的pH值为2.5~4.5。
2.4.3 温度耐受性试验
酵母菌生长温度在20~40 ℃之间,是典型的嗜温型生物[27]。菌株Y14的温度耐受性结果见图6。由图6可知,当温度在28~30 ℃时,菌株Y14的OD600nm值基本保持平稳,该温度区间适合菌株Y14的生长繁殖;当温度在30~39 ℃时,OD600nm值呈持续下降趋势,表明菌株Y14的生长受到了影响,菌株的繁殖能力随温度的升高明显减弱;当温度超过42 ℃后,菌体的生长繁殖基本停止,推测可能是高温破坏酵母细胞膜,造成细胞损伤,影响细胞生长和代谢[28-29]。因此,确定菌株Y14的最高耐受温度为39 ℃。

图6 菌株Y14对温度的耐受性Fig.6 Temperature tolerance of strain Y14
2.4.4 糖度耐受性试验
水果中的糖以葡萄糖、果糖、蔗糖为主,酵母菌可利用这些糖类供自身生长繁殖,同时进行酒精发酵产生乙醇[5]。在一定范围内,酵母的发酵能力随着糖浓度的增大而增强。但是,过高浓度的糖会对酵母菌的生长产生抑制作用,同时,高渗透压也会造成酵母细胞的水分流失,致使其活性降低[29]。菌株Y14的糖度耐受性结果见图7。由图7可知,随着葡萄糖含量的升高,菌株Y14生物量先升高后降低,当发酵液的糖度<30°Bx时,不会对其产生负影响,说明菌株Y14对葡萄糖的耐受性较好。果酒酒精发酵时的初始糖浓度一般<25°Bx(按葡萄糖计)[30-32],而山西老陈醋糖化阶段的还原糖含量通常<20°Bx[12],菌株Y14能够发挥正常功能。因此,菌株Y14的最适发酵糖度为30°Bx,可以耐受35°Bx的糖度。
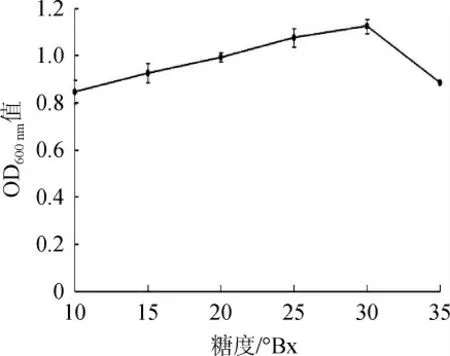
图7 菌株Y14对糖的耐受性Fig.7 Glucose tolerance of strain Y14
2.4.5 SO2耐受性试验
果酒发酵前期通常需加入适量的SO2,达到防止杂菌污染、抗氧化以及护色等目的,但较高浓度的SO2对发酵主体微生物也有一定的抑制作用[33]。菌株Y14对SO2的耐受性见图8。由图8可知,菌株Y14的生长随着SO2质量浓度的升高逐渐受到不同程度的抑制。目标菌株在含有0~150 mg/L SO2的培养液中生长24 h后,OD600nm值略有下降,表明菌株Y14的生长繁殖基本不受影响;当SO2质量浓度为150~250 mg/L时,OD600nm值迅速降低,表明其生长受到较大程度的抑制;当SO2质量浓度>250 mg/L之后,生物量基本为0,表明其生长受到严重抑制。果酒发酵初期,为抑制或杀死其他杂菌,保证发酵的正常进行,通常会添加60~100 mg/L的SO2[34],菌株Y14在这个范围内基本不受影响,能够正常发挥其生理功能。因此,菌株Y14最高可以耐受质量浓度为200 mg/L的SO2。

图8 菌株Y14对SO2的耐受性Fig.8 SO2tolerance of strain Y14
2.5 毛榛毕赤酵母Y14在木枣果酒中的应用
2.5.1 料液比对木枣果酒发酵的影响
以总酯含量为主要评价指标,料液比对木枣果酒发酵的影响见表3。由表3可知,不同的料液比对木枣果酒酒精度、总酯含量及风味、口感的影响显著(P<0.05)。当料液比为1∶2(g∶mL)时,木枣果酒的酒精度最高,达11.2%vol,总酯含量为(1.22±0.01)g/100 mL,发酵液果香浓郁,口感偏苦涩;当料液比为1∶3(g∶mL)时,木枣果酒的酒精度为(10.6±0.16)%vol,总酯含量最高为(1.64±0.06)g/100 mL,有浓郁的枣香气和协调的酒香,酒体丰满,酸甜适口;当料液比为1∶4~1∶6(g∶mL)时,枣汁浓度降低,发酵而成的木枣果酒酒精度在6.8%vol~8.8%vol之间,总酯含量在(0.46~1.48)g/100mL之间,枣香、酒香较淡,酒质较粗糙。因此,确定最适料液比为1∶3(g∶mL)。
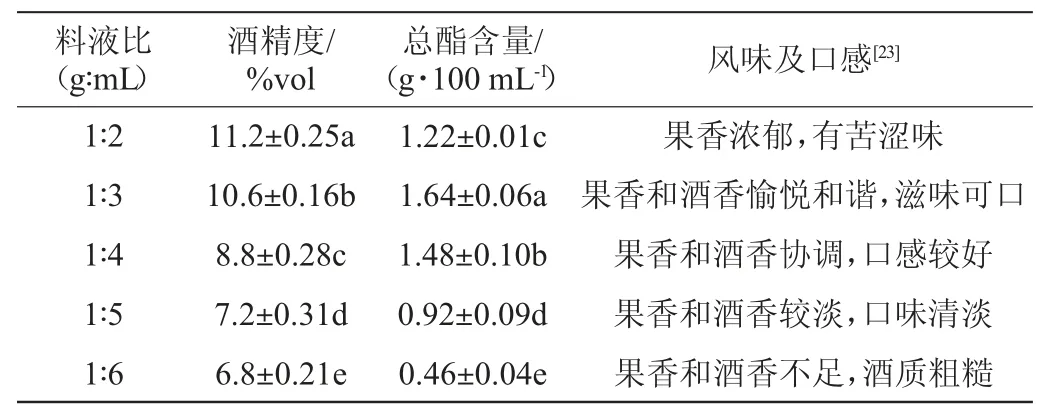
表3 料液比对木枣果酒发酵的影响Table 3 Effect of material to liquid ratio on jujube fruit wine fermentation
2.5.2 发酵温度对木枣果酒发酵的影响
以总酯含量为主要评价指标,发酵温度对木枣果酒发酵的影响见表4。

表4 不同发酵温度对木枣果酒发酵的影响Table 4 Effect of different fermentation temperature on jujube fruit wine fermentation
低温更有利于产酯酵母发酵,从而提高果酒品质[35];但是温度过低也会影响酵母的繁殖和代谢速度。由表4可知,当发酵温度为24~26 ℃时,发酵液中的酒精含量偏低,为7.6%vol~8.9%vol,枣香浓郁,酒香较淡,口感偏甜;当发酵温度为28~32 ℃时,发酵液中的酒精含量为10.8%vol~11.2%vol,总酯含量为(1.42~1.68)g/100 mL,果香、酒香愉悦和谐,滋味可口,无苦味。26~28 ℃发酵条件下的总酯含量明显高于32 ℃发酵温度下的,推测可能是略低的发酵温度适合酯类物质的生成,当发酵温度高于28 ℃会导致产酯酵母的产酶活力降低,不利于产酯酵母代谢,果酒品质也相应降低[35-36]。因此,确定最适发酵温度为28 ℃。
2.5.3 毛榛毕赤酵母Y14接种量对木枣果酒发酵的影响
以总酯含量为主要评价指标,毛榛毕赤酵母Y14接种量对木枣果酒发酵的影响见表5。
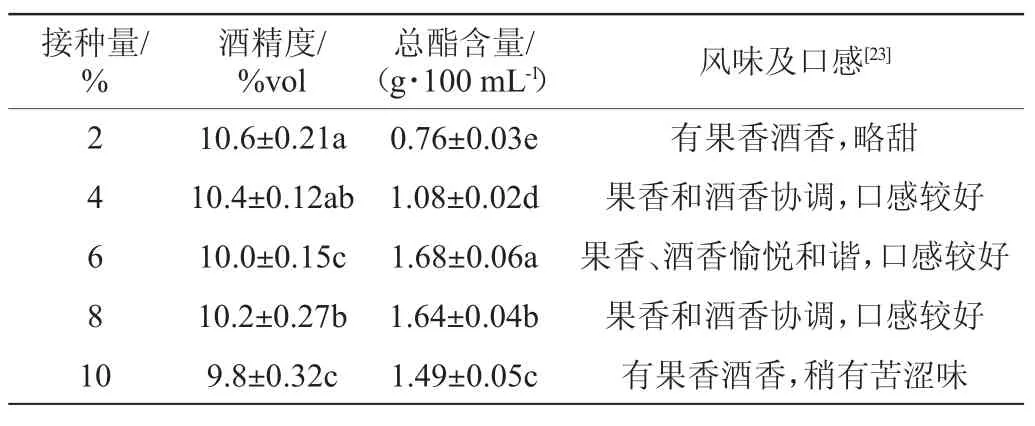
表5 不同毛榛毕赤酵母Y14接种量对木枣果酒发酵的影响Table 5 Effect of different Pichia manshurica inoculum on jujube fruit wine fermentation
由表5可知,P.manshuricaY14接种量过低,发酵启动慢,24 h后接种的安琪果酒专用酵母快速繁殖成为优势菌,会对P.manshuricaY14的生长繁殖产生竞争性的抑制作用,发酵液中也会积累大量的酒精,抑制了P.manshuricaY14的繁殖及代谢,不利于提高发酵液中的总酯含量。当P.manshuricaY14接种量为6%~8%时,木枣果酒的酒精度为10.0%vol~10.2%vol,总酯含量为(1.64~1.68)g/100 mL,果香、酒香愉悦和谐,口感较好。继续加大P.manshuricaY14的接种量,一方面酵母快速繁殖消耗了大量的营养物质,酒体含糖量降低;另一方面可能会导致发酵液中溶氧不足,进而对酵母菌的生长繁殖产生抑制作用,不利于香气物质的形成,导致口感变差。因此,确定最适P.manshuricaY14的接种量为6%。
2.5.4 发酵时间对木枣果酒发酵的影响
以总酯含量为主要评价指标,发酵时间对木枣果酒发酵的影响见表6。

表6 不同发酵时间对木枣果酒发酵的影响Table 6 Effect of different fermentation time on jujube fruit wine fermentation
由表6可知,不同发酵时间对木枣果酒酒精度的影响不大。当发酵时间为5~6 d时,木枣果酒中的果香和酒香较淡,酒味略重,口感较差,推测可能是果酒中的酯类、有机酸、多糖、氨基酸等风味物质尚未完全生成,发酵不彻底所致[37];当发酵时间为7 d时,木枣果酒中的总酯含量为1.62 g/100 mL,果香和酒香逐渐协调一致,酒体丰满,酸甜可口,同时果酒的酒度达到最大值11.0%vol;随着发酵时间的继续延长(9 d),木枣果酒的酒精度略有所降低,此时应结束发酵。因此,确定最适发酵时间为7 d。同时,考虑到发酵时间对木枣果酒酒精度的影响并不明显,故而在响应面试验中发酵时间不作为考察因子进行考虑。
2.5.5 木枣果酒发酵工艺优化响应面试验
(1)回归模型的建立及方差分析
响应面试验设计及结果见表7,方差分析见表8。
采用软件Design-Expert 8.0.6对表7的数据进行回归拟合,得到二次回归方程为:

由表8回归方程的方差分析结果可知,两个模型均极显著(P<0.01),且失拟项均不显著(P=0.29/0.055>0.05),说明此两个模型是可靠的;变异系数(coefficient of variation,CV)=2.09%/9.38%,较小,说明试验操作可信;酒精度和总酯含量的校正决定系数R2Adj=0.948 5/0.900 0,表明94.85%/90.00%的响应值变化是由所选变量引起的,决定系数R2=0.977 5/0.956 2与R2Adj较接近,说明模型拟合程度较好,误差较小,采用响应曲面法优化建立的木枣果酒发酵工艺回归方程(模型)是有效的。
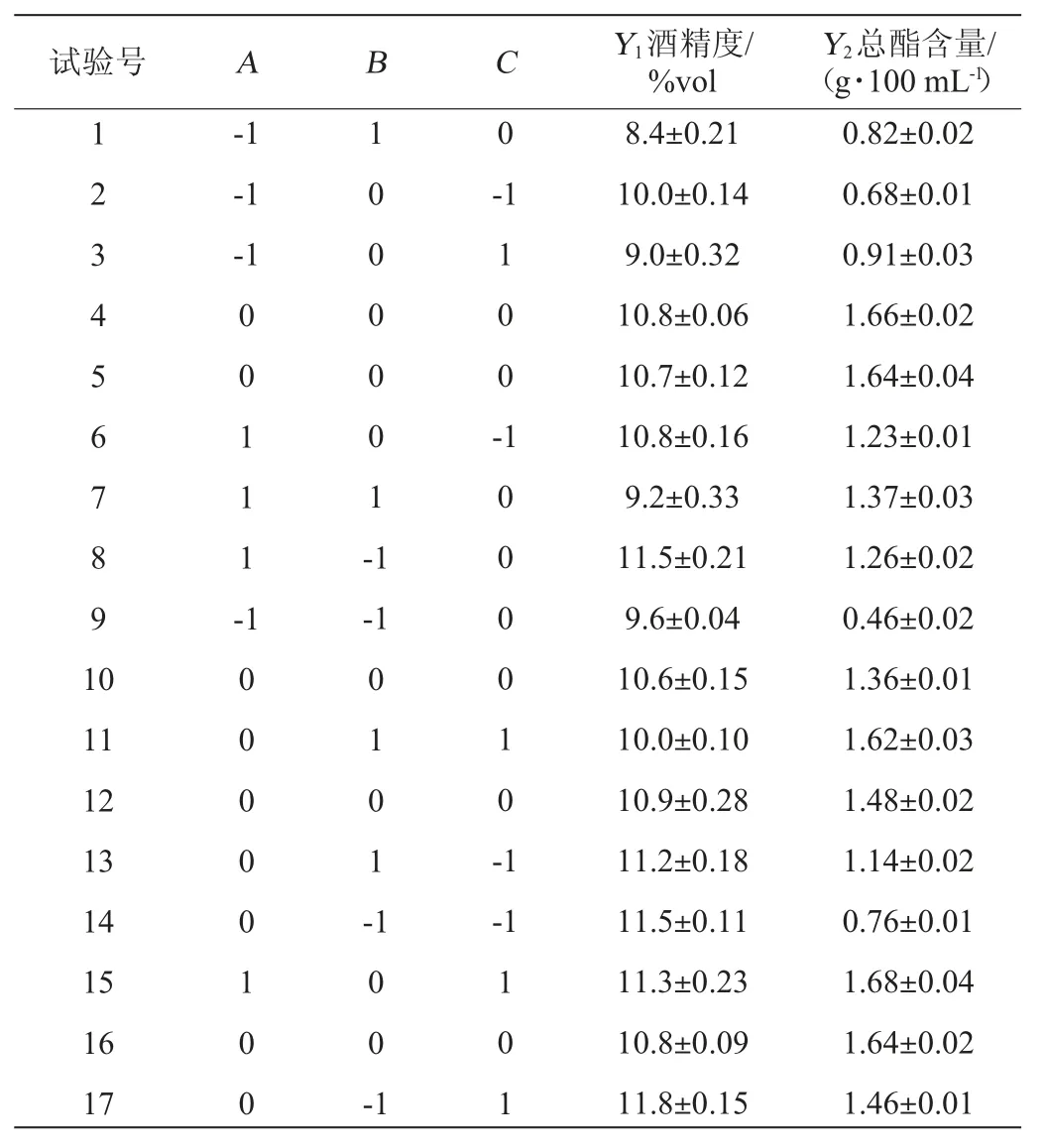
表7 木枣果酒发酵工艺优化响应面试验设计及结果Table 7 Design and results of response surface experiments for jujube fruit wine fermentation process optimization

表8 响应面试验结果的方差分析Table 8 Variance analysis of response surface experiments results
以酒精度为响应值时,一次项A、B和二次项A2、C2对结果影响极显著(P<0.01),交互项AB、AC、BC影响显著(P<0.05),由F检验可以得到因子贡献率为A>B>C;以总酯含量为响应值时,一次项A、C和二次项A2、B2影响极显著(P<0.01),一次项B影响显著(P<0.05),由F检验可以得到因子贡献率为A>C>B。
(2)响应曲面分析
3个因素对指标影响的响应面结果见图9。由图9可直观地看出料液比、P.manshuricaY14接种量和发酵温度的交互作用对酒精含量(Y1)和总酯含量(Y2)的影响程度。响应面的陡峭程度,表示两个因素之间的交互作用是否明显。在Y1模型中AB、AC、BC交互作用显著,等高线呈现椭圆形,存在极值,曲面较为陡峭,交互作用显著;在Y2模型中,AB、AC、BC交互作用不显著,与表8中的方差分析结果一致。
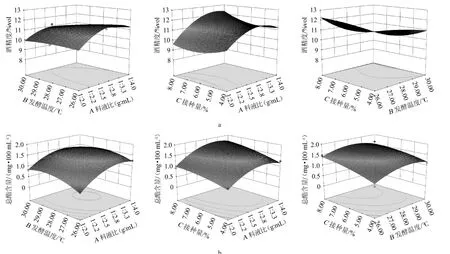
图9 料液比、接种量和发酵温度交互作用对酒精度(a)及总酯含量(b)影响的响应曲面及等高线Fig.9 Response surface plots and contour lines for effects of interaction between material-liquid ratio,inoculum and fermentation temperature on alcohol content (a) and total ester content (b)
(3)验证试验
以总酯含量为主要评价指标,通过回归拟合方程2得到的木枣果酒最优发酵条件为料液比1.0∶2.8(g∶mL),毛榛毕赤酵母接种量6.2%,发酵温度28.3 ℃,预测的总酯含量为1.67 g/100 mL,酒精度为10.8%vol。实际发酵中为操作方便调整为料液比1∶3(g∶mL),顺序接种毛榛毕赤酵母Y14 6%、安琪果酒专用酵母0.5%,发酵温度28 ℃,发酵周期7 d,在优化得出的最佳条件下做3次平行验证试验,获得木枣果酒的总酯含量为(1.68±0.02)g/100 mL,酒精度为(10.5±0.12)%vol,与理论预测值接近。成品果酒的颜色呈琥珀色,枣香、酒香浓郁清新,酒体丰满醇厚,酸甜可口。因此,经响应面法优化所得的最佳发酵工艺参数准确可靠,模型合理可靠,具有实际应用价值。
3 结论
采用纯培养技术从山西老陈醋酒醪中共分离到23株酵母菌,通过产酯性能测试,初筛出1株产酯能力最强的菌株Y14,总酯产量为(38.52±0.19)g/L,通过形态观察、生理生化试验及分子生物学技术鉴定其为毛榛毕赤酵母(Pichia manshurica)。菌株Y14的环境耐受性分析结果表明,菌株Y14可在乙醇体积分数8%、pH值2.5~4.5、糖度35 °Bx、SO2200 mg/L和最高温度不超过39 ℃的环境中生存。将P.manshuricaY14应用于木枣果酒发酵,在单因素试验的基础上采用响应面分析,获得木枣果酒的最适发酵工艺为料液比1∶3(g∶mL),P.manshuricaY14和安琪果酒专用酵母的顺序接种量分别为6%和0.5%,发酵温度28 ℃,周期7 d。制成的木枣果酒酒精度为(10.5±0.12)%vol,总酯含量为(1.68±0.02)g/100 mL,有明显的枣香气,浓郁清新,酒体丰满醇厚,酸甜可口。

