miR-197结合HNRNPD的5’UTR区上调其蛋白表达
罗 婧,杨丝雨,吴 宇,王雨萌,郑煜芳,
(1.复旦大学 生命科学学院 发育生物学研究所, 上海 200433; 2.复旦大学附属妇产科医院, 上海 200011)
microRNA最早在1993年被报道发现[1],是一类长度为19~25nt的非编码小RNA.通常microRNA通过与靶基因mRNA的3’UTR互补配对抑制靶基因的翻译,降低其稳定性.已有研究表明,microRNA 5’端的种子序列(seed sequence)会和靶基因mRNA的3’UTR通过完全碱基互补配对形成microRNA诱导的沉默复合物(microRNA-Induced Silencing Complex, miRISC),该复合物会介导mRNA的切割和降解[2].而microRNA与3’UTR区段不完全的碱基配对则主要导致mRNA的翻译沉默[3].除了与3’UTR的常规相互作用外,最近的研究表明在转录后调控中microRNA也可以与靶基因mRNA的5’UTR区[4]或编码区(CDS)结合[5-6].
microRNA介导的基因调节在发育和疾病调控中都发挥了重要的作用.我们实验室前期工作发现,MECP2复制会上调miR-197,并促进大脑皮质发育中的神经发生[7].hsa-miR-197从1p13.3染色体转录,成熟的miR-197-3p具有22个核苷酸[8].miR-197直系同源基因仅在一些灵长类动物(人、恒河猴、西部大猩猩、侏儒黑猩猩、黑猩猩)和部分其他哺乳动物,包括牛、狗、马,山羊和兔子中被鉴定出,表明其在灵长类动物和这些哺乳动物中具有重要的作用.此外,miR-197还是包括人胶质母细胞瘤[9]在内的几种癌症的生物标志物[10].因此,我们在几种人类细胞中寻找hsa-miR-197-3p的潜在靶基因,包括人诱导多能干细胞hiPSC,人髓核细胞hNPC,人神经元,人胚胎肾细胞293T和人神经胶质瘤细胞U251.我们一共鉴定出9个在这些细胞中均高表达的潜在靶基因,qRT-PCR结果显示过表达miR-197的确可以下调大多数靶基因的表达,但是miR-197对异质核糖核蛋白D0基因(HNRNPD)的表达却有显著的上调作用.
HNRNPD也被称为富含AU的元件RNA结合蛋白1(AUF1),能结合许多原癌基因和细胞因子mRNA的3’UTR上的AU-Rich Elements(AREs)[11-12].由于在2号外显子或7号外显子上的可变剪接,HNRNPD有4种亚型,其分子量分别为p37,p40,p42和p45.这4种亚型具有不同的亚细胞定位: p37和p40可以在细胞核与细胞质间穿梭,但在细胞质中含量较多,而其他两个亚型仅分布在细胞核[11].所有4种亚型都可以通过与AREs结合介导mRNA的快速降解,其中p37具有最高的结合亲和力[13].此外,HNRNPD还可以通过结合靶基因的3’UTR区影响其翻译水平.小鼠核心生物钟基因Cry1的3’UTR区可以与HNRNPD结合,后者通过与翻译起始因子相互作用并募集40S核糖体亚基来启动Cry1的翻译[14].根据近期数据库的预测结果,人类基因组中约22%的基因在其3’UTR上包含至少一个ARE[15].因此,HNRNPD可能影响许多基因的表达.
在本研究中,我们发现miR-197不调控HNRNPD的3’UTR,而是通过5’UTR上调HNRNPD的表达.同时我们还发现,神经发育障碍(如自闭症和严重的智力障碍)相关基因中含有比全基因组中更高比例的ARE-mRNA.所以miR-197和HNRNPD在调节神经发育和相关疾病中可能具有重要作用.
1 材料和方法
1.1 材料
1.1.1 细胞、miRNA mimics、抑制剂及引物
293T和U251细胞系均从中国科学院上海细胞库获得.miR-197 mimics及其对照,miR-197抑制剂及其对照均购自Genepharma.在1 OD单链RNA oligo中加入125μL不含RNase的水制成20mmol/L溶液进行储存,工作浓度为50nmol/L.miR-197的引物和内参U6引物均购自Qiagen.
1.1.2 Ago2 shRNA
根据Ago2序列一共设计了3种shRNA,由和元生物有限公司将shRNA装入过表达载体并用慢病毒包装.具体5’-3’ shRNA序列如表1所示.

表1 Ago2 shRNA序列
1.2 方法
1.2.1 细胞培养
在DMEM培养基中培养293T和U251细胞,该培养基中添加了10%的胎牛血清(Gibco)和1%的青霉素-链霉素溶液(Beyotime Biotechnology).将细胞在37℃含5%CO2的潮湿培养箱中培养.
1.2.2 5种细胞miR-197潜在靶基因的GEO数据提取
从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)中提取了人诱导多能干细胞(hiPSC),人神经祖细胞(hNPC),人神经元,U251细胞和293T细胞的RNA-seq数据集.对每个数据集的前1000个富集基因进行提取,然后将每个细胞的靶基因的交集列表进行进一步分析.
GSM号码如下:
人iPSC: GSM2884932,GSM2884933,GSM2884934,GSM2884935,GSM2884968,GSM2884969,GSM2884970,GSM2884971.人NPC: GSM2127240,GSM2127241,GSM2127242,GSM2127245,GSM2127246,GSM2127247,GSM2127248.人神经元: GSM2884974,GSM2884975,GSM2884976,GSM2884986.U251细胞: GSM1681972,GSM1681973,GSM1681974.293T细胞: GSM3753369,GSM3755570.
1.2.3 细胞转染
1.2.3.1 脂质体转染
转染前一天将细胞传代后接种到10cm细胞培养皿中,待细胞密度到70%左右进行脂质体转染.将转染试剂和工作浓度为50nmol/L的miRNA或4μg质粒按照2∶1的比例混合并用500μL opti-MEM进行稀释,静置20min后,将上述混合溶液均匀滴加到细胞培养皿中.24h后收细胞.实验中涉及两种脂质体转染试剂: 单独转染miR-197 mimics或抑制剂及其对照时,用Lipofectamine RNAiMAX(Thermo fisher Scientific);共转染miR-197mimics或抑制剂及其对照和HNRNPD基因相关质粒时使用X-tremeGENE siRNA转染试剂(Roche).
1.2.3.2 病毒转染
转染前一天将细胞传代后接种到12孔板中,待细胞密度达到30%左右进行病毒转染,转染时根据不同病毒的滴度按MOI=10在细胞中加入对应的病毒,72h后收细胞.
1.2.4 RNA抽提和qRT-PCR
使用RNeasy Mini Kit(Qiagen)提取293T或U251细胞的总RNA.使用All-in-One TM miRNA qRT-PCR检测试剂盒(GeneCopoeia)进行miRNA逆转录和miR-197的qRT-PCR.使用带有gDNA Remover的ReverTraAce®qPCR RT预混液(Toyobo)进行mRNA反转录,并用SYBR®Green Realtime PCR预混液(Toyobo)进行mRNA的qRT-PCR.由于HNRNPD的所有4个转录本都具有相同的3’UTR和5’UTR区,因此设计的qRT-PCR引物对应所有4个转录本的共享序列.引物序列如表2所示.

表2 qRT-PCR引物列表
1.2.5 荧光素酶报告基因检测
将全长的HNRNPDmRNA 5’UTR或3’UTR序列克隆到质粒载体pGL3中以生成荧光素酶报告基因质粒.使用Q5聚合酶(NEB)通过定点诱变生成不同位点的突变体,并通过Sanger测序进行证实.通常microRNAs上存在一段连续的7~8mer种子序列,该序列可以与其靶基因通过碱基互补配对结合[16].因此,我们通过将HNRNPD上与miR-197种子序列互补配对的7mer区段突变了3~4个碱基获得了HNRNPD的突变型质粒.并注意避免产生其他microRNA新的结合位点.转染前一天将U251细胞以每孔1×105个细胞的数量接种在24孔板上,当细胞密度达到70%左右时进行miRNA、荧光素酶报告基因质粒以及Renilla表达载体的共转染.转染试剂为X-tremeGENE siRNA转染试剂(Roche),miRNA的作用终浓度为50nmol/L,每孔所加荧光素酶报告基因质粒和Renilla表达质粒分别为0.5μg和0.1μg.转染24h后检测荧光素酶活性(Dual-Luciferase®Reporter Assay System,Promega).荧光素酶信号通过Renilla进行标准化.
1.2.6 Western blot
提取6孔板内细胞时每孔加入150μL含有完整蛋白酶抑制剂(Roche)的RIPA(中等)蛋白裂解液(Beyotime)提取细胞蛋白,裂解处理后通过10%SDS-PAGE(Beyotime Biotechnology)进行电泳分离.一抗来自Abcam,包括Vinculin抗体(ab129002),HNRNPD抗体(ab61193)和Ago2抗体(ab186733).二抗为HRP标记的山羊抗兔IgG(Beyotime Biotechnology).计算蛋白相对表达量时用Vinculin作内参进行标准化,并用Image J量化蛋白表达水平.
1.2.7 Biotin-miRNA pull down
转染前一天将U251细胞传代后接种到10cm细胞培养皿中,待细胞密度到70%左右进行脂质体转染.每皿转染工作浓度为50nmol/L的带生物素(biotin)修饰的miRNA-197mimics.转染24h后收集全细胞裂解液,并添加磁珠以下拉带生物素标签的miR-197以及与其结合的RNA.洗脱后,通过qRT-PCR测定内源HNRNPD的mRNA表达水平.通过以下公式计算miRNA的富集: 相对mRNA结合倍数=(Bio miR-197 pull-down/Bio scramble pull-down)/(Bio miR-197 input/Bio scramble input).每个数据至少进行3组独立重复实验.荧光素酶mRNA引物从Genewiz订购,引物序列见表3.

表3 Luciferase引物列表
1.2.8 疾病相关基因提取
从以下几个数据库中提取不同疾病的相关基因: 自闭症相关基因来自AutDB的4星及5星基因[17-18].高血压相关基因来自http://bws.iis.sinica.edu.tw/THOD/.精神分裂症相关基因来自SZDB[19].癫痫相关基因来自http://carpedb.ua.edu/.所有其他与疾病相关的基因均来自OMIM(https://omim.org/).通过ARED-PLUS[15]筛选所有疾病相关基因的AREs mRNA百分比,并用卡方检验确定疾病和整个基因组中AREs mRNA的百分比是否有显著差异.
2 结果与分析
2.1 9个潜在靶基因中miR-197仅上调HNRNPD的表达
我们首先从miRDB[20]和targetscan[21]两个数据库中各自预测了miR-197的潜在靶基因,然后取交集.由于miR-197在神经干细胞分化和癌症中的作用,我们检查了预测的靶基因中有多少基因在hiPSC,hNPC,人神经元,U251细胞和293T细胞中是在前1000高表达的基因(图1(a)).我们将5种细胞分为两组,将各细胞中上述高表达基因中的预测靶基因取交集,每组获得了10个共有的高表达基因.这两组中有9个基因是5种细胞共有且高表达的.因此,我们将这9个基因作为的miR-197靶基因的候选基因,分别是APL6IP1,CAPRIN1,CBX3,HNRNPD,HNRNPR,NCL,PGK1,RAN,ST13(图1(b)).接着,我们用miR-197mimics或其对照转染293T细胞,转染24h后通过qRT-PCR检测miR-197对293T细胞中这些基因的影响.如图2所示,除了HNRNPD,所有这些靶基因的mRNA表达量都在miR-197mimics的作用下显著降低,只有HNRNPD的表达水平被miR-197上调.

图1 miR-197靶基因的预测

图2 miR-197潜在靶基因在293T细胞中表达的验证
2.2 miR-197可以在mRNA和蛋白水平显著上调HNRNPD的表达
我们用miR-197mimics或抑制剂(i-197)转染U251细胞以进一步确认miR-197对HNRNPD的作用.qRT-PCR结果表明在U251细胞中miR-197mimics显著提高了miR-197的表达水平,而i-197则对其进行了抑制(图3(a,b),第52页).随后,用qRT-PCR检测转染了miR-197mimics或抑制剂后U251细胞中HNRNPD的mRNA表达水平.结果表明,miR-197mimics可以上调HNRNPD的表达水平约3.5倍(图3(c),第52页).接着,我们用蛋白质印迹实验检测了细胞质中HNRNPD的蛋白质水平.与以前的报道类似,在细胞质中检测到HNRNPD p37和HNRNPD p40,而HNRNPD p37在U251细胞中的蛋白表达水平高于HNRNPD p40(图3(d),第52页).因此,我们统计了HNRNPD p37的蛋白表达水平.结果表明,miR-197mimics显著上调了HNRNPD p37的蛋白水平,而i-197则下调了HNRNPD p37的蛋白水平(图3(d)).

图3 miR-197在mRNA和蛋白水平上均上调HNRNPD的表达
2.3 miR-197通过5’UTR区上调HNRNPD表达
根据TargetScan数据库(7.2版)的预测,miR-197在HNRNPD的3’UTR上有一个8-mer的靶向结合位点(图4(a),第52页).因此,我们构建了包含3’UTR全长的野生型(3’UTR-WT)或突变型(3’UTR-MUT)荧光素酶报告质粒.突变型3’UTR在预测位点包含3个点突变(图4(a)).将miR-197mimics或抑制剂i-197与含HNRNPD3’UTR-WT或3’UTR-MUT的荧光素酶报告质粒共转染,结果显示miR-197mimics或者i-197对于含HNRNPD3’UTR野生型和突变型报告质粒的荧光素酶表达水平都没有显著影响(图4(b),第52页).因此,HNRNPD的3’UTR很可能不是miR-197的作用靶点.

图4 HNRNPD的3’UTR不是miR-197的作用靶点
据前言中所述,已有报道表明microRNA也可能与靶基因的5’UTR相互作用[20].因此,我们检查了HNRNPD的5’UTR序列,并根据RNAhybrid[22]中的自由能计算发现了4个可能的结合位点(图5(a),第53页).根据预测的结果,我们构建带有5’UTR全长的野生型5’UTR-WT和4种突变型5’UTR-MUT1~4(序列如图5(b~e),第53页)的荧光素酶报告质粒.将这些荧光素酶报告质粒和miR-197mimics或阴性对照共转染U251细胞.同样,miR-197显著上调了5’UTR-WT的荧光素酶相对表达水平(图5(f)).与5’UTR-WT相比,miR-197对HNRNPD的上调作用在MUT1中丢失(图5(f)),其他3个位点的突变对于上调作用有一定程度的削弱,但是没有MUT1显著.因此,荧光素酶检测结果表明miR-197是通过5’UTR而不是预测的3’UTR区和HNRNPD结合,而位点1是最重要的调控位点.

图5 miR-197作用于HNRNPD mRNA的5’UTR
2.4 miR-197通过互补配对直接结合HNRNPD mRNA的5’UTR区
为了验证miR-197是否能与HNRNPD的mRNA直接结合,我们利用带生物素标记的miR-197mimics(miR-197*)进行RNA pull-down实验,然后用miR-197*结合的RNA作为模板进行qRT-PCR实验.我们首先利用U251细胞的内源性RNA进行实验,结果表明,被miR-197mimics拉下的内源性HNRNPDmRNA为对照组的2.36倍(图6(a)).
为进一步确认HNRNPD与miR-197的结合位点,将HNRNPD3’UTR和5’UTR的荧光素酶报告基因在U251细胞过表达,然后进行RNA pull-down和qRT-PCR实验.这次qRT-PCR验证的是含有荧光素酶的mRNA,结果显示miR-197*只与含5’UTR的报告基因mRNA结合(图6(b)),而不与3’UTR报告基因的mRNA结合(图6(c)).为了验证之前5’UTR的位点一是否对于HNRNPD和miR-197的结合也很重要,我们进一步利用突变型荧光素酶报告质粒(5’UTR WT,5’UTR MUT1)与带生物素标签的miR-197 mimics共转染后进行RNA pull-down和qRT-PCR实验.结果表明,当HNRNPD的5’UTR位点1发生突变时,5’UTR MUT1丧失了与miR-197结合的能力(图6(b)).上述结果提示,miR-197是通过互补配对的方式直接结合HNRNPDmRNA的5’UTR.

图6 miR-197通过互补配对直接结合HNRNPD mRNA的 5’UTR
2.5 miR-197对HNRNPD蛋白的上调依赖于Ago2
在miRNA介导的基因激活中,Ago2是必不可少的[23].我们首先用3种不同的Ago2 shRNA转染U251细胞,发现均能显著下调AGO2的表达水平(图7(a,b)).
然后,我们使用其中Ago2-sh1和Ago2-sh2与miR-197mimics进行共转染.Western blot结果显示,此时只有Ago2-sh1对Ago2依然有下调作用(图7(c),(d)).有趣的是,当Ago2表达量显著降低时,miR-197失去了对HNRNPD的上调作用(图7(c),(e)).因此,miR-197对HNRNPD的上调是依赖于Ago2的.
3 讨 论
本项工作中,我们发现miR-197结合的是HNRNPD的5’-UTR序列.尽管有越来越多的生物信息学工具预测miRNA与5’UTR的相互作用[24],但通过实验证实microRNA通过5’UTR对靶向mRNA起上调作用的报道依然较少.在本研究之前,miRNA只通过5’UTR上调靶基因的报道仅有4例.除miR-122对丙型肝炎病毒的调控外[25-27],仅有miR-10a,miR-346和miR196b 3个miRNA被证实能够通过靶向结合5’UTR激活翻译.miR-10a通过与5’UTR结合来刺激核糖体蛋白mRNA的翻译[28].miR-346可以通过5’UTR上调RIP140的表达[29].miR-196b通过5’UTR上调Insulin2的表达[30].上述4个miRNA的这些报告均是miRNA通过5’UTR对靶基因mRNA进行翻译水平的调控.此外,只有一例报道证明miRNA可以同时下调靶基因的转录和翻译: miR-103a-3p可以靶向结合GPRC5A的5’UTR以下调其mRNA和蛋白质水平[31].我们的结果证明了miR-197可以同时上调HNRNPD的转录和翻译水平,并且miR-197对于HNRNPD翻译的上调是依赖于Ago2的.已知在RNA介导的基因沉默中,Ago2蛋白是沉默复合体(RISC)的核心组成部分.而在RNA介导的基因激活中,Ago2蛋白同样起到识别、招募小RNA形成复合物的作用[32].如受dsRNA上调的E-cadherin,p21和VEGF在敲除Ago2后,原有的RNA激活效应几乎被完全抑制[23].另一方面,对比不同哺乳动物(人、恒河猴、狗、马、山羊等)HNRNPD的5’-UTR序列,HNRNPD的5’-UTR区域在这些物种中具有高保守性,且miR-197靶向结合HNRNPD的5’-UTR位点1也相对保守,提示在这些物种中miR-197均可能对HNRNPD有调控作用.具体miR-197是如何上调HNRNPD的RNA水平的,则有待进一步深入研究.
另一个挑战是要了解HNRNPD和miRNA之间复杂的调控网络.HNRNPD不仅参与ARE-mRNA的降解,还参与调控miRNA的合成和其他功能.据报道,HNRNPD可以调节关键miRNA加工者DICER1的mRNA[33].此外,HNRNPD可通过帮助miRNA加载至Ago2来促进miRNA介导的基因沉默[34].但是,HNRNPD也可以与miRNA竞争结合3’UTR中的ARE,从而阻断miRNA的功能[35].研究中,我们证实miR-197可以上调HNRNPD,但HNRNPD是否可以对miR-197进行反馈调节,以及miR-197对其他mRNA和miRNA的影响有待进一步研究.
HNRNPD的生理功能目前还不是特别清楚.HNRNPD在胚胎的脑部有高表达[38-39],特别是在大鼠的大脑皮层发育高峰期[38].因此,HNRNPD很可能也参与了神经发育和相关疾病的调控.我们搜索了人遗传疾病公共数据库DECIPHER[40],发现其中共记录了34个携带HNRNPD的拷贝数变异(CNV)的临床样本,在这些样本中有23例(67.6%)患有严重的智力障碍、自闭症、整体发育迟缓或语言发育迟缓.
此外,已有研究发现HNRNPD可以促进mRNA快速降解[36],这一作用主要是通过与富含AU元件(AREs)的mRNA结合实现的[11,37].因此,我们还探索分析了一些主要神经发育障碍疾病的相关基因是否含有AREs以及含有AREs的基因所占的比例.我们从多个数据库AutDB[17-18]、SZDB[19]和OMIM中提取了与自闭症,严重智力障碍,语言发育迟滞,精神分裂症,癫痫病,神经管缺陷,先天性心脏病和高血压相关的核心基因.上述所有疾病相关核心基因均通过ARED-PLUS[15]筛查AREs mRNA的百分比,结果如表4所示.按ARED-PLUS之前的分析,全基因组中约有22%的基因含有AREs[15].而在119个自闭症相关基因中,有52个(43.7%)含有ARE,几乎是全基因组水平的2倍.此外,在其他几种神经发育障碍中,包括严重智力障碍、语言发育迟滞相关基因中,含有AREs的基因比例也显著高于全基因组.
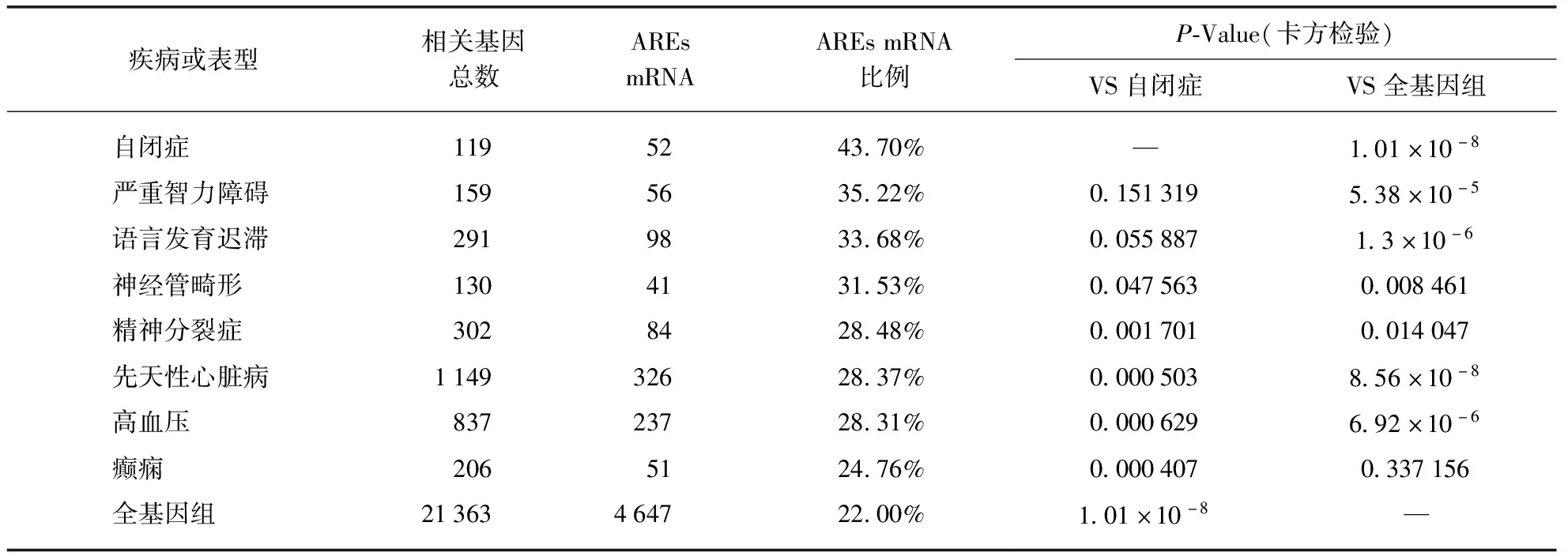
表4 AREs-mRNA在各疾病相关基因中所占的比例
因此,HNRNPD基因异常和其调控异常很可能与神经发育障碍疾病相关.虽然HNRNPD基因敲除的小鼠模型表型为炎症反应失调,而没有明显的神经系统缺陷[41].但是,DECIPHER数据库中大多数携带HNRNPD的CNV的人类患者具有严重的神经发育障碍.这种差异可能是由于动物模型不够准确以及人脑的结构和功能比小鼠更复杂导致的.因此,后续需要对人群的HNRNPD进行更多的遗传学研究,以充分了解其在人脑发育中的功能.

