未产卵雌性黄鳝的性转变
范 淼 杨 威 孙 数 李 忠 张利红* 张为民*
(1.中山大学生命科学学院水生经济动物研究所, 广州 510275; 2.仙桃市忠善黄鳝工厂化繁育基地, 仙桃 433012;3.中国水产科学研究院长江水产研究所, 武汉 430223)
脊椎动物性别决定和分化发育机制一直是生物学研究热点。目前研究表明, 脊椎动物性别决定方式包括基因决定性别和环境因素决定性别, 性别分化方向呈现可塑性[1]。鱼类具有雌雄异体和雌雄同体等多种性别表现形式, 性别分化可塑性高, 是研究脊椎动物性别决定和分化发育的良好模型。同时, 很多鱼类在生长和体型等方面呈现性别二态型, 通过性控育种实现单性化养殖将产生重大的经济效益[2,3], 而鱼类性别决定和分化机制研究是实现鱼类性控育种的基础。
黄鳝(Monopterus albusZuiew)隶属合鳃鱼目,合鳃鱼科, 黄鳝属, 是目前我国重要的特色淡水养殖鱼类, 在湖北、安徽和湖南等地广泛养殖。但是,黄鳝养殖的苗种仍主要是人工捕获的野生黄鳝。由于过度捕捞, 近年来黄鳝自然资源日益减少, 严重影响黄鳝规模化人工养殖业的可持续发展。早在1944年, 我国脊椎动物性别决定研究先驱刘建康先生发现黄鳝是一种雌性先熟的性转变鱼类[3]。由于幼体阶段性腺分化发育的单向性(雌性)和成体阶段性腺自然可塑性(雌性转变为雄性), 黄鳝已成为研究脊椎动物性别分化发育机制的重要鱼类模型[4]。黄鳝自然性转变规律和调控机制的阐明不仅具有很高的理论价值, 也将为其规模化人工繁育技术研发提供重要的支撑。
Liu[5]通过分析在重庆北碚野外采集的黄鳝性腺组织学结构及其性别比例, 首次提出黄鳝具有自然性转变现象。随后, Liem[6]分析了印度尼西亚万隆地区野外捕获和实验室养殖的黄鳝性腺组织学结构和性别比例, Chan和Phillips[7]分析了中国香港和广东地区的黄鳝性腺组织学结构和性别比例, 这些研究都证实了黄鳝存在自然性转变。Chan等[8]通过活体解剖技术跟踪同一条黄鳝性腺组织学变化, 进一步直接证实了黄鳝存在自然性转变。雄性黄鳝都是从雌性黄鳝通过间性阶段转变而来, 没有发现雄鱼再转变为间性或雌性的现象[6,8]。
在黄鳝卵巢向精巢转变时, 最早出现的组织结构变化是生殖褶增厚, 并在生殖褶内围出现零星的雄性生殖细胞; 随着雄性生殖细胞的增殖和雌性生殖细胞的退化, 最终卵巢被精巢所取代, 雌性黄鳝转变为雄性黄鳝[9]。关于雌性黄鳝在什么发育阶段开始性转变, 有些学者认为是在雌鳝性成熟产卵后发生[5,7,10—12]。通过分析年龄、体长和体重等与黄鳝性转变的相关性, 发现黄鳝性别与年龄和体长关系较密切[13]。有研究表明, 雌性黄鳝2龄后开始性转变[6,13]。由于生存环境和/或地理位置的不同, 不同地区的黄鳝发生性转变时体长不同, 印度尼西亚万隆地区黄鳝在体长为16 cm左右时开始性转变[6],中国香港和广东地区的黄鳝在体长为20 cm左右时开始性转变[7], 中国天津地区的黄鳝在体长为40 cm左右时发生性转变[14]。
增殖细胞核抗原(Proliferating cell nuclear antigen, 简称PCNA)是真核细胞DNA合成所必需的一种核蛋白。在细胞增殖过程中, PCNA表达量在G1晚期开始上升, S期达到高峰, G2期下降[15,16]。PCNA作为细胞增殖的分子标记, 常用于分析鱼类性腺细胞的增殖。美洲花鳝(Synbranchus marmoratusBloch)是一种先雌后雄的性转变鱼类, 其性转变早期性腺结缔组织中Leydig细胞的PCNA免疫活性很高[17]。在孵化180d的黑棘鲷(Acanthopagrus schlegeliiBleeker)早期精巢中, 发现生殖细胞中有PCNA免疫阳性信号[18]。本文分析了实验室内从受精卵或幼苗开始养殖至不同时段的黄鳝性腺发育状况, 并对性腺进行了PCNA免疫组织化学分析, 旨在阐明黄鳝性转变的基本规律, 以及间性性腺中各种细胞增殖与性转变的关联。
1 材料与方法
1.1 实验黄鳝及其饲养
5月龄黄鳝为仙桃市忠善黄鳝工厂化繁育基地(湖北仙桃)2019年7月孵出的黄鳝苗, 于2019年9月运回本实验室(广东广州)饲养; 12月龄和34月龄黄鳝分别为本实验室于2018年5—6月和2016年5—6月孵化的黄鳝苗养成。在自然光照和温度条件下, 参照何智等[19]报道的方法, 实验室内黄鳝饲养于直径为 80 cm 的塑料盆中, 投喂生物饵料(先期为水蚯蚓, 5月龄后为黄粉虫), 投喂量约为体重的5%。养殖盆中放置1—2条灰色塑料管(直径6.5 cm,长度37 cm), 以便黄鳝藏匿, 模仿其生态习性。每天换水, 并根据生长情况适时分盆, 控制养殖密度[20]。5月龄和12月龄黄鳝一直饲养在实验室内, 34月龄黄鳝在性腺活检手术前1个月转移至室外水泥池(1 m×1 m×1 m)中饲养。在整个饲养和实验过程中,每天上、下午观察和记录黄鳝生存状态。
1.2 黄鳝性腺样品的采集和分析
通过性腺活检手术[8]获得黄鳝性腺样品。黄鳝肠道位于腹腔的腹面, 肾脏位于腹腔的背面, 紧贴背壁, 性腺位于肠道与肾脏之间, 呈管状, 以肠系膜与肠道相连。黄鳝性腺活检手术基本操作如下: 使用麻醉剂MS-222(500 mg/L; Sigma, A5040, MO,USA)麻醉实验黄鳝。将麻醉后的黄鳝置于实验台,腹面朝上, 用碳钢手术刀片(11号; 上海浦东金环医疗用品股份有限公司, 中国上海)于麻醉黄鳝泄殖孔前0.3—0.5 cm处腹中线偏右上方纵向开口0.5—1 cm, 小心把性腺与肠系膜剥离, 剪取适量性腺样品后, 于腹腔内埋植经75%酒精消毒的电子标签(广州市洪腾条码技术有限公司, 中国广州), 然后用Δ1/2医用缝合针(6×14; 巢湖市宾雄医疗器械有限公司, 中国安徽)和非吸收型外科缝合线(4-0; 扬州源康医疗器械有限公司, 中国江苏)缝合伤口, 一般缝合3—5针即可。在缝合处涂抹红霉素药膏(广东恒建制药有限公司, 中国广东)后, 将术后黄鳝置于曝气水中苏醒。如要对同一条黄鳝个体进行多次活检手术, 下一次手术是在上一次手术位置前(头部方向)1—2 mm处实施。
30条5月龄黄鳝[体重(15.3±2.9) g, 体长(25.7±1.2) cm]于2019年12月间进行性腺活检手术; 17条12月龄黄鳝[体重(9.1±3.1) g, 体长(20.3±2.5) cm]和94条34月龄黄鳝[体重(25.5±9.1) g, 体长(30.5±3.7) cm]于2019年3—5月间进行性腺活检手术。于2019年3—4月间, 对94条34月龄黄鳝中的36条雌鱼[体重(20.8±6.7) g, 体长(29.2±3.4) cm]性腺发育进行了为期1个月的跟踪研究。
通过性腺活检手术剪取长约0.5 cm黄鳝性腺组织, 置于波恩氏液中固定24h, 然后按常规石蜡组织学切片流程处理。切片厚度为 4—5 μm, 苏木精-伊红(HE)染色, 中性树胶封片, 使用Nikon显微镜(E800, Nikon, Japan)进行观察和拍照。
1.3 PCNA免疫组织化学定位
黄鳝性腺组织石蜡切片经脱蜡和水化后, 用3%过氧化氢(无水甲醇∶30%过氧化氢∶ddH2O=8∶1∶1, 现配现用)在室温下处理15min, 灭活内源性过氧化物酶; 用PBS(137 mmol/L NaCl, 2.7 mmol/L KCl, 10 mmol/L Na2HPO4, 2 mmol/L KH2PO4; pH=7.4)浸洗3次(每次5min)后, 组织切片放入预热(95℃)的0.01 mol/L柠檬酸盐缓冲液(pH= 6.0)处理15min, 进行抗原修复; 取出玻片放凉至室温后, PBS浸洗3次(每次5min), 滴加适量的正常山羊血清, 在室温湿润的条件下孵育30min, 封闭非特异性结合位点; 在封闭后的切片上滴加PCNA即用型抗体(MAB-0145鼠单抗, 克隆号PC10, 福州迈新生物科技有限公司, 中国), 4℃过夜孵育, 再于室温下孵育3h。在一抗孵育完后, 用PBS浸洗切片3次(每次5min), 滴加适量免疫组化信号放大剂(EliVisionTMSuper, KIT-9922,福州迈新生物科技有限公司), 室温孵育15min, 经PBS浸洗3次(每次5min), 再滴加适量高敏型酶标抗鼠/兔聚合物(EliVisionTMSuper, KIT-9922, 福州迈新生物科技有限公司), 室温孵育15min后, PBS浸洗3次(每次5min), DAB(DAB-1031, 福州迈新生物科技有限公司, 中国)显色。阴性对照以PBS代替PCNA抗体, 其余操作一致。用Nikon显微镜(E800,Nikon, Japan)观察切片和拍照。
1.4 数据处理
实验黄鳝体重和体长等生物学参数采用SPSS统计软件进行分析。数据表示为平均值±标准差(Mean±SD)。
2 结果
2.1 未经产卵过程的间性和雄性黄鳝
实验所用黄鳝是从幼鱼(指5月龄鱼)或受精卵(指12月龄和34月龄鱼)开始饲养, 每天记录生活状况。在饲养过程中, 未发现有任何雌鳝发育至腹部膨大呈半透明状态, 也未观察到养殖盆中有黄鳝卵粒或吐泡筑巢行为, 因此判断实验黄鳝没有经历产卵过程。
用石蜡组织切片和HE染色技术, 分析30条5月龄、17条12月龄和94条34月龄黄鳝的性腺发育状况。结果表明, 在5月龄黄鳝中, 雌性占比66.7%, 间性占比13.3%, 雄性占比20.0%(图1和表1); 在12月龄黄鳝中, 雌性占比82.4%, 雄鱼占比17.6%(图2和表1); 在34月龄黄鳝中, 雌性占比78.7%, 间性占比12.8%, 雄性占比8.5%(图3和表1)。
不同年龄段黄鳝的性别与其个体大小关系分析表明, 在5月龄和34月龄的黄鳝中, 间性和雄性个体较雌性偏大(图4A和4C), 但12月龄黄鳝中雄性个体较雌性偏小(图4B)。
2.2 三龄雌鳝不经产卵过程发生性转变现象
对94条34月龄黄鳝中的36条雌性黄鳝性腺发育进行了跟踪研究。结果表明, 在1个月的跟踪实验过程中, 30条雌鳝依旧为雌性(图5A2和A2’), 但有6条雌鳝变成为间性(图5B2和B2’), 性转变发生比例为16.7%。在黄鳝间性性腺中, 生殖褶增厚, 出现间质细胞, 及早期雄性生殖细胞包括精原细胞和精母细胞(图5B2’)。
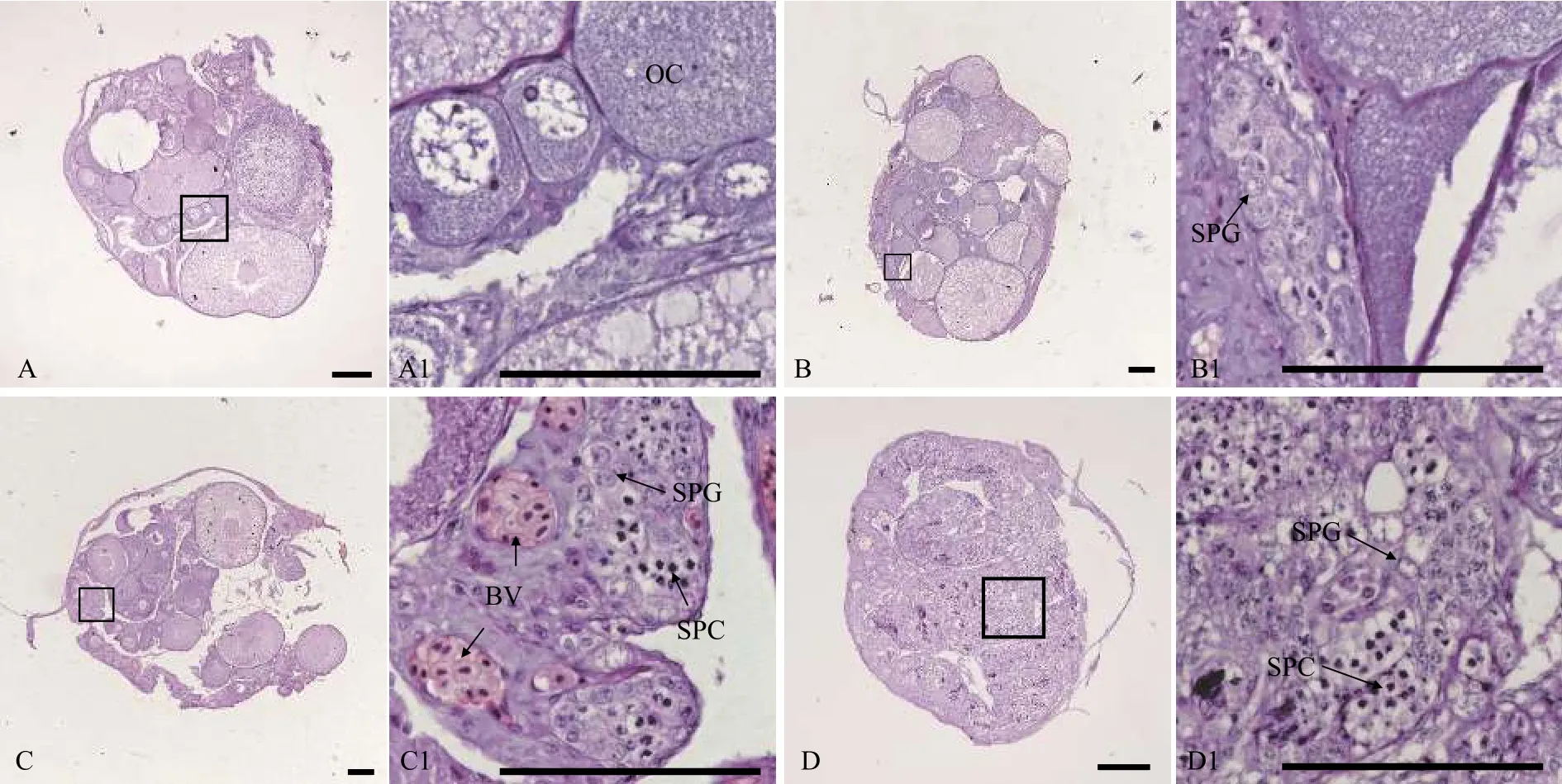
图1 五月龄黄鳝的不同性别状态性腺组织结构Fig.1 Gonadal histology of 5-month-old ricefield eels of different sexual stages
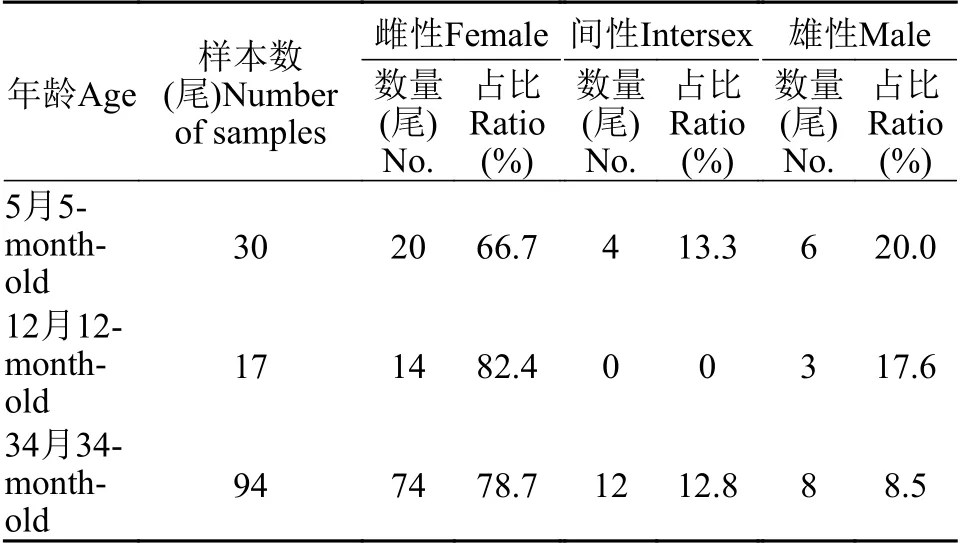
表1 不同年龄段黄鳝的性别比例Tab.1 Sex ratios of ricefield eels at different ages
2.3 黄鳝性转变过程中性腺PCNA免疫组织化学分析
对同一黄鳝个体的不同发育阶段的性腺进行PCNA免疫组织化学分析, 结果表明, 在卵黄发生期黄鳝卵巢中, 卵母细胞的细胞核及其外周部分滤泡层细胞核具有明显的PCNA免疫阳性信号(图6A1);卵巢中生殖褶很薄, 仅见个别细胞的细胞核具有PCNA免疫阳性信号(图6A2)。
在间性早期黄鳝性腺中, 除卵母细胞的细胞核及其外周部分滤泡层细胞核可观察到明显的PCNA免疫活性信号(图6B1)外, 增厚的生殖褶中也出现明显的PCNA免疫信号。这些PCNA免疫信号主要分布在生殖褶两类细胞, 其中一类为间质细胞, 另一类为雄性生殖细胞, 包括精原细胞和初级精母细胞(图6B2)。
在间性晚期黄鳝性腺中, 退化卵母细胞上未见PCNA免疫信号(图6C1), 增厚的生殖褶中可见不同发育阶段的雄性生殖细胞, 其中精原细胞和初级精母细胞有明显的PCNA免疫信号(图6C2), 部分间质细胞上也有PCNA免疫信号, 但次级精母细胞上未观察到PCNA免疫信号(图6C1和C2)。
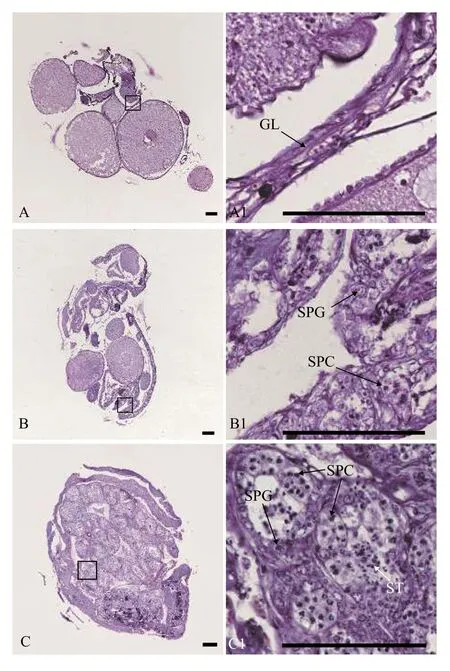
图3 34月龄黄鳝的不同性别状态性腺组织结构Fig.3 Gonadal histology of 34-month-old ricefield eels of different sexual stages
以PBS代替PCNA抗体, 免疫组织化学分析结果表明, 黄鳝性腺切片中未呈现任何免疫阳性信号(图6D1和D2), 提示上述黄鳝性腺切片中PCNA免疫信号具有特异性。
3 讨论
3.1 黄鳝性转变与年龄、体长、体重的关系
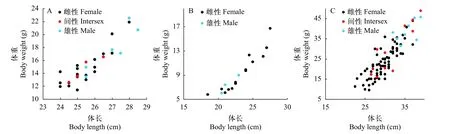
图4 不同年龄段黄鳝的性别与体重和体长的关系Fig.4 The relationship between sex, body weight, and body length of ricefield eels at different ages
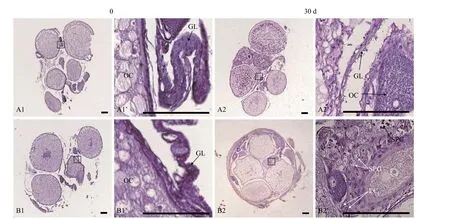
图5 两条34月龄黄鳝的性腺组织结构在跟踪1个月前后的对比Fig.5 Tracing for gonadal changes of two 34-month-old ricefield eels in a one-month period
已有研究表明, 黄鳝在2龄之前都为雌性, 2龄后开始性转变[6,13]。本文分析了实验室内从受精卵或幼苗养殖至不同年龄黄鳝的性腺发育状况, 发现在5月龄黄鳝中就存在有间性和雄性个体, 提示实验室内养殖的黄鳝在5月龄之前就已经开始性转变,比之前的报道至少提前了1.5年。
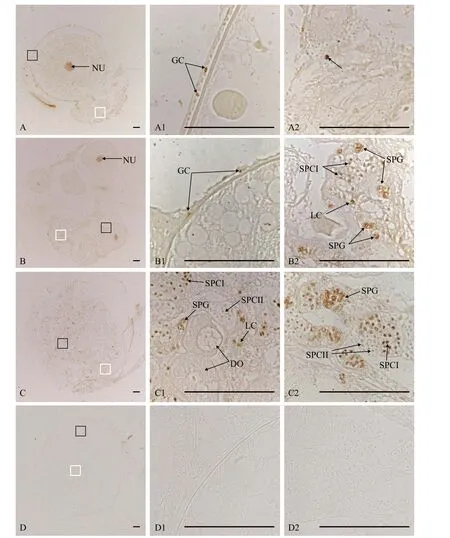
图6 黄鳝性转变过程中性腺PCNA免疫组织化学分析Fig.6 PCNA immunohistochemistry in gonads of ricefield eels during sex change
在实验室养殖的5月龄、12月龄和34月龄的黄鳝中, 都有一定比例的不同性别的个体, 表明在同一个群体中黄鳝性转变年龄存在个体差异。刘修业等[13]也发现3—5龄黄鳝性别处于过渡期, 性别过渡期达2年之久。那么, 黄鳝在什么年龄完成性转变, 即在什么年龄全部变为雄性? 对于这个问题, 目前仍没有定论。王良臣等[14]在野外采集的6龄和7龄黄鳝样品中没有发现雌性和间性个体, 全部为雄性。但是, 本实验室有3条养殖8年的黄鳝, 其性腺仍处于间性阶段(数据未显示)。这些不同研究之间黄鳝性别与年龄关系的差异可能是因为实验黄鳝生存环境不同所致, 而同一群体中黄鳝个体性转变年龄的差异可能是由遗传因素所决定的[8]。
除年龄外, 黄鳝性别与体长关系也比较密切[13]。与其他研究类似, 本研究表明, 在5月龄和34月龄黄鳝中, 间性和雄性个体较雌性个体偏大。在5月龄和34月龄黄鳝中, 间性黄鳝最小个体体长分别为24.5和26.5 cm, 比较接近鄱阳湖和洞庭湖黄鳝性转变的临界体长30 cm[21,22]和粤港地区黄鳝性转变临界体长20 cm[7], 而与天津[14]和信阳地区[23]黄鳝性转变临界体长(40.0 cm 左右)差异较大。与万隆地区黄鳝性转变临界体长(16 cm左右)[6]也差异较大。这些不同地区黄鳝性转变临界体长差异可能与所在区域的纬度和气候条件相关, 低纬度地区, 黄鳝生长发育较快, 性成熟早, 发生性转变也早, 性转变时体长也较小[11]。
本研究所观察的12月龄黄鳝的体重和体长比5月龄偏小, 这可能是由于这批黄鳝在7月龄时发生疾病, 出现大规模死亡现象, 摄食和生长都受到严重影响。与5月龄和34月龄雄性黄鳝不同, 12月龄黄鳝的雄性个体较雌性偏小, 导致这些12月龄雄性黄鳝个体偏小的原因目前仍不清楚。Chan和 Phillips[7]曾报道有一些小个体的雌性黄鳝卵巢中卵母细胞数量少, 并有明显的精巢组织出现, 推测它们的雌性阶段很短。因此, 由这些小个体的雌鱼性转变产生的雄鱼, 其个体也应该偏小。
3.2 产卵并非雌鳝性转变的必经事件
研究者通常认为, 雌性黄鳝的性转变是在经过一次或多次性成熟产卵后发生的[7,11,24,25]。本研究分析了实验室内从受精卵或幼苗养殖至不同年龄黄鳝的性腺发育状况。在养殖过程中, 没有发现黄鳝有产卵现象或繁殖行为。前期研究表明, 实验室内养殖的雌性黄鳝1龄时可发育至性成熟[19]。这些实验室内养殖的雌性黄鳝之所以不产卵, 可能是由于室内养殖条件不适合其产卵和繁殖。性腺组织切片结果表明, 在94条34月龄黄鳝中, 有12条间性个体, 占比12.8%; 30条5月龄黄鳝中, 有4条间性个体, 占比13.3%, 这些结果提示, 雌性黄鳝不经过产卵过程也可以发生性转变。另外, 本研究对36条34月龄雌性黄鳝的性腺发育进行了跟踪观察, 发现16.7%的黄鳝在这一跟踪过程中发生性转变, 进一步表明, 产卵并不是雌性黄鳝性转变必须要经历的事件。
就目前所掌握的资料来看, “黄鳝产卵后性转变”的观点最早由Chan和Phillips[7]于1967年提出的。但是, 早在1963年, Liem[6]从黄鳝受精卵孵化出黄鳝幼苗后养殖, 第30个月取样时发现有雌性和间性黄鳝个体, 第36个月时取样发现有雌性、间性和雄性黄鳝个体。但是, 该论文没有说明这些30月龄的间性黄鳝是否在实验室内经历了产卵过程, 因此, 不能判断产卵过程是否是黄鳝性转变必经事件。在2004年, 周秋白等[21]报道, 怀卵未产雌鳝经过1周年饲养后有11%的个体转变为间性。这些结果似乎与“黄鳝产卵后性转变”的观点不一致。但是, 该论文并没有提供这些怀卵未产雌鳝的生物学参数和年龄等信息, 也没有提及这些怀卵未产雌鳝是否初次性成熟, 之前的年份是否曾经历产卵过程,因此, 论文的讨论部分并没有对“黄鳝产卵后性转变”的观点提出质疑[21]。
那么, 雌性黄鳝产卵后是否就进入间性阶段发育? 答案是否定的。周秋白等[21]发现, 已产卵黄鳝在第二年的雌性比例仍占51.1%。因此, 雌性黄鳝产卵过程与性转变启动并没有必然的因果关联。
黄鳝性转变的诱因目前仍不清楚。研究表明,环境因素如温度和社会等级变化等影响鱼类性别决定和分化[26,27]。应激激素皮质醇可能介导了温度诱导鱼类雄性化和社会行为诱导雌雄同体鱼类性转变的过程[28]。在雌性先熟的性转变鱼类斜带石斑鱼中, 腹腔注射皮质醇可诱导其从雌性转变为雄性[29]。因此, 有关环境因素和皮质醇等与黄鳝性转变的关联值得进一步探讨。
3.3 黄鳝是否有原发性雄性
研究发现, 同属合鳃目的美洲花鳝也具有先雌后雄的性转变现象, 这种鱼的雄性有2种来源, 即原发性雄性(不经雌性阶段直接发育为雄性)和次发性雄性(雌鱼经性转变发育成雄鱼)[17,30]。次发性雄鱼精巢是在卵巢结构基础上改造而来, 因此精巢为单个, 但是原发性雄鱼精巢是成对存在的[17]。
在黄鳝种群中, 是否存在原发性的雄性可能因地理位置而异。Liem[30]报道, 在泰国、马来西亚沙捞越、马来半岛和日本冲绳的黄鳝样品中发现原发性雄性, 而在印度尼西亚万隆、日本Uda River和中国北碚的黄鳝样品中没有发现原发性雄性。与美洲花鳝原发性雄性一样, 黄鳝原发性雄性的精巢也是成对存在, 由两个精巢叶和连接两者的结缔组织构成, 结缔组织中央有一条精巢静脉, 两侧各有一条输精管, 分别与两侧的精巢叶对应; 而次发性雄性黄鳝的精巢保留了卵巢的解剖结构, 原来的卵巢腔转变为精巢的输精管, 原来的输卵管的空间仍存在, 但可能在精巢中不行使功能。
Chan和Phillips[7]报道了香港和广东地区的黄鳝精巢有2种结构类型, 一种为full-cord, 另一种为half-cord。前者整个生殖褶充满精巢小叶, 而后者精巢小叶仅分布在生殖褶内侧。尽管Liem[30]推测含full-cord精巢的黄鳝为原发性雄性, 但是这种推测似乎缺乏证据, 因为Chan和Phillips[7]在文中并没有提出half-cord和full-cord两种精巢在解剖结构上有任何差异。
本研究在5月龄和12月龄黄鳝中都发现雄性个体, 占比分别为17.6%和20.0%, 比例较接近。组织切片分析表明, 这些雄性个体精巢中没有任何退化的卵母细胞, 但解剖结构上与卵巢类似, 即有2条生殖褶, 2个性腺内腔及一个性腺外腔[8], 这与Liem[30]所描述的黄鳝原发性雄性精巢结构不同。因此, 本研究推测这些5月龄和12月龄雄性黄鳝也可能是通过性转变所产生的, 其性转变发生在卵巢发育早期阶段。当然, 另一种可能性也不能完全排除, 即这些5月龄和12月龄雄性黄鳝是原发性的雄性, 特别是12月龄的雄性黄鳝, 其个体较雌性黄鳝偏小, 与雌性转化为雄性的自然性转变过程中个体大小变化趋势存在矛盾。如果这些雄性黄鳝是原发性雄性, 那么其精巢的早期发生与卵巢类似, 而与Liem[30]所描述的黄鳝原发性雄性不同。因此, 中国本土黄鳝是否存在原发性雄性仍需进一步探讨。
3.4 黄鳝性转变过程中精巢组织细胞的发生
黄鳝从雌性转变为雄性的过程是性腺中的卵巢组织不断被精巢组织所取代的过程[7], 因此性转变过程伴随着精巢组织体细胞和生殖细胞的增殖。黄鳝精巢体细胞和生殖细胞发生于性腺生殖褶内侧, 其中的性原细胞(Gonocyte)在雌性阶段就已存在, 性转变开始时, 这些性原细胞增殖, 产生精原细胞, 同时间质细胞也分化发育, 形成Leydig细胞[7,8]。在黄鳝间性早期性腺增厚的生殖褶中, 本研究也观察到早期雄性生殖细胞包括精原细胞和精母细胞, 及精巢间质细胞。这些间质细胞呈卵圆形, 染色质浓缩, 与核膜相邻, 存在于精小囊之间[31]。但是, 由于缺乏相应细胞的分子标记, 黄鳝间性性腺中性原细胞、精原细胞和间质细胞等的鉴定主要依据细胞形态和细胞在组织中所处的位置, 黄鳝性逆转初期性腺组织细胞学变化仍很不清晰。
增殖细胞核抗原(Proliferating Cell Nuclear Antigen, 简称PCNA)是真核细胞DNA合成所必需的一种核蛋白, 在不同物种间具有高度的保守性, 已被用作多种组织中细胞增殖的生物标志物[32—34]。本研究应用免疫组织化学方法, 分析了卵巢、间性早期和间性晚期黄鳝性腺中PCNA免疫活性分布。发现PCNA免疫活性信号分布在黄鳝卵巢和间性早期性腺的卵母细胞, 间性晚期性腺的精原细胞和初级精母细胞等生殖细胞, 及卵巢中部分颗粒细胞中,这与上述这些性腺细胞具有较强的增殖能力相一致, 进一步提示商品化的PCNA抗体可用于分析黄鳝性腺细胞增殖。
在间性早期黄鳝性腺的生殖褶中, 除精原细胞和初级精母细胞为PCNA免疫阳性外, 精巢间质细胞也含有PCNA免疫阳性信号。在美洲花鳝性转变早期的性腺结缔组织中, 精巢间质细胞也呈现很强的PCNA免疫信号[17]。这些结果提示, 精巢间质细胞和精原细胞的增殖可能与黄鳝性转变的启动密切相关。但是, 这些间质细胞和精原细胞的起源仍有待进一步研究。因此, 黄鳝性转变早期性腺中精巢体细胞和生殖细胞相关分子标记的开发, 结合PCNA免疫组化分析, 将能更好地揭示这些精巢体细胞和生殖细胞的动态变化, 有助于阐明黄鳝性转变调控机制。
致谢:
感谢中山大学生命科学学院崔鑫、李曦、张澜馨、刘敏琦、何智、许星和张有为同学协助实验黄鳝饲养管理。

