饲料脂肪水平对杂交鲟幼鱼生长、饲料消化率、抗氧化水平和肌肉脂肪酸组成的影响
邢 薇 郁欢欢 于凤祥 刘 洋 李铁梁 马志宏 姜 娜 罗 琳
(1.渔业生物技术北京市重点实验室, 北京市水产科学研究所, 北京 100068; 2.北京京朝花园农业发展中心, 北京 100018)
鲟隶属于硬骨鱼纲、鲟形目, 是现存最古老、体型最大的一种鱼类, 素有“水中活化石”之称。鲟肉质鲜美, 鲟卵制成的鱼子酱更有“黑色黄金”之称。因其具有生长速度快、营养价值和经济价值高等特点, 鲟已成为世界上重要的经济鱼类[1,2]。西伯利亚杂交鲟(Acipenser baeriiBrandt ♀ ×A.schrenckiiBrandt)是以西伯利亚鲟为母本(♀), 施氏鲟为父本()获得的优良杂交品种, 是我国主导的鲟养殖品种[3,4]。
脂肪是鱼类的重要能量来源, 饲料配方中脂肪的合理利用不仅能够节约蛋白质, 还能够降低饲料成本、减少氮的排放。据了解, 国内鲟的商业饲料主要参考鲑鳟的饲料配方[5]。而鲑鳟为冷水性鱼类, 配方中的脂肪含量偏高, 约为20%—30%[6—8]甚至高达47%[9]。饲料中过高的脂肪水平会给鱼类造成多种负面影响, 如抑制鱼类摄食进而导致生长迟缓[10—12]、鱼体脂肪过度沉积进而影响鱼类健康和肉品质等[13,14]。因此, 明确鲟的脂肪需求, 是其养殖产业可持续发展的必要条件之一。目前, 关于鲟脂肪需求的研究已有一些报道。Zhu等[15]用5%、15%和25%三种脂肪含量的饲料投喂俄罗斯鲟(A.gueldenstaedtii)后发现, 当饲料中的脂肪含量为25%时, 俄罗斯鲟获得最优生长性能。而刘阳洋等[16]发现, 当饲料中脂肪水平为7.88%时, 匙吻鲟[Polyodon spathula, 初始体重(81.38±0.14) g]的SGR达到最大值。施氏鲟(A.schrenckii)幼鱼[初始体重(111.39±14.63) g]的适宜脂肪水平则处于俄罗斯鲟和匙吻鲟之间, 为17%[17]。以上结果说明, 不同品种的鲟对饲料中脂肪的需求量是不同的。但是目前, 缺乏西伯利亚杂交鲟适宜脂肪水平的相关报道。鱼油是水产饲料中最重要的脂肪源。与其他动植物油脂相比, 鱼油中含有丰富的必需脂肪酸n-3高不饱和脂肪酸(High unsaturated fatty acid, HUFA), 尤其是二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)。本实验室在前期研究中发现, EPA和DHA在促进鲟生长发育、改善代谢和维持鱼类健康等方面有重要作用[18,19]。本研究以鱼油为脂肪源, 配制4种脂肪水平分别为5%、10%、15%和20%的等氮饲料, 探究不同脂肪水平对西伯利亚杂交鲟生长性能、饲料消化率、抗氧化及肌肉脂肪酸组成的影响, 以期找到杂交鲟饲料中较为适宜的脂肪添加水平, 从而更好地为杂交鲟的饲料生产提供参考。
1 材料与方法
1.1 饲料配方与制备
本研究以鱼粉和豆粕为主要蛋白源, 以鱼油为脂肪源, 设计粗脂肪含量分别为5%、10%、15%和20%的4种等氮饲料。采用双螺杆挤压膨化工艺(MY56X2A, 牧羊集团, 江苏, 中国)制成3.0和4.0 mm两种不同粒径实验饲料, 以满足实验鱼的摄食需要。所有饲料晾干后于-20℃保存备用。饲料组成及营养水平见表1。饲料中脂肪酸含量见表2。
1.2 实验鱼及养殖条件
本养殖实验在北京京朝花园农业发展中心的工厂化循环水养殖车间进行。实验鱼为该中心自行繁育的同批次的统一规格西伯利亚杂交鲟。在停食24h后, 初始体重为(152.83±0.67) g的实验鱼(25尾/缸)被随机的分配到12个圆柱形玻璃纤维缸(直径2.0 m, 高0.5 m)中, 每种饲料设3个重复, 每天饱食投喂3次(09:30、13:30和17:30), 养殖周期为12周。在养殖过程中, 水温为(20±1)℃, pH为7.5—8.0, 溶氧在7.0 mg/L左右, 氨氮和亚硝酸盐含量均低于100.0 μg/L。
1.3 样品采集
为排除鱼体肠道内原有粪便对实验的干扰, 实验1周后开始收集粪便。因为鲟为底部摄食, 所以实验采用平底的圆形玻璃纤维缸, 用泥蟹的方法收集粪便[21]。每次饱食投喂0.5h后人工收集有完整膜包裹着的新鲜粪便。转入小铝盒内, 保存于-20℃,以免粪样分解变质。收集满一盒后置于烘箱75℃下烘干用于检测干物质、蛋白、脂肪及能量的表观消化率(Apparent digestibility coefficient, ADC)。
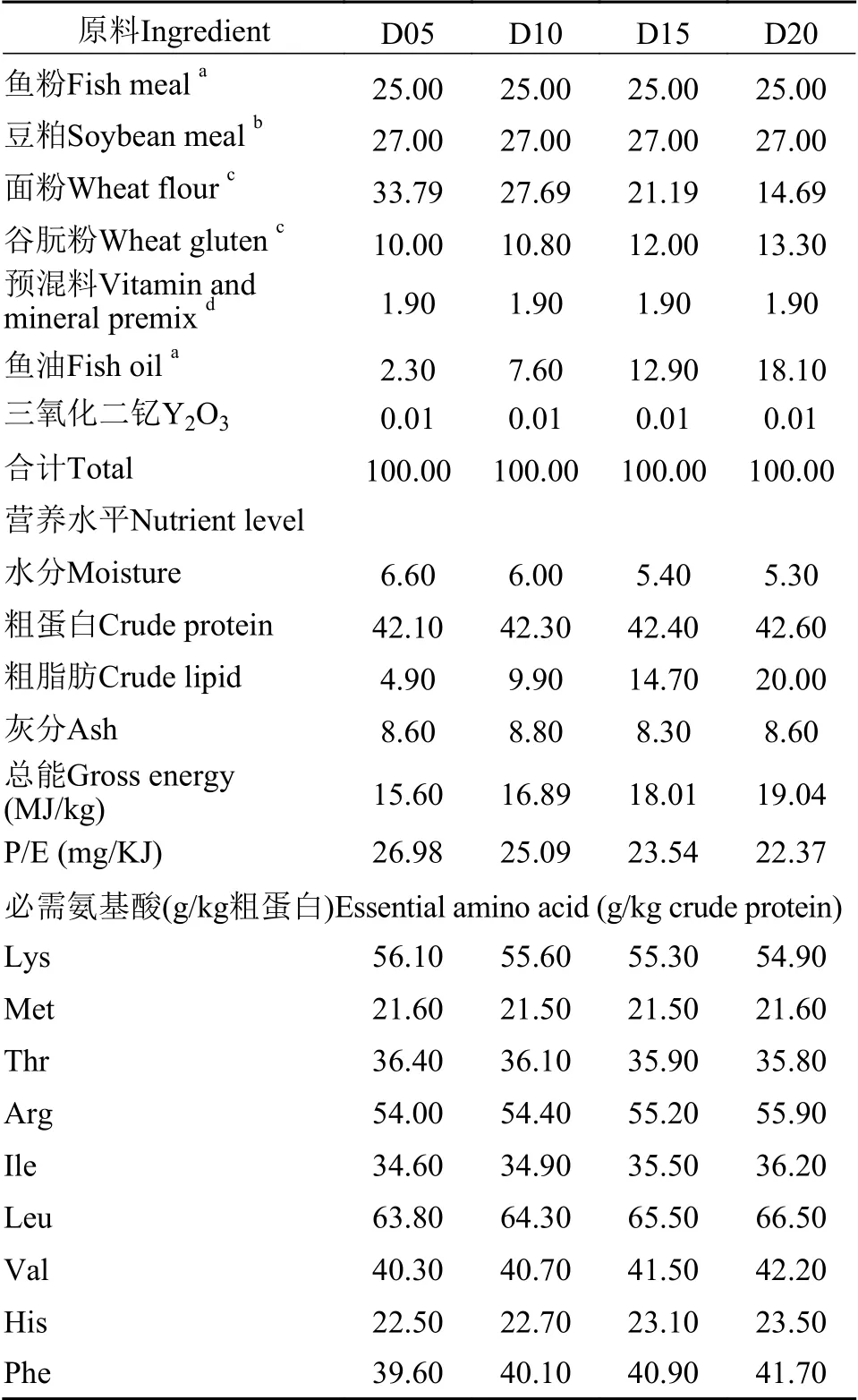
表1 饲料组成及营养水平(%风干基础)Tab.1 Composition and nutrient levels of the experimental diets(% air-dry basis)
在12周的养殖实验结束后, 所有鱼饥饿24h。分别对各缸鱼称重并统计末均重(Final body weight,FBW)、增重率(Weight gain rate,WGR)、特定生长率(Specific growth rate,SGR)及饲料效率(Feed efficiency,FE)。从每个养殖缸中随机取3尾鱼, 300 mg/L三氯叔丁醇麻醉后, 用2 mL的一次性注射器从尾静脉采血, 采集的血样放入2 mL离心管内, 1500×g离心5min后取血清并保存于-80℃, 用于抗氧化指标和肝脏功能的分析。采完血后, 分别测量体长(Body length,BL)、体重、内脏重和肝脏重, 计算肥满度(Condition factor,CF)、脏体比(Viscerasoma-tic index,VSI)和肝体比(Hepatosomatic index,HSI),然后剖取肌肉和肝脏样品, 存于-80℃, 用于肌肉组分、肝脏脂肪含量的检测。
1.4 化学分析
所有样品成分分析参考AOAC[22]描述的方法:水分含量采用直接干燥法(105℃), 粗蛋白含量(N×6.25)采用凯氏定氮法, 粗脂肪含量采用索氏抽提法, 灰分含量采用灰化法(550℃)。饲料和粪便中的三氧化二钇(Y2O3)含量按照田莹等[23]描述的方法进行测定。饲料和肌肉中的脂肪酸含量参照Caballero等[24]描述的方法, 使用安捷伦6890型气相色谱仪进行测定。
1.5 血清生化指标
血清样品用于检测抗氧化指标, 包括超氧化物歧化酶(Superoxide dismutase, SOD)、总抗氧化能力(Total antioxidant capacity, T-AOC)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)和髓过氧化物酶(Myeloperoxidase, MPO); 肝功能指标, 包括谷丙转氨酶(Alanine aminotransferase, ALT)、谷草转氨酶(Aspartate aminotransferase, AST)、碱性磷酸酶(Alkaline phosphatase, ALP)和乳酸脱氢酶(Lactic dehydrogenase, LDH)。其中SOD、GSHPx和T-AOC试剂盒由南京建成生物工程研究所提供, MPO试剂盒由北京华英生物工程研究所提供。ALT、AST、ALP和LDH试剂盒由德国罗氏诊断有限公司提供。所有指标均通过HITACH 7160型生化分析仪进行检测。
1.6 计算方法和统计分析
增重率(WGR, %)=100×(Wt-W0)/W0
特定生长率(SGR, %/d)=100×(lnWt-lnW0)/t
饲料效率(FE, %)=100×(Wt-W0)/干饲料消耗量
肥满度(CF)=100×Wt/L3
脏体比(VSI)=100×Wv/Wt
肝体比(HSI)=100×Wh/Wt
干物质表观消化率(ADCd, %) = 100×[1-(饲料中Y2O3/粪便中Y2O3)]
蛋白质表观消化率(ADCp, %)=100×[1-(饲料中的Y2O3/粪便中的Y2O3)×(粪便中的粗蛋白/饲料中的粗蛋白)]
脂肪表观消化率(ADCf, %)=100×[1-(饲料中的Y2O3/粪便中的Y2O3)×(粪便中的粗脂肪/饲料中的粗脂肪)]
能量表观消化率(ADCe, %)=100×[1-(饲料中的Y2O3/粪便中的Y2O3)×(粪便中的粗能量/饲料中的粗能量)]
式中,W0为初重(g);Wt为末重(g);Wv为内脏重(g);Wh为肝脏重(g);t为实验天数。
结果以平均值±标准误(Mean±SE)表示, 使用统计软件SPSS 17.0对数据进行单因素方差分析(Oneway ANOVA)。差异显著时通过Duncan’s检验进行多重比较, 差异显著性水平为P<0.05。通过线性回归和皮尔逊相关分析得到肌肉中脂肪酸和饲料中脂肪酸含量的相关性, 显著相关值为R2>0.5。
2 结果
2.1 不同脂肪水平对杂交鲟生长和形体指标的影响
在整个养殖过程中没有出现实验鱼死亡的现象, 各组存活率均为100%。从表3可以看出, 饲料中添加不同水平的脂肪, 对杂交鲟幼鱼FBW、WGR和SGR均有显著影响(P<0.05)。FBW、WGR和SGR随着脂肪水平的升高呈先升高后降低的趋势,其中D15组显著高于其他三组(P<0.05)。D15组杂交鲟幼鱼的FE在四组中最高, 且显著高于D05和D10组(P<0.05)。杂交鲟幼鱼的BL和CF并未受到饲料脂肪含量的影响(P>0.05)。VSI和HSI随着饲料脂肪水平的升高显著升高, D20组的VSI和HSI显著高于其他三组(P<0.05)。
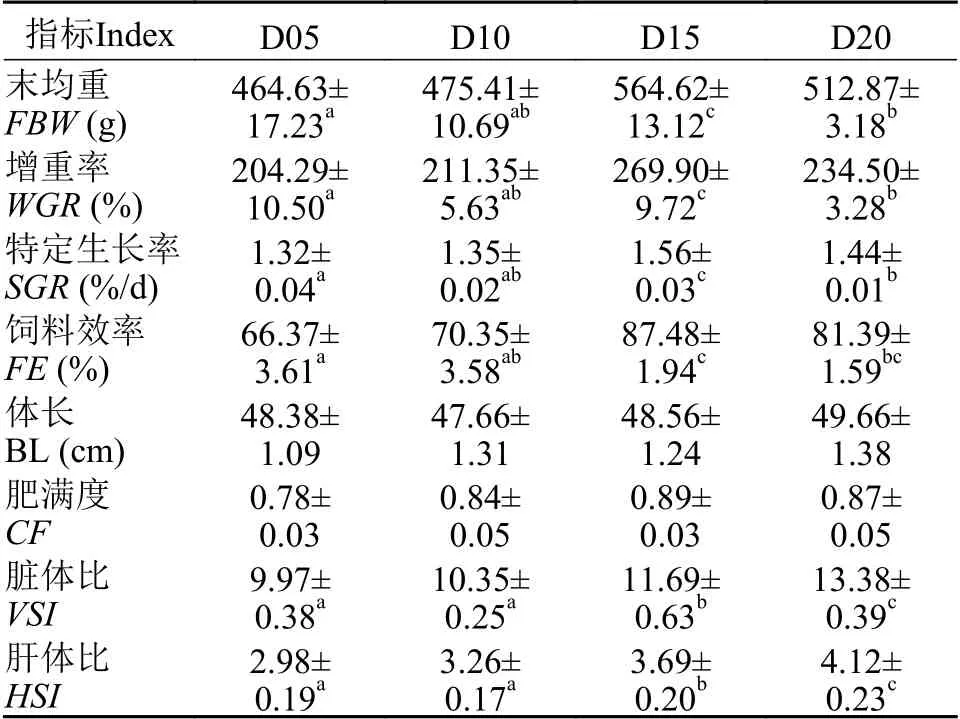
表3 饲料中不同脂肪含量对杂交鲟幼鱼生长、形体指标的影响(平均值±标准误, n=3)Tab.3 Growth performance and morphometric parameters of juvenile hybrid sturgeon fed experimental diets with different lipid levels (Mean±SE, n=3)
2.2 不同脂肪水平对杂交鲟幼鱼肌肉组分及肝脏脂肪含量的影响
饲料中不同脂肪水平对杂交鲟幼鱼肌肉中水分、粗蛋白和灰分含量无显著影响(P>0.05, 表4)。随着饲料中脂肪含量的升高, 杂交鲟幼鱼肌肉和肝脏中的脂肪含量显著升高(P<0.05)。当饲料脂肪含量为20%时, 其肌肉和肝脏脂肪含量显著高于D05和D10组(P<0.05)。
2.3 不同脂肪水平对杂交鲟幼鱼饲料消化率的影响
杂交鲟幼鱼的ADCd、ADCp分别在76.49%—78.42%和90.99%—91.86%, 且未受饲料脂肪含量的显著影响(P>0.05, 表5)。D15组的ADCf和ADCe在各组中数值最大, 其中, ADCf显著高于D05组(P<0.05), ADCe显著高于D05和D10组(P<0.05)。
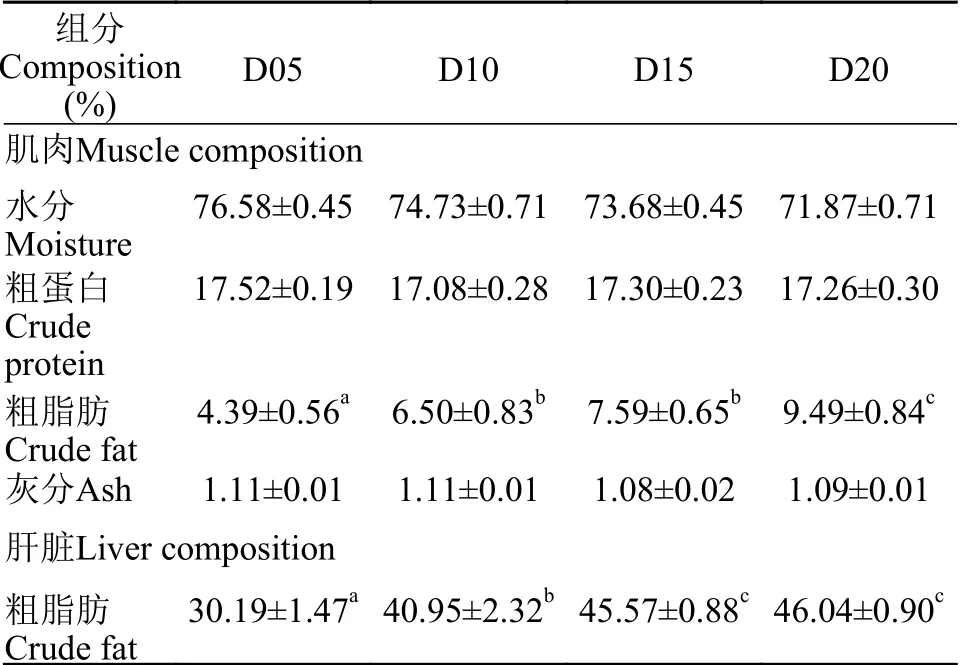
表4 饲料中不同脂肪水平对杂交鲟幼鱼肌肉组成和肝脏脂肪含量的影响(平均值±标准误, n=3)Tab.4 Fillet proximate compositions and hepatic fat content of juvenile hybrid sturgeon fed experimental diets with different lipid levels (Mean±SE, n=3)
2.4 不同脂肪水平对杂交鲟血清中抗氧化和肝功能指标的影响
如表6所示, 随着饲料中脂肪含量的增加, 杂交鲟幼鱼血清中SOD、T-AOC和MPO水平显著升高(P<0.05)。其中, D20组的SOD水平显著高于其他三组(P<0.05); D20组的MPO水平显著高于D05和D10组(P<0.05), 但与D15组相比, 差异不显著(P>0.05)。血清GSH-Px水平随着饲料脂肪含量的升高显著降低, 且D15组GSH-Px显著低于D05和D10组(P<0.05), 而与D20组差异不显著(P>0.05)。
随着饲料脂肪含量的增加, 杂交鲟幼鱼血清中ALT、AST、ALP和LDH的含量随之显著升高(P<0.05)。其中D20组杂交鲟幼鱼血浆ALT、AST、ALP和LDH含量显著高于脂肪含量为5%的D05组(P<0.05, 表6)。

表5 饲料中不同脂肪水平对杂交鲟幼鱼表观消化率的影响(平均值±标准误, n=3)Tab.5 ADC of dry matter, protein, fat and energy of juvenile hybrid sturgeon fed experimental diets with different lipid levels(Mean±SE, n=3)

表6 饲料中不同脂肪含量对杂交鲟血清中抗氧化指标和肝脏功能的影响(平均值±标准误, n=3)Tab.6 Serum antioxidant parameters and liver functions of juvenile hybrid sturgeon fed experimental diets with different lipid levels (Mean±SE, n=3)
2.5 不同脂肪水平对杂交鲟幼鱼肌肉脂肪酸含量的影响
由表7可见, 随着饲料脂肪水平的升高, 杂交鲟幼鱼肌肉中饱和脂肪酸(∑MUFA)、单不饱和脂肪酸(∑MUFA)和多不饱和脂肪酸(∑PUFA)的含量也随之显著升高(P<0.05)。杂交鲟幼鱼肌肉中各脂肪酸含量与饲料中脂肪酸含量呈显著的线性正相关(R2>0.92, 表8)。
3 讨论
3.1 饲料脂肪水平对杂交鲟幼鱼生长性能的影响
本研究结果显示, 饲料脂肪含量从5%增加到15%时, 杂交鲟幼鱼的生长性能显著提高, 而当饲料中的脂肪含量从15%增加到20%时, 杂交鲟幼鱼的生长性能有所下降。这一结果与已有的研究结果相吻合[25—29]。鱼类对于脂肪具有较好的利用能力, 饲料中添加适量脂肪, 能够起到减少蛋白质分解供能, 增加蛋白质沉积的作用, 这是随饲料中脂肪含量增加(5%—15%), 杂交鲟幼鱼生长性能显著提高的主要原因。但是, 饲料脂肪含量不是越高越好, 当饲料中的脂肪含量超过最适含量后, 鱼类的生长性能反而下降。研究表明, 俄罗斯鲟[30]、黄姑鱼(Nibea japonica)[31]、杂交罗非鱼(Oreochromis niloticus×O.aureus)[32]、亚东鲑(Salmo trutta)[33]等摄入脂肪水平偏高的饲料时, 其生长速度会减慢,饲料效率降低。而且当饲料中脂肪含量过高, 还会造成鱼体肝脏、肌肉和腹腔等部位的脂肪过量沉积[32], 严重时会诱发脂肪肝等代谢性疾病。本研究发现, 当饲料中的脂肪含量为20%时, 肝脏中的脂肪显著蓄积, 脏体比、肝体比显著上升, 抗氧化及肝脏功能相关酶活显著上升, 机体代谢异常是高脂饲料导致杂交鲟幼鱼生长性能下降的主要原因之一[25, 26, 34, 35]。

表7 饲料中不同脂肪水平对杂交鲟幼鱼肌肉脂肪酸含量的影响(g/100 g肌肉, 平均值±标准误, n=3)Tab.7 Fatty acid content in fillets of juvenile hybrid sturgeon fed experimental diets with different lipid levels (g/100 g fillet, Mean±SE, n=3)

表8 肌肉和饲料中脂肪酸含量相关性分析Tab.8 Correlation coefficients (R2) and P values of fatty acid concentrations in fillets vs.dietary fatty acid concentrations
蛋能比(P/E)在鱼类饲料中扮演着重要的角色,蛋能比过高会造成蛋白质的浪费, 过低则会造成脂肪代谢异常, 生长受到抑制[13,36]。对于大多数鱼类而言, 最适的蛋能比为20—25 mg/kJ[37—39]。Mohseni等[40]的研究指出俄罗斯鲟的最适P/E为22 mg/kJ, 波斯鲟(A.persicus)的最适P/E为18—20 mg/kJ, 欧洲鳇(Huso huso)的最适P/E为21—23 mg/kJ。Médale等[41]也认为当P/E比为20—22 mg/kJ时对俄罗斯鲟的生长更为有利。在本研究中, D15组的生长性能和FE在所有实验组中是最优的, 说明对于西伯利亚杂交鲟幼鱼而言, P/E在23.54 mg/kJ左右比较适宜。
3.2 饲料脂肪水平对杂交鲟幼鱼血清中抗氧化和肝功能指标的影响
ALT、AST、ALP和LDH是指示肝功能的重要指标。Wells等[42]的研究指出, 血清中ALT、AST和ALP水平升高可能是肝损伤或肝功能障碍的信号。LDH是用来检测组织障碍和帮助诊断组织损伤的指标[43,44], 其水平升高可能是由于细胞损伤而导致的肝脏病变和坏死[45,46]。在本研究中, ALT、AST、ALP和LDH在D20组中都是最高的, 说明饲料中过高的脂肪水平引起杂交鲟幼鱼肝脏功能受损。
在正常的营养代谢过程中会产生大量的活性氧(Reactive oxygen species, ROS)。机体抗氧化系统通过清除过量ROS, 维持氧化与抗氧化的动态平衡, 保护组织和细胞免受氧化应激损伤[47]。抗氧化系统分为酶与非酶抗氧化系统。SOD和GSH-Px是机体抗氧化酶系统的主要成员, 而T-AOC反映机体的总抗氧化水平。本研究发现, D20组杂交鲟幼鱼血清中SOD、T-AOC的含量显著升高, 提示当饲料中脂肪水平达到20%时, 杂交鲟幼鱼发生氧化应激。鱼油是饲料中n-3 HUFA的主要来源, 随着鱼油含量的增加, 饲料中的HUFA含量显著上升。而HUFA是机体发生脂质过氧化的主要来源。HUFA的含量越高, 机体发生过氧化的概率也就越大[48]。因此, 抵制体内脂质过氧化的发生, 是D20组SOD酶被显著激活, T-AOC含量显著增加的主要原因[49]。GSH-Px在抗过氧化的所有酶中, 效果是最显著的[50]。通过促进谷胱甘肽与过氧化氢反应, GSH-Px能够有效减少脂质过氧化对鱼体的损伤[51]。在本实验中, D15和D20组血清GSH-Px的活性显著低于D05和D10组, 说明饲料中脂肪含量过高会降低机体的抗氧化能力。MPO主要存在于中性粒细胞和单核细胞中, 能够催化过氧化氢和氯离子产生次氯酸。临床上认为, MPO的激活主要与炎症等有关[52,53]。在本研究中, MPO水平随着饲料中脂肪含量的增加而升高, 并在D20组中达到最高, 说明饲料中高水平脂肪可能有增加机体炎症反应的风险。
3.3 饲料脂肪水平对杂交鲟幼鱼肌肉脂肪酸含量的影响
Xu等[54]研究发现白鲟肌肉中的脂肪酸组成, 特别是n-3 HUFA, 显著受饲料中脂肪酸组成的影响。Xu和Hung[55]也指出, 白鲟肌肉中的脂肪酸组成与饲料中的脂肪酸组成高度一致。相似的结果在纳氏鲟中也得到了验证, Vaccaro等[56]发现纳氏鲟肌肉中C16∶0、C18∶1n9、C20∶5n3和C22∶6n3的含量与饲料中该四种脂肪酸含量显著一致。本实验的研究结果也显示, 杂交鲟幼鱼肌肉中的各脂肪酸含量与饲料中脂肪酸含量呈显著的线性正相关(R2>0.90)。以上结果说明, 鲟肌肉中脂肪酸组成和含量与饲料中脂肪酸组成和含量高度相关。
4 结论
本研究结果表明, 当饲料中脂肪含量从5%增加到15%时, 杂交鲟幼鱼的生长性能显著提高, 而当饲料中的脂肪含量从15%增加到20%时, 杂交鲟幼鱼的生长性能显著下降。随着饲料中脂肪水平的升高, 杂交鲟幼鱼脏体比、肝体比及肌肉、肝脏中的脂肪含量显著上升, 机体过氧化压力增大, 肝损伤风险增加。杂交鲟幼鱼肌肉中的各脂肪酸含量与饲料中脂肪酸含量呈显著的线性正相关。综合各指标因素分析, 杂交鲟适宜脂肪水平为15%,P/E为23.54 mg/kJ。

