根际促生菌对沉水植物的促生效应及其与沉积物氮磷赋存形态的关系
王会会 李前正 李亚华 王 川 吴振斌 周巧红
(1.中国科学院水生生物研究所淡水生态和生物技术国家重点实验室, 武汉 430072; 2.中国科学院大学, 北京 100049;3.中国地质大学, 武汉 430074)
沉积物是湖泊生态系统中氮、磷等营养盐的主要贮存库, 营养盐的释放会对水体产生不利影响,控制营养盐从而削减内源污染是湖泊水环境保护和治理重点关注的内容[1]。沉水植物作为水体中重要的初级生产者, 对生态系统的物质循环与能量流动起调控作用, 它可以通过根系吸收和自身积累去除沉积物中的营养盐和重金属等污染物[2]。利用苦草(Vallisneria natans)去除沉积物氮和磷负荷的研究表明, 苦草生物量达最高时, 沉积物中 NH4-N 和NO3-N的含量可降低一半左右[3], 沉积物间隙水溶解性总磷的含量降低 90%[4]。苦草、黑藻(Hydrilla verticillata)和菹草(Potamogeton crispus)在试验周期内对沉积物TP的最大降低幅度分别为60.7、35.3和25.9 mg/kg[5]。因此沉水植物的生长和生物量的扩大是促进植物强化内源控制的前提条件, 利用沉水植物进行湖泊沉积物修复和营养盐控制得到了广泛关注[6]。然而沉积物又是影响沉水植物生长的主要因素之一, 在沉水植物生长、形态和分布特征等方面起决定作用[7,8]。沉水植被在恢复过程中常受到高负荷沉积物胁迫等问题困扰[9], 沉积物中过高的营养盐会胁迫沉水植物种子萌发, 幼苗生长, 甚至有毒害作用, 从而影响整个湖泊生态恢复进程。有机质含量较高会导致沉积物成为还原性腐泥, 对水生植物产生胁迫效应, 不利于水生植物的存活和萌发[10]。研究表明, 沉水植物自然恢复通常在水体营养水平降低后的数十年才得以实现[11],因而在生态工程中常用人工辅助的恢复方式。
植物根际促生菌 (Plant growth-promoting rhizobacteria, PGPR) 是指定植于植物根际, 并能直接或间接地促进植物生长的一类细菌的总称[12]。目前在水稻和小麦等作物[13]、药用植物[14]及经济林木[15]中分离出众多PGPR菌株。大量研究表明, 根际有益微生物有增强植物耐受干旱胁迫、盐碱胁迫、重金属胁迫和养分亏缺等非生物胁迫能力。接种特定PGPR菌株可以缓解作物的盐胁迫[16,17]。Lasudee等[18]将PGPR菌株Streptomyces thermocarboxydus接种水稻后, 其通过增强溶解磷, 分泌脯氨酸、植物激素和嗜铁素, 提高了水稻的抗旱能力, 促进了干、鲜重及叶绿素等生理指标的明显提升。PGPR的接种对于非生物胁迫下沉水植物的恢复是否具有一定作用, 相关研究目前较少。
本研究以高有机质沉积物作为胁迫条件, 进行苦草植物的恢复实验, 通过接种PGPR的方式探究其对苦草生长及沉积物中氮磷赋存形态变化的影响, 以期为受污染湖泊沉水植物的恢复提供一种新思路。
1 材料与方法
1.1 沉水植物根际促生菌
研究团队前期以根系分泌物为唯一碳源开展了沉水植物根际促生菌的筛选, 共筛选得到61株PGPR。分别对61株PGPR进行1-氨基环丙烷-1-羧酸(1-aminocy clopropane-1-carb oxylate, ACC)脱氨酶活性、溶P、产吲哚乙酸 (Indole-3-acetic acid,IAA)及产细胞分裂素(Cytokinins, CKs)能力共4个促生指标的测定, 最终比选了8株优良PGPR菌株并进行了16S rDNA的测定。将8株PGPR进行苦草种子萌发试验, 进一步得到PC2、H19和L3三株最优菌株。接种苦草种子的处理后, 萌发的苦草幼苗株高分别增加了95.7%、69.6%和81.2%。本研究选用PC2、H19和L3三株PGPR进行苦草成株的接种实验, 菌种来源、鉴定结果及促生性能等具体结果如表1。
1.2 实验设计
根据前期试验筛选得到PC2、H19和L3三株PGPR, 共设置CK、PC2、H19和L3四个处理组。根据加拿大环境和能源部发布沉积物中营养盐的环境质量评价标准, 有机质含量超过17.2%的沉积物为严重污染级[19], 本研究采用的高有机质沉积物来自杭州西湖西里湖湖心区域, 该区域无沉水植物生长, 其有机质含量为17.4%。每个处理在30 cm×50 cm×35 cm(长×宽×高)的箱子里均匀摆放15个种植杯(直径5 cm, 高8 cm), 杯底部铺设5 cm高度的沉积物, 每个杯内种植大小一致, 生物量相同的5株苦草幼苗。该实验在室外自然光照下进行培养, 实验时间为2019年的7—11月, 培养温度范围是5—36℃,实验周期120d, 每隔3d补充一次上覆水(自来水), 使种植水深维持在35 cm, 每隔15d使用一次性滴管向植物根际补充一次菌液(A600=1、2), 空白处理用超纯水代替。分别在实验开始前(0)、20d、40d、60d、90d和120d进行样品采集, 每次采样随机选取每个处理的3个种植杯, 收集植物样品及沉积物样品。在实验周期结束时, 沉积物有机质含量未产生显著性变化。
1.3 指标检测方法
植物样品: 每个处理随机选取6株苦草植株, 测定其株高、根长、地上鲜重和根鲜重。
沉积物样品: 样品在自然风干后, 研钵研磨过100目筛, 置于干燥器储存备用。总磷(TP)、铁铝结合态磷(Fe/Al-P)、钙磷(Ca-P)、无机磷(Inorg-P)和有机磷(Org-P)均采用SMT化学分级提取法[20], 沉积物各种形态磷含量采用钼锑抗分光光度法测定;总氮(TN)采用过硫酸盐消化法[21]、氨态氮(NH4-N)、硝态氮(NO3-N)和亚硝态氮(NO2-N)均采用氯化钾溶液浸提-分光光度法[22]。测定前绘制标准曲线, 并根据标准曲线计算各形态氮、磷的含量。
1.4 统计分析
数据统计分析与绘图分别采用SPSS19.0与Origin8.0。以单因素方差分析(One way ANOVA)多样本间的显著性检验, Duncan法进行多重比较。选用皮尔森相关(Pearson)进行数据间的相关性分析, 规定显著水平P<0.05。采用Canoco4.5软件包进行物种间的主成分分析(Principal component analysis,PCA)及物种与环境因子间的冗余分析(Redundancy analysis, RDA)。
2 结果
2.1 PGPR对苦草的促生效应
PGPR对苦草的生长变化影响在实验结束后, 4个处理组苦草的生长情况如图1所示, 接种处理组苦草植株的形态特征均优于空白处理。对各处理组不同时期苦草的株高、根长、地上鲜重及根鲜重进行单因素方差分析, 具体分析结果如图2所示。结果表明, 空白对照中苦草的株高显著低于PGPR处理组。高有机质试验进行20d, 接种PGPR的3个处理组株高较空白处理均有显著性差异(图2a), 在整个试验过程中, 3个接种PGPR的处理组株高均显著高于空白处理组。在实验结束时,PC2处理组株高比空白处理增加了165.0%。40d时,接种PGPR的3个处理组的根长(图2b)、地上鲜重(图2c)和根鲜重(图2d)均与空白处理有显著性差异。空白处理组的根长一直呈上升趋势, 其各时间段的平均值均低于其他3个处理组。在实验结束时,PC2处理组根长、地上鲜重和根鲜重比空白处理分别增加了17.4%、378.8%和 165.1%。PC2处理组优于H19和L3处理组, 在实验结束时, PC2处理组的株高较H19和L3处理组分别增加了9.0%和40.0%;H19和L3处理组根长相同, PC2处理组的根长较H19和L3增加了10.2%; PC2处理组的地上鲜重较H19和L3处理组分别增加了11.4%和65.7%; PC2处理组的根鲜重较H19和L3处理组分别增加了37.5%和53.9%。由此可见, 沉积物高有机质显著抑制苦草的生长, 接种PGPR对苦草生物量的扩大具有显著作用, 进而能够加快逆境下植物的恢复进程。

表1 三株PGPR(PC2、H19、L3)基本信息情况表Tab.1 Basic information of the three strains of PGPR (PC2, H19, L3)
苦草生长指标的主成分分析(PCA)根据生长指标的显著性分析基本可以判断PGPR的接种有利于苦草在高有机质沉积物中的恢复, 为了综合判断不同菌株处理之间的影响差异, 本研究进一步结合各个生长时期的结果, 采用主成分分析(PCA)评价多变量样本间差别[23]。对苦草不同生长时期(0、20d、40d、60d、90d和120d)的株高、根长、地上鲜重及根鲜重数据进行PCA计算分析, 以确定不同处理对苦草生长影响的差异性。第一轴和第二轴总共解释了总变异的98.4% (图3), 且第一轴解释度占绝对优势, 表明4个指标在苦草不同生长时期的结果均呈现较好的一致性。3个接种处理组与空白处理明显分开, 尤其是PC2处理组距离空白处理距离最远、H19次之、L3最近, 表明PGPR接种对苦草生长促进的综合影响为PC2>H19>L3。
2.2 PGPR对沉积物氮磷赋存形态的影响
沉积物磷赋存形态及变化沉积物TP的初始含量为1442.9 mg/kg (图4a), Org-P和Inorg-P的含量分别为459.1和983.8 mg/kg (图4b和4c), Inorg-P含量是Org-P的2.1倍, Fe/Al-P为初始沉积物中主要的Inorg-P(图4e)。在接种处理后, TP含量下降,实验进行90d时, L3处理组TP达到最低, 减少了25.9%。Ca-P在整个实验周期内相对稳定, 其含量为249.9—461.0 mg/kg, 仅PC2接种组在90d出现显著的上升(图4d)。Fe/Al-P含量呈现一定的波动, 随实验的进行呈V形波动。

图1 实验结束时(120d)四个处理组苦草植株生长情况Fig.1 Plant growth of V.natans in four treatment groups on the 120th day
沉积物氮赋存形态及变化沉积物TN的初始含量为5423.8 mg/kg (图5a), Org-N和Inorg-N的含量分别为5376.9和35.9 mg/kg (图5b和5c), 其中Org-N占TN的比例超过95.0%。在整个实验周期内, 接菌处理组TN和Org-N的含量与空白处理组无显著性差异。在3种形式的Inorg-N中, 以NH4-N为主导, 其次是NO3-N和NO2-N。NH4-N和NO3-N都呈现先下降再略微上升的趋势(图5d和5e), 实验结束时PC2的NH4-N和NO3-N比CK分别下降了34.8%和25.7%。NO2-N含量占无机氮的比例最小, 后期显著积累(图5f), PC2和H19的接种显著抑制了NO2-N的上升, 其含量比CK分别低27.4%和32.9%。
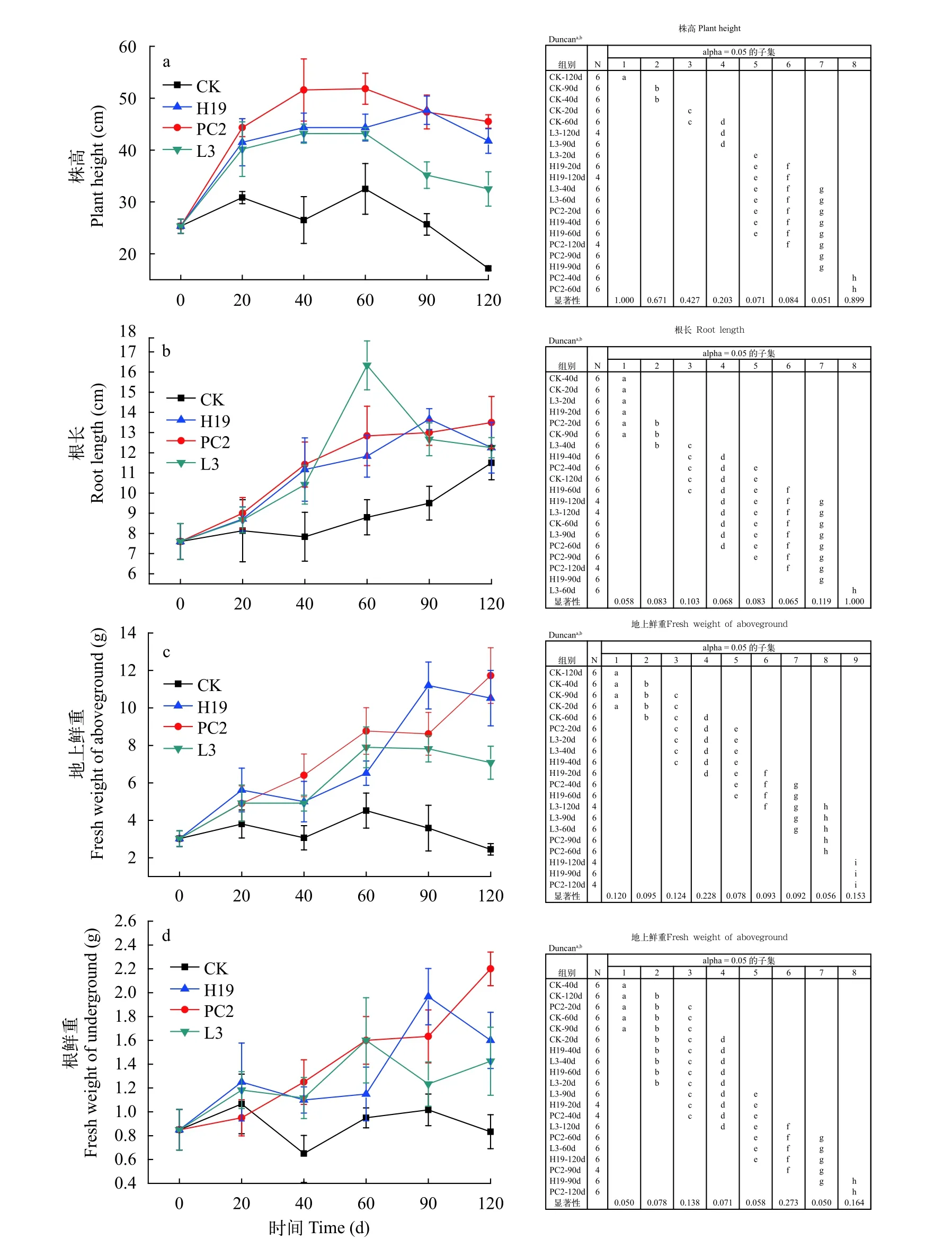
图2 PGPR接种对苦草的生长变化影响及其显著性分析Fig.2 Effects of PGPR inoculation on the growth of V.natans and their significance analysis
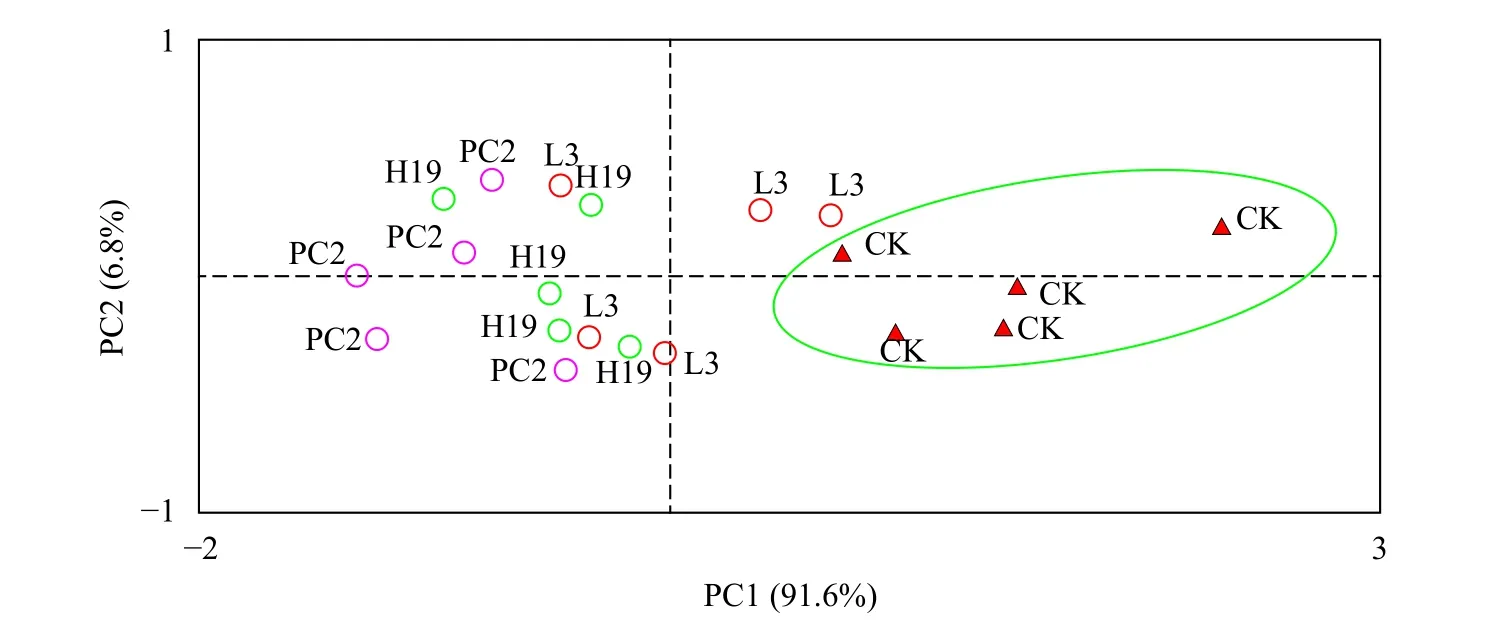
图3 基于植物生长指标的PCA分析Fig.3 PCA analysis based on plant growth index
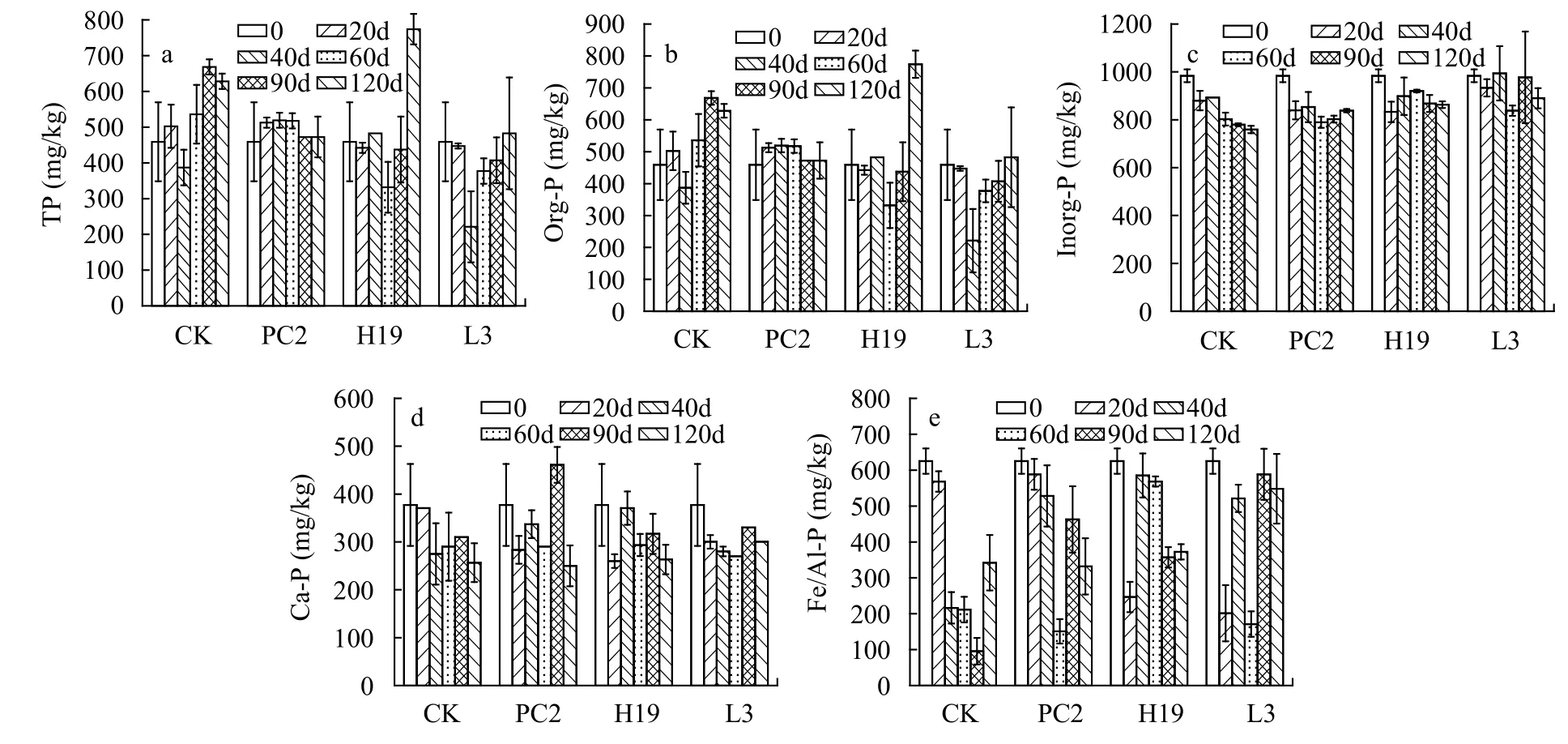
图4 沉积物中不同磷赋存形态Fig.4 Different phosphorus forms in the sediment samples
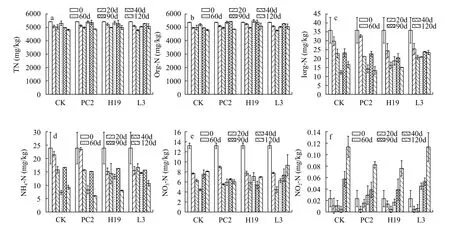
图5 沉积物中不同氮赋存形态Fig.5 Different nitrogen forms in the sediment samples
2.3 PGPR接种与沉积物氮磷赋存形态的关系探讨
通过植物生长指标与沉积物氮磷赋存形态现存量的分析, 初步得到PC2菌株接种对沉积物氮磷赋存形态尤其是无机形态具有显著的影响。为进一步探讨PGPR接种与植物生长、沉积物氮磷赋存形态的相关关系, 选用苦草各生长指标及不同氮磷赋存形态含量在每个测量周期内的变化量(即后一采样时间与前一采样时间的差值)来进行指标增加量的分析。首先对数据进行DCA分析(Detrended correspondence analysis, 去趋势对应分析)以获得第一轴的梯度长, 本研究第一轴的梯度长小于3, 所以选用RDA分析。RDA分析结果表明(图6), ΔTN、ΔNH4-N、ΔNO3-N、ΔNO2-N、ΔInorg-N、ΔOrg-N、ΔTP、ΔCa-P、ΔFe/Al-P、ΔOrg-P和ΔInorg-P共11个环境因子增量共解释了83.6%的生长指标变化。Δ株高与ΔNO3-N、ΔNO2-N、ΔInorg-N和ΔInorg-P等负相关; Δ根长与ΔNO3-N、ΔInorg-N、ΔFe/Al-P和ΔInorg-P等负相关; Δ地上鲜重与ΔFe/Al-P、ΔInorg-N、ΔInorg-P、ΔNH4-N和ΔNO3-N等负相关; Δ根鲜重ΔFe/Al-P、ΔInorg-N、ΔInorg-P和ΔNO3-N等负相关。在此基础上, 进行各生长指标增量与环境因子增量的Pearson相关分析(表2),结果表明, Δ株高与ΔNO3-N和ΔNO2-N极显著负相关, 与 ΔInorg-N和ΔInorg-P显著负相关; Δ根长ΔNO3-N、ΔInorg-N和ΔInorg-P显著负相关; Δ地上鲜重与ΔFe/Al-P极显著负相关; Δ根鲜重与ΔFe/Al-P和ΔInorg-P显著负相关。相关分析结果在RDA分析中均有呈现, 因此ΔInorg-N、ΔNO2-N、ΔNO3-N、ΔInorg-P和ΔFe/Al-P是与苦草各生长指标增量显著相关的重要环境因子。
3 讨论
3.1 PGPR促进植物生长恢复的效果与作用原理
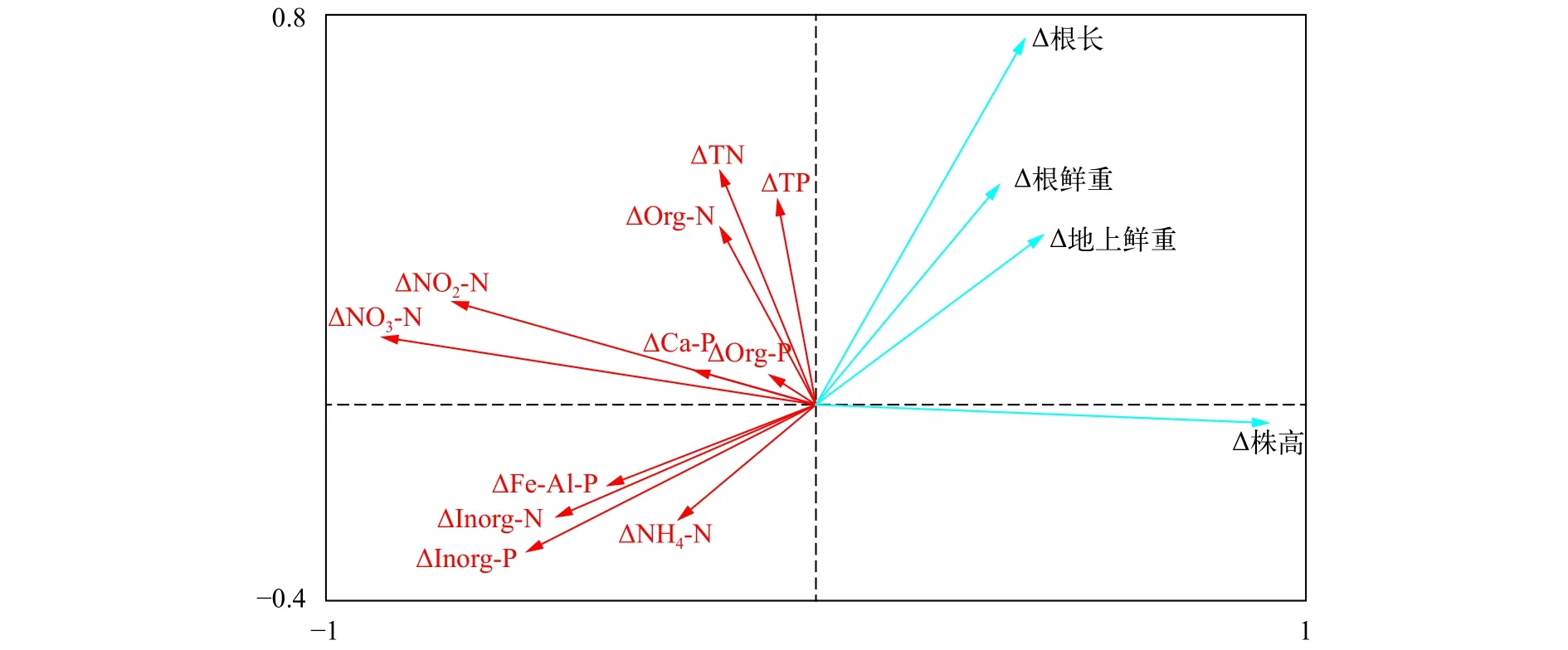
图6 生长指标增量与沉积物各氮磷形态增量的RDA分析Fig.6 RDA analysis of the increment between plant growth index and sediment N and P forms
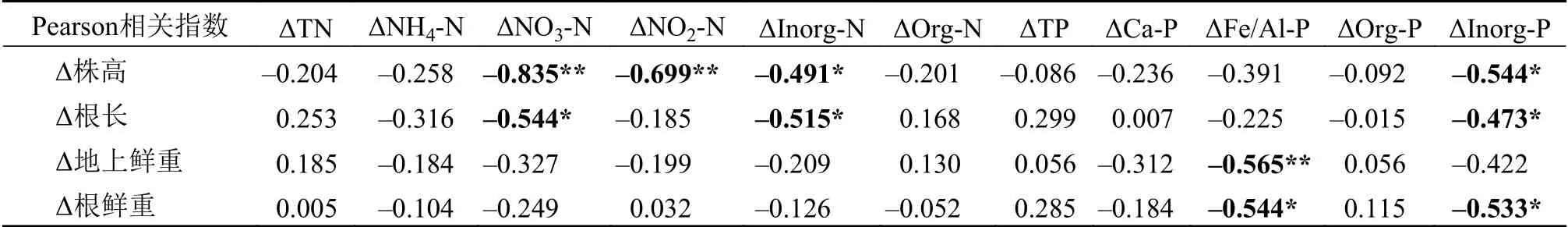
表2 生长指标增量与环境因子增量的相关性分析Tab.2 Correlation analysis between growth index increment and environmental factor increment
本研究旨在探讨PGPR对苦草的促生效应及与沉积物氮磷赋存形态相互关系, 以期得到加快受污染湖泊沉水植物恢复及削减内源污染的方法。结果表明, 在高有机质负荷的沉积物条件下, PGPR的接种可以有效抵抗植物生长所受的胁迫, 显著提高植物生物量的积累, 尤其是地上部分株高和生物量的积累。实验进行第20天时, PC2、H19和L3处理组株高较空白均有显著提高, 第40天时, PC2、H19和L3处理组根长、地上鲜重及根鲜重与空白均有显著性差异, 较空白均有大幅度提高。在试验结束时, 空白处理种植的苦草生长受到抑制, 株高降低了32.2%, 尽管根长略有增加, 但地上和地下鲜重没有显著变化。进一步表明高有机质沉积物对苦草的抑制地上部分呈“扁平化”, 地下部分呈“细长型”。在接种的3株PGPR中, PC2对苦草的生长促进作用最为显著。PC2筛选自菹草根际, 但溶磷能力、产IAA及CKs能力高于H19和L3, PGPR的促生能力不受宿主沉水植物的影响, 菹草为耐污型沉水植物, 因此PC2有更强的促生能力; H19的溶磷能力、产IAA及CKs能力低于L3, 但ACC脱氨酶活性约为L3的6倍, ACC脱氨酶可以将合成乙烯的前体ACC分解为氨和 α -丁酮酸来减少乙烯合成, 从而降低植物对逆境的敏感性, 提高植物抗逆能力。因此, 对苦草生长促进的综合影响H19>L3可能与ACC脱氨酶活性有关。赵伟进等[24]在PGPR对黑青稞幼苗的促生试验中发现, 各接菌处理组对黑青稞幼苗的须根数、茎粗等有一定促进作用, 不接菌的空白处理, 黑青稞幼苗的根长、茎粗及须根数等受到抑制。此外, 王欢等[15]发现4株PGPR菌株对白菜、空心菜、苋菜和水稻的株高均有促进作用, 其中GD12和GD3菌株效果最优。GD12菌株处理后白菜株高比空白增加59.5%, 水稻株高比空白增加15.8%; GD3菌株处理后空心菜株高比空白增加38.2%, 苋菜株高比空白增加37.5%。
PGPR是一类存在于根际周围, 能够通过自身特有功能, 如溶磷解钾、产IAA和固氮作用等直接或间接促进植物生长的微生物。研究表明, PGPR可以利用色氨酸合成植物激素吲哚乙酸(IAA),能够显著促进甜菜、芥菜、小麦等植物的生长[25];产ACC脱氨酶细菌接种小麦, 可显著降低干旱胁迫对小麦生长的负面影响等[26]。PGPR通过与植物发生相互作用, 能够改良土壤, 活化土壤矿物质,提高植物养分吸收, 减少病害, 提高产量等[27]。目前, PGPR与植物的互利共生关系在农业领域已有长期的应用和发展, 其次是在林业、草地业, 针对营养获取、抵抗环境胁迫、病原防治和迁地移栽等问题, 其应用的核心目的是农业的可持续性与植被保护[28—30]。面对水生态系统退化、沉水植物难以自然恢复、水体生物与非生物环境因素的多重胁迫等问题时, 本研究的初步结果表明, PGPR与沉水植物的互利共生关系可以成为一个有潜力的恢复方法。
3.2 PGPR对沉积物无机氮磷污染修复的潜力
为进一步探讨PGPR接种后沉水植物生长与沉积物氮磷赋存形态的相关关系, 选用苦草各生长指标及不同氮磷赋存形态含量在每个时期的变化量进行冗余分析和皮尔森指数相关分析。分析结果表明, 苦草各生长指标增量与沉积物中ΔInorg-N、ΔNO2-N、ΔNO3-N、ΔInorg-P和ΔFe/Al-P等显著负相关, PGPR对沉积物中Inorg-N、NO2-N、NO3-N、Inorg-P和Fe/Al-P等无机态氮磷的削减有促进作用, 以PC2菌株的作用效果最为明显。农田土壤为氮、磷、钾等养分的贮存库, PGPR菌肥可对土壤养分库进行活化, 促进植物对营养元素的吸收。如解磷微生物的解磷机制通常认为是微生物能分泌有机酸, 既能够降低pH, 又可与铁、铝、钙和镁等离子结合, 从而使难溶性磷酸盐溶解; 解钾微生物是土壤中分离出来的一种能分化铝硅酸盐和磷灰石类矿物的细菌, 能够分解钾长石, 磷灰石等不溶的硅铝酸盐的无机矿物, 还能促进难溶性的钾、磷和镁等养分元素转化成为可溶性养分, 增加土壤中速效养分含量以促进作物生长发育, 提高产量[31]。PGPR菌肥的施用使得土壤微生物种群密度增大,根际微生态环境得到改善, 从而提高了土壤速效氮、磷等的含量[27]。在本研究中, 苦草Δ地上鲜重与ΔFe/Al-P呈极显著负相关, 表明对沉积物Fe/Al-P的控制和削减需要重点考虑沉水植物地上生物量的扩大。今后可以从PGPR的优化筛选和接种、对泥水界面氮磷通量的影响等方面进行深入探究, 使具有绿色、高效特点的PGPR在水生态系统恢复的过程中发挥积极的作用。
4 结论
本研究将沉水植物根际筛选到的PC2、H19和L3三株芽孢杆菌属PGPR接种到苦草植株根际, 结果表明在高有机质沉积物条件下, PGPR接种后苦草生长状况显著优于非接种组; 120d时, 空白处理种植的苦草生长受到抑制, PC2处理组株高比空白处增加了165.0%, 根长比空白处理增加了17.4%, 地上鲜重比空白处理增加了378.8%, 根鲜重比空白处理增加了165.1%。进一步分析PGPR与沉积物氮磷赋存形态的相互关系, 通过RDA分析与皮尔森指数相关分析得出PGPR对沉积物中Inorg-N、NO2-N、NO3-N、Inorg-P和Fe/Al-P等无机态氮磷的削减有促进作用。研究结果拓展了PGPR在水体生态系统中的应用, 为人工辅助恢复沉水植物及削减内源污染提供思路。

