三疣梭子蟹Pt-ddit4l基因的克隆及表达分析
阎德平 吕建建, 陆 璇 张 文 题兴斌 宋 柳 刘 萍,
(1.中国水产科学研究院黄海水产研究所, 农业农村部海洋渔业可持续发展重点实验室, 青岛 266071;2.青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 青岛 266071)
三疣梭子蟹(Portunus trituberculatus)是一种重要的海洋经济动物, 因其肉味鲜美, 蛋白含量高, 已成为我国沿海地区的主要养殖蟹类, 在黄渤海及东海区域养殖尤为广泛[1,2]。随着养殖规模的不断扩大, 病害爆发愈加频繁, 给梭子蟹养殖业造成了巨大的经济损失。而副溶血弧菌(Vibrio parahaemolyticus)是造成三疣梭子蟹批量死亡的主要致病菌之一[3]。本实验在前期开展的弧菌胁迫全基因组重测序中成功检测并鉴定到一个跟副溶血弧菌性状相关的SNP标记(P=0.013, 数据未发表), 并成功定位于ditt4l(DNA damage inducible transcript 4 like)基因上, 推测该基因可能是一个具有副溶血弧菌抗性的基因。
DDIT4L又被称为REDD2/RTP801L, 该基因具有参与DNA损伤修复和介导细胞凋亡的功能, 是DDIT家族中重要的一员[4,5]。该基因首先发现于人的白血病细胞系中, 在相关处理下, 可以使细胞行使吞噬功能, 随后形成参与免疫反应的巨噬细胞[6]。ddit4l基因在哺乳动物的C端相当保守, 含有一个RTP_901C蛋白结构域。此外ddit4l基因还具有调节胚胎发育、参与无氧代谢及介导细胞凋亡的功能[7—9]。但目前尚未有该基因在甲壳动物免疫防御方面的报道。
为了探究三疣梭子蟹Pt-ddit4l基因的结构特征和功能, 克隆了三疣梭子蟹Pt-ddit4l的cDNA全长,并对不同发育阶段、组织分布、弧菌感染和RNA干扰下的表达情况进行了深入的研究, 为丰富DDIT基因家族的功能提供了参考, 也为进一步研究三疣梭子蟹在弧菌感染下的免疫防御机制提供理论依据。
1 材料与方法
1.1 样品采集
本实验所使用的三疣梭子蟹均来自中国水产科学研究院黄海水产研究所下营实验基地。2018年8月实验所用梭子蟹均为体重(40±3) g的80日龄个体, 先放置于若干个大整理箱(660 mm×400 mm×310 mm)中暂养1周, 暂养期间持续供氧, 温度保持在23℃, 盐度8.0, pH 8.3, 每晚6点及时更换自然海水和投喂新鲜饵料。
2019年4月在下营实验基地育苗期间, 根据薛俊增等[10]关于三疣梭子幼体发育不同时期的鉴定方法, 在三疣梭子蟹苗种繁育期间采集其幼体发育各期的样品(取3组平行样品), 包括囊胚期、原肠期、眼点期、心跳期、溞状幼体Ⅰ期(Z1)、溞状幼体Ⅱ期(Z2)、溞状幼体Ⅲ期(Z3)、溞状幼体Ⅳ期(Z4)和大眼幼体期(M), 样品放置于液氮中保存[10]。
1.2 病原感染实验
从暂养1周后健康的80日龄梭子蟹中随机取9只, 分别取其肝胰腺、心脏、血细胞、眼柄、鳃、胃、肠和脑等组织样品, 来自3只梭子蟹的同组织样品混合成一管, 置于液氮中保存。随后进行副溶血弧菌感染实验, 参照张杰等[2]实验方法加以改进。将暂养1周后健康的梭子蟹随机分成PBS对照组和副溶血弧菌感染组, 每组50只, 并设置3个平行, 随后分别于三疣梭子蟹游泳足第一关节基膜处注射100 μL的PBS(浓度为10 mm/L)和副溶血弧菌(浓度为3.8×106cfu/mL)。在注射后的0、3h、6h、12h、24h、48h和72h收集梭子蟹的血细胞和肝胰腺组织样品, 每组随机取3只。其血细胞的收集方法参照宋柳等[11]进行, 每只于游泳足第一关节基膜处抽取1 mL血液与抗凝剂缓冲液(柠檬酸钠1.32%,柠檬酸0.48%和葡萄糖1.47%)混合, 随后移置到1.5 mL无RNA酶的离心管中, 在4℃下4000 r/min离心10min,随后将上清液丢弃将血细胞保存下来, 样品标记编号后统一放置于液氮中保存。
1.3 三疣梭子蟹Pt-ddit4l基因cDNA全长的克隆
根据本实验室全基因组重测序数据库中得到的Pt-ddit4l基因部分序列, 使用引物设计软件Primer Premier 6.0 设计中间片段扩增引物, 以及5′和3′所需要的基因特异性引物, 引物参见表1, 由北京睿博兴科生物科技有限公司进行合成。
利用引物REDD2F/ REDD2R进行基因中间片段扩增, PCR反应扩增体系为20 μL, 包括: 13.6 μLddH2O, 2.5 μL 10× TransTaq®HiFi Buffer I, 1.6 μL 2.5 mol/L dNTPs, 0.4 μL TransTaq®HiFi DNA Polymerase, 0.4 μL Forward/Reverse primer (10 μmol/L)and 1 μL template DNA。反应程序如下所示: 94℃,5min; 94℃30s, 60℃30s, 72℃, 1min, 35个循环;72℃, 10min; 4℃, 恒温保存。将扩增得到的PCR产物送交青岛擎科梓熙生物技术有限公司进行测序,然后和获得的unigene片段进行比对, 确保保守区域的正确性。

表1 实验所用引物名称及序列Tab.1 Primers used in this study
使用SMARTTMRACE试剂盒对Pt-ddit4l基因3′和5′进行扩增, 先进行第一轮PCR扩增, 使用引物REDD2F1/REDD2R1和UPM进行扩增; 随后将PCR产物稀释10倍作为下一轮扩增的模板, 使用引物REDD2F2/REDD2R2和NUP混合进行第二轮PCR扩增, 反应体系和程序如上所述。制备1%的琼脂糖凝胶进行PCR产物电泳, 将正确的电泳条带经DNA切胶回收、pMD18-T载体连接、转化入DH5α感受态细胞中, 最后挑选单一菌落并使用通用引物M13F/M13R(表1)进行阳性克隆鉴定, 筛选目的菌液完成测序。
1.4 生物信息学分析
使用Vecror NTI 11.0软件去除多余的载体序列, 然后将序列正确拼接, 拼接好的目的片段使用国家生物技术信息中心NCBI-BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析。使用Bioedit和Gene Tool进行开放阅读框(ORF)的预测,并对编码的氨基酸进行翻译。氨基酸序列通过Pfam数据库(http://pfam.xfam.org/search)进行蛋白质功能结构域预测分析; 蛋白质分子质量、不稳定性指数、亲水系数、理论等电点和信号肽通过Ex-PASy-ProtParam tool(https://web.expasy.org/protparam/)预测。使用分子进化遗传型分析软件MEGA 6.0以Neighbor-Joining 法构建系统进化树, 对Ptddit4l基因的亲缘关系进行进一步的分析。
1.5 Pt-ddit4l基因在发育不同时期的表达分析
使用RNAiso Plus试剂根据说明书步骤分别提取三疣梭子蟹不同发育时期总RNA。从提取的三疣梭子蟹发育不同时期总RNA中选取高质量的样品通过Reverse Transcriptase M-MLV (RnaseH)试剂盒反转录合成cDNA, 合成的cDNA模板用于后续实时荧光定量PCR。利用Primer Premier 6.0软件设计用于Pt-ddit4l幼体发育不同时期表达分析的荧光定量引物Pt-REDD1qF/Pt-REDD1qR, 内参基因使用β-actinF/β-actinR(表1)。以三疣梭子蟹发育不同时期的cDNA为模板, 进行实时荧光定量RT-PCR扩增。反应总体系为10 μL, 包括5 μL 2×ChamQ Universal SYBR qPCR Master Mix, 1 μL Template cDNA, 0.4 μL Primer F(10 μmol/L), 0.4 μL Primer R(10 μmol/L), ddH2O补足至10 μL。每个样品设置3个平行重复和内参对照, 反应程序设置如下: 95℃10min; 95℃ 5s, 60℃ 34s, 总共35个循环。
1.6 Pt-ddit4l基因mRNA表达分析
按照上述1.5的方法分别提取三疣梭子蟹9个组织和病原胁迫后各时间点样品的总RNA, 反转录合成cDNA。以稀释后的cDNA为模板, 进行实时荧光定量PCR。扩增体系和反应程序同上述发育不同时期。实时荧光定量PCR实验结果数据采用相对标准曲线法2-ΔΔCt法进行相对表达定量计算, 计算出平均表达量和标准差, 使用SPSS 19.0软件对计算结果进行单因素方差分析,P<0.05表示差异显著, 并通过OriginPro 2018将统计的结果整理成柱状图。
1.7 RNA干扰实验
Pt-ddit4l基因的双链RNA(dsRNA)的合成方法参照Kim等[12]的体外转录的方法合成, 设计的引物序列见表1。将暂养1周后健康的三疣梭子蟹随机分为PBS阴性对照组和RNAi取样组, 每组各40只。按照Bai等[13]的实验方法进行注射, 对照组和实验组分别在梭子蟹游泳足第一关节基膜处注射50 μL的dsRNA(1 μg/g)和PBS(10 mm/L), 在注射后的12h后每组随机取3只梭子蟹收集血细胞和肝胰腺,提取RNA, 利用qPCR检测dsRNA注射后REDD基因沉默的效率。并在注射后的第12h, 对照组和实验组再注射50 μL副溶血弧菌(浓度为3.8×106cfu/mL),在弧菌感染后的3h、6h、12h和24h统计每组梭子蟹的死亡率。该实验同时设置3个平行。
2 结果
2.1 Pt-ddit4l基因序列分析
Pt-ddit4l基因cDNA全长2727 bp, 包括698 bp的5′-UTR, 1522 bp的3′-UTR和507 bp的开放阅读框(ORF), ORF编码168个氨基酸(图1), 预测分子质量为19.14 kD, 理论等电点为5.41, 不稳定系数为54.05, 亲水系数为-0.177, 归类为不稳定亲水蛋白。通过预测还发现该基因在13—15氨基酸处有一个糖基化位点, 在46—160氨基酸位置处含有一个RTP801_C结构域, 且该结构域在物种间相当保守。
利用MEGA 6.0软件对Pt-ddit4l编码的氨基酸序列与其他同源物种的氨基酸序列构建进化树分析, 结果如图1所示, 本研究中的Pt-ddit4l先与凡纳滨对虾(Litopenaeus vannamei)聚为一支, 再与大型蚤(Daphnia magna)相聚, 它们的亲缘关系最近, 形成一个独立的分支, 接着与棘皮动物的紫色海胆(Strongylocentrotus purpuratus)、日本刺参(Apostichopus japonicas)和马蹄蟹(Limulus polyphemus)聚为一支, 而与同属梭子蟹科的滨蟹(Green Shore Crab)相距较远。

图1 构建的DDIT4L的系统进化树Fig.1 The phylogenetic tree based on the sequences of different DDIT4L family members
2.2 Pt-ddit4l在不同组织中的表达分布
利用qPCR技术对Pt-ddit4l在三疣梭子蟹各组织中的表达量进行检测, 结果发现Pt-ddit4l在三疣梭子蟹的各组织中均有表达, 在肝胰腺中表达量最高, 约为心脏中表达量的2.8倍; 其次在鳃中表达量最高, 为心脏中表达量的1.1倍 (图2)。
2.3 Pt-ddit4l基因在不同发育时期的表达分布
如图3所示, 胚胎发育时期,Pt-ddit4l的表达量逐渐上升, 在心跳期时表达量达到最高, 且与囊胚期中的表达量差异显著(P<0.05); 而在溞状幼体发育时期,Pt-ddit4l的表达量出现明显下调, 随后出现回升, 在溞状幼体Ⅳ期和囊胚期相比无显著差异(P>0.05); 随后大眼期的表达量也明显下调, 显著低于囊胚期(P<0.05)。
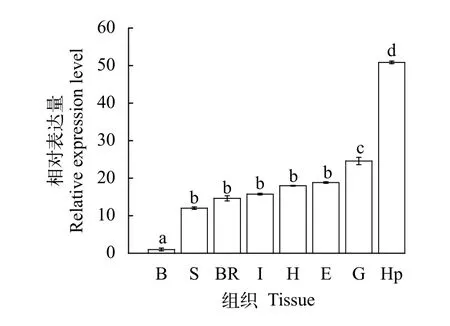
图2 三疣梭子蟹ddit4l基因在健康组织中mRNA相对表达量Fig.2 The relative ddit4l mRNA level in healthy tissues of ddit4l P.trituberculatus
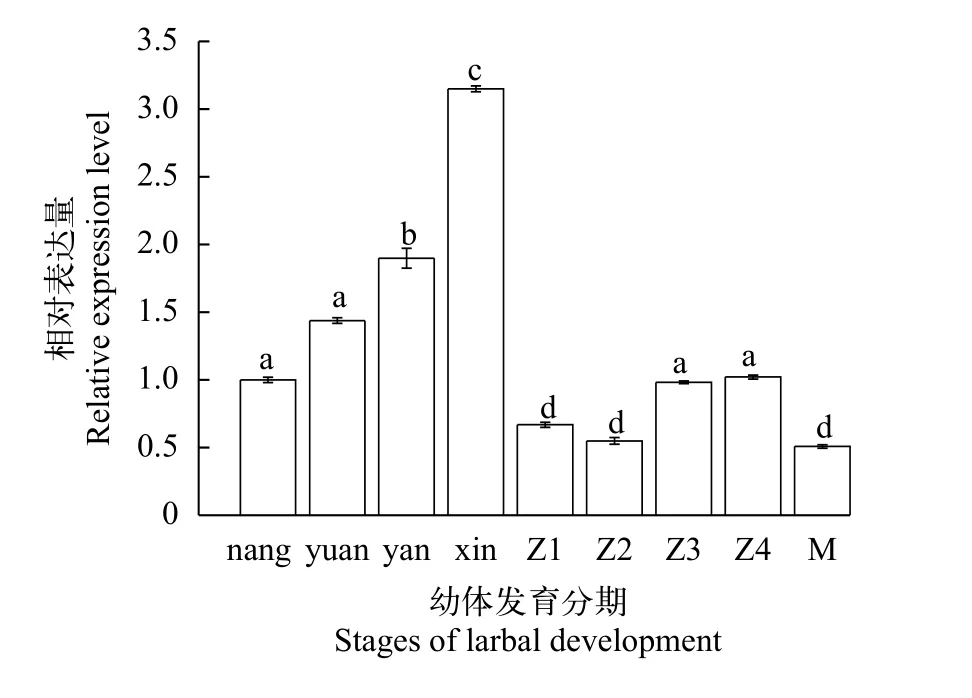
图3 三疣梭子蟹不同发育阶段ddit4l基因的相对表达量Fig.3 Relative expression of ddit4l at different larval development stages of larval P.trituberculatus
2.4 Pt-ddit4l在副溶血弧菌感染后的表达分析
ddit4l如图4所示, 在血细胞中, 注射副溶血弧菌后,Pt-ddit4l基因的表达量呈先上升后下降的趋势, 12h时达到峰值, 是对照组表达量的8.85倍(P<0.05), 除24h出现下调之外, 整体呈上调趋势。而在肝胰腺中, 注射副溶血弧菌感染后,Pt-ddit4l表达量出现显著下调, 72h达到最低值, 仅为对照组表达量的1/40 (P<0.05)。
2.5 注射dsRNA后Pt-ddit4l基因的表达分析及弧菌感染下死亡率统计
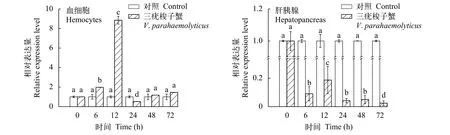
图4 三疣梭子蟹血细胞和肝胰腺感染副溶血弧菌后Pt-ddit4l的表达情况Fig.4 The relative expression of Pt-ddit4l in hemocytes and hepatopancreas of P.trituberculatus infected with V.parahaemolyticus

图5 RNA干扰后Pt-ddit4l 在三疣梭子蟹血细胞和肝胰腺中的表达情况Fig.5 The relative expression of Pt-ddit4l in hemocytes and hepatopancreas of P.trituberculatus injected with RNAi
如图5所示, 在肝胰腺中, RNA干扰组6—24h的基因表达量显著下调, 与对照组相比分别下降了17%、88.8%和36%; 在血细胞中, RNA干扰组6—24h的基因表达量显著下调, 与对照组相比分别下降了61.7%、49.4%和81.1%。注射RNAi后12h再注射副溶血弧菌感染的死亡统计结果如图6所示, 发现注射RNA干扰的实验组相比起对照组死亡率明显增高, 这些结果表明Pt-ddit4l参与了三疣梭子蟹弧菌感染后的免疫防御机制。
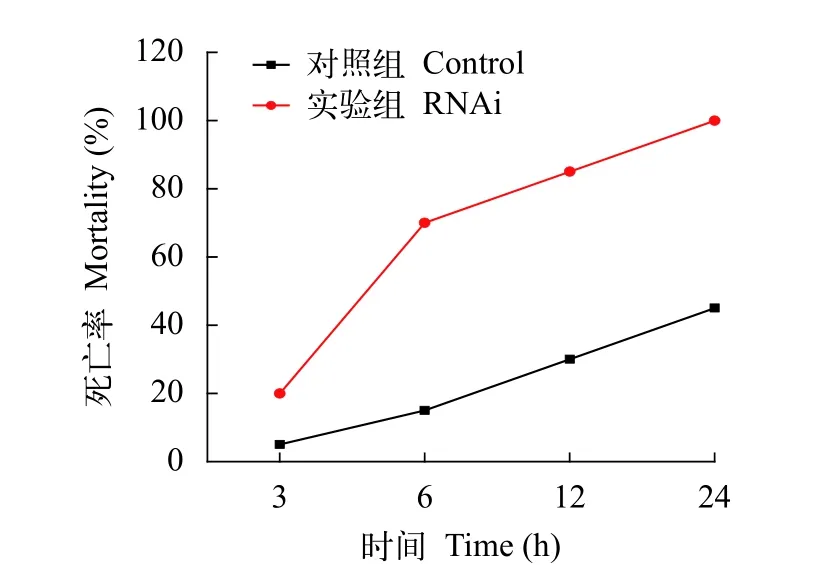
图6 RNA干扰下感染副溶血弧菌的梭子蟹死亡率统计Fig.6 Mortality of swimming crab infected with V.parahaemolyticus by RNA interference
3 讨论
3.1 Pt-ditt4l的序列特征
为进一步探究副溶血弧菌感染下三疣梭子蟹的免疫防御机制, 本实验通过分子标记成功定位到一个具有副溶血弧菌抗性的基因, 通过基因克隆首次获得三疣梭子蟹Pt-ddit4l序列全长, 将其命名为Pt-ddit4l, cDNA全长为2727 bp, 编码一个由168个氨基酸组成的多肽。BLAST相似性比对和系统发育树进化分析发现其与甲壳动物中的凡纳滨对虾相似性最高为60%, 在进化树上单独聚为一分支,随后与其他物种的ddit4l基因聚为一类。由此确定该基因为三疣梭子蟹DDIT4家族新的成员。
3.2 Pt-ditt4l基因的表达分布
在本研究中,Pt-ddit4l在各组织中均有表达, 其在肝胰腺的表达量最高, 而肝胰腺是三疣梭子蟹的重要免疫器官, 暗示其可能发挥重要的免疫功能[14,15]。通过分析三疣梭子蟹在不同发育阶段的表达量发现,Pt-ddit4l基因在发育的不同阶段均有一定的表达, 但在胚胎发育期间表达量出现明显上调; 而溞状幼体期间表达量与囊胚期相比没有显著上调(P>0.05), 推测Pt-ddit4l基因可能主要在三疣梭子蟹的胚胎期发挥作用, 这与对小鼠胚胎染色发现发育早期的信号较强的结果相似[16]。这些结果都表明Pt-ddit4l基因可能发挥了一定的维持正常发育或抵御外界病原感染的功能。
3.3 Pt-ditt4l基因的免疫防御机制
受到弧菌感染后,Pt-ddit4l在肝胰腺中的表达量出现明显下调, 且显著低于对照组(P<0.05)。而Imen等[15]通过对人单核细胞U-937进行瞬时转染的研究结果也表明在ddit4l基因表达水平高的细胞中,Bax/Bcl2 mRNA的比率显著增加, 与正常细胞相比Bax的表达量几乎不变或略微下降, 而Bcl2基因的表达量却显著下降, 推测其可能介导了细胞凋亡,且在一定程度上抑制了凋亡基因发挥作用; 在受到弧菌感染后, 肝胰腺中Pt-ddit4l表达量降低可能促进凋亡基因表达以清除体内病原微生物, 但其具体机制尚不明确, 有待进一步的深入研究[17]。甲壳动物免疫属于非特异性免疫, 血细胞在机体的抗病免疫反应中发挥着重要的作用[18,19]。外界异物可以刺激血细胞提高其吞噬能力, 如对克氏原螯虾和扇贝注射病毒和细菌可显著提高它们血细胞的吞噬活性[20—22]。梭子蟹在受到副溶血弧菌入侵时, 血细胞可能产生吞噬作用将其转移到细胞内部后灭杀,而本实验结果也显示, 弧菌胁迫后Pt-ddit4l的表达量显著上调, 12h时在血细胞中达到峰值(8.85倍),表明Pt-ddit4l基因可能提高血细胞的吞噬活性。此外,Pt-ddit4l在受到副溶血弧菌刺激后的血细胞中的表达趋势与Zhang等[23]、Yang等[24]和Wang等[25]报道的C-型凝集素、C型清道夫受体和Toll受体免疫因子受到弧菌刺激后的变化趋势一致。因此, 我们可以推断Pt-ddit4l在免疫防御过程中也发挥了一定的作用, 可能为一种新的免疫因子。
为了进一步证明Pt-ddit4l是否参与三疣梭子蟹的免疫防御, 本研究通过RNA干扰对该基因进行了沉默, 随后进行副溶血弧菌感染实验, 结果表明: 在注射dsddit4l后,Pt-ddit4l基因表达量出现显著下调(P<0.05), 这表明对该基因的干扰是有效的; 同时,沉默Pt-ddit4l基因后, 感染弧菌的实验组死亡率显著高于对照组, 且在6h时死亡率差距最大, 这与干扰后基因沉默的时间表现出吻合。这些结果都表明了, 三疣梭子蟹的Pt-ddit4l基因参与了体内的先天免疫应答。
本研究探究了三疣梭子蟹在病原感染下Ptddit4l基因的表达模式及调控机制, 成功克隆了Ptddit4l基因的cDNA全长, 分析了Pt-ddit4l基因在胚胎发育、组织表达分布、弧菌感染以及注射RNA干扰和副溶血弧菌感染后的死亡统计, 初步了解到ddit4l基因的响应机制, 为深入探究三疣梭子蟹在副溶血弧菌感染中的作用机制提供了理论支持。

