大豆蛋白/蛋清蛋白复合凝胶特性的研究
杨娟,罗玮倩,何曼源
1(岭南师范学院 食品科学与工程学院,广东 湛江,524048)2(华南理工大学 食品科学与工程学院,广东 广州,510641)
大豆蛋白是一种性价比高、富有营养的产品。虽然我国食用豆制品已有悠长历史,但由于大豆蛋白属于球蛋白,其结构保守,聚集的驱动力多以疏水作用、氢键等物理相互作用为主,聚集体结构无序,凝胶强度不足,二硫键含量低,使得制备的大豆蛋白凝胶等食品易出现口感粗糙,滋味不足,结构松散的现象,由大豆蛋白制成的凝胶食品不能提供具有弹性的、坚韧的口感质构[1-4]。解决该问题可通过选择性混合二硫键含量丰富的蛋清蛋白于其中,制出一种高蛋白、风味口感俱佳的植物蛋白和动物蛋白混合物。蛋清蛋白富含二硫键,可形成以共价键支撑的凝胶网络,赋予凝胶良好的口感质构及持水性[5-7]。利用其成胶特性,使其作为大豆蛋白热致凝胶过程中游离巯基的供体,使复合体系可形成更多二硫键,最终达到改善大豆蛋白凝胶结构和质构的目的。本文研究大豆分离蛋白(soy protein isolate,SPI)与蛋清蛋白(egg albumin,EA)及其复合体系间的差异,利用万能材料机考察其成胶性能、扫描电子显微镜(scanning electronicmicroscope,SEM)观察其微观结构并分析其持水性能,了解不同条件下单一大豆蛋白体系和大豆蛋白/蛋清蛋白复合体系凝胶的状态,从而为选择性混合大豆蛋白与蛋清蛋白的进一步实验提供思路和理论基础。
1 材料与方法
1.1 实验材料
蛋清蛋白,Sigma公司;低温脱脂大豆粕,山东御馨生物科技公司;Folin-酚试剂盒,北京鼎国昌盛生物技术有限责任公司;其他试剂皆为分析纯。
1.2 仪器与设备
CR22G高速冷冻离心机,日本Hitachi公司;Alpha-4冷冻干燥机,德国Christ公司;RW 20顶置式搅拌器、T25分散均质机,德国IKA公司;Zeiss EVO18台式扫描电子显微镜,德国Carl Zeiss;Genesys 10 s分光光度计,美国Therom Fisher公司;5943万能材料试验机,美国Instron公司。
1.3 实验方法
1.3.1 大豆分离蛋白的制备
采用WANG等[8]的方法制备大豆分离蛋白。
1.3.2 聚丙烯酰胺凝胶电泳
通过SDS-PAGE考察大豆蛋白及蛋清蛋白原料的蛋白组成[9-10]。配制分离胶缓冲液(1.5 mol/L Tris-HCl pH 8.8)、浓缩胶缓冲液(0.5 mol/L Tris-HCl pH 6.8)、30%(体积分数)单体贮液、10%(质量分数)SDS、电泳缓冲液。分离胶由10 mL分离胶缓冲液、17 mL 30%单体贮液、0.4 mL 10% SDS、12.4 mL去离子水加250 μL 过硫酸铵(ammonium persulfate,AP)后迅速摇晃,再迅速加入25 μL 四甲基乙二胺四甲基乙二胺(N,N,N′,N′-tetramethylethylenediamine,TEMED)组配。浓缩胶由5 mL浓缩胶缓冲液、3.4 mL 30%单体贮液、0.2 mL 10%SDS、11.4 mL去离子水、加120 μL AP后迅速摇晃再加10 μL TEMED组配。Marker上样量7μL,蛋白样品(质量浓度2.5 mg/mL)上样量10 μL。
1.3.3 蛋清蛋白溶解性
采用Folin-酚试剂盒进行测定。
1.3.4 成胶性能测定
配制8 mL 2%~12%(体积分数)的蛋清蛋白溶液、8 mL 10%~15%(体积分数)的SPI蛋白溶液、8 mL 10%~15%的大豆蛋白/蛋清蛋白复合溶液(质量比为4∶1)并调至pH 5.5,置于95 ℃水浴30 min,冰水冷却至室温。将凝胶样品切成长度为10 mm、直径为14.36 mm的截面平整的圆柱体,利用万能材料机测定质地剖面分析(texture profile analysis,TPA)曲线,选用直径为25 mm的探头,速度均为1 mm/s,形状采用绝对斜线段,凝胶压缩强度为30%,首次压缩后探针停滞保持1 s后进行二次压缩,TPA曲线最高峰点对应凝胶硬度[4,11]。另考察pH 7.0和pH 5.5时的凝胶成胶性能以及等电点成胶的优势。
1.3.5 持水性测定
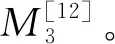
(1)
1.3.6 微观结构
配制60 mL 5%(体积分数)戊二醛溶液,混合60 mL 40 mmol/L的磷酸缓冲液作为固定液使用。将制好的凝胶固定过夜,然后用20 mmol/L的磷酸缓冲液漂洗3次,以30%~100%不同体积分数的乙醇对凝胶进行梯度脱水10 min并切薄片,置于导电胶上,喷金处理后在扫描电镜10 kV条件下观察[13-14]。
2 结果与分析
2.1 蛋白质的组成
经分析,2种蛋白质条带对应的类别如图1所示。

图1 SPI与EA的SDS-PAGE图Fig.1 SDS-PAGE image of SPI and EA
2.3.2 蛋清蛋白溶解性
蛋清蛋白于pH 8.0条件的溶解度最高,随着pH下降,在pH 5.0时溶解度达到最低。呈现典型的蛋白质溶解度曲线。SPI在pH 4.5处达到等电点,二者等电点接近。选择pH 5.5即接近两者等电点处作为成胶条件可使凝胶强度相对较强[15-16]。

图2 pH 2~8时100 μg/mL EA溶液溶解度Fig.2 Solubility of 100 μg/mL EA solution at pH 2-8注:不同小写字母表示具有显著性差异(P<0.05)(下同)
2.3.3 蛋清蛋白及大豆蛋白/蛋清蛋白复合体系成胶性能
2%~12%的EA、10%~15%的SPI和SPI+EA加热后所形成的凝胶形态如图3所示。

a-5%~12%的EA凝胶形态;b-10%~15%的SPI凝胶形态;c-10%~15%SPI+EA凝胶形态图3 蛋白浓度为2%~12%的EA、蛋白浓度为10%~15%的SPI和SPI+EA凝胶形态Fig.3 Morphology of EA gel with 2%-12% protein content,SPI gel with 10%-15% protein content and SPI+EA composite gel
EA溶液,体积分数为2%时难以成胶。溶液体积分数为4%可形成结构仍然不紧致凝胶,无法切块后直立。溶液体积分数为5%及以上,凝胶结构和质地良好且强度随蛋清蛋白浓度的增加逐渐升高[16-17]。10%~15%的SPI溶液加热后可形成完好凝胶,但凝胶结构仍不紧致。凝胶结构强度随大豆蛋白浓度增加逐渐升高,形状更加完整,质地愈来越硬。10%~15%的SPI+EA复合溶液加热后形成的凝胶结构强度随着SPI+EA蛋白浓度的增加逐渐升高,其质地也越来越硬。相比于单纯的大豆蛋白凝胶,同一浓度复合凝胶结构的完整性及质地有明显的优势。TPA曲线分别对应5%~12%的蛋清蛋白凝胶。溶液浓度为6%及以上时,凝胶硬度逐渐上升,逐渐形成了结构良好、完整的圆柱体,即凝胶硬度随着蛋清蛋白浓度的增加而上升,趋势明显。同一浓度和处理条件下,添加了蛋清蛋白后的复合体系形成的凝胶结构更紧密,质地硬度更高,成胶性能大大提升。

图4 蛋白浓度为5%~12%的EA、蛋白浓度为10%~15%的SPI以及SPI+EA凝胶硬度Fig.4 Hardness of EA gel with 5%-12% protein content, SPI gel with 10%-15% protein content and SPI/ EA composite gel
2.3.4 蛋清蛋白持水性
不同浓度蛋清蛋白间的持水性能差异如图5所示。在5%~12%,随EA溶液浓度的增加,其持水性能提高。更多蛋白加入到凝胶网络中带来更多的亲水基团,将更多的水束缚在网络内。随着蛋白浓度增加,网络结构增强,网络内可承载水分量增加。随着SPI和SPI+EA复合体系浓度的增加,体系的持水性逐步加强。相比于同一浓度的单一SPI溶液体系,复合体系的持水性具有优势,蛋清蛋白的加入不仅能够增加二硫键来改善蛋白凝胶的硬度,还能锁住更多的水分。
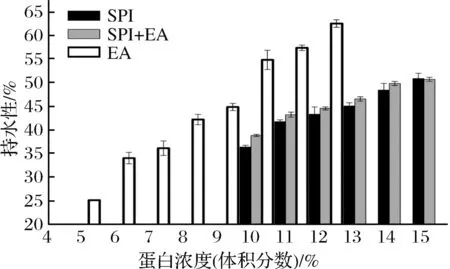
图5 蛋白浓度为5%~12%的EA、5%~12%的SPI及SPI+EA凝胶持水性Fig.5 Water holding capacity of EA gel with 5%-12% protein content, SPI gel with 10%-15% protein content and SPI+EA composite gel
2.3.5 蛋白凝胶微观结构
通过SEM观察到的微观结构如图6所示。凝胶网络是由多个聚集体小球组装成凝胶的三维网络,在浓度较低时,EA复合凝胶疏松,孔隙和颗粒更多,在浓度较高时,蛋白体系形成了结构紧密的状态。随着蛋白体系浓度的增加,凝胶微观结构从疏松过渡为致密,凝胶机械强度由此提升,颗粒数的明显降低和越来越致密网络导致了凝胶持水性的提高。浓度相同时,在浓度较低时,纯SPI凝胶较SPI+EA复合凝胶疏松,孔隙和颗粒更多,在浓度较高时,2种蛋白体系都形成了结构紧密的状态。蛋白浓度低时,SPI网络是颗粒球堆砌起来,而加了蛋清蛋白以后,有了更多共价键参与网络的构建,EA融入了SPI网络,形成了更清晰的网络结构,使蛋白网络更致密,因而改善凝胶的硬度和持水性。

a-EA 5%;b-EA 6%;c-EA 7%;d-EA 8%;e-EA 9%;f-EA 10%;g-EA 11%;h-EA 12%;i-SPI 10%;j-SPI+EA 10%;k-SPI 11%;l-SPI+EA 11%;m-SPI 12%;n-SPI+EA 12%;o-SPI 13%;p-SPI+EA 13%;q-SPI 14%;r-SPI+EA 14%;s-SPI 15%;t-SPI+EA 15%图6 蛋白浓度为5%~12%的EA以及10%~15%的SPI与SPI+EA微观结构Fig.6 Microstructure of SPI gel, SPI+EA composite gel with 10%-15% protein content and EA gel with 5%-12% protein content
2.3.6 不同pH下蛋白体系成胶性能
对比10%浓度下不同pH和不同构成的蛋白溶液加热后形成的凝胶的成胶性能,结果如图7所示。
10% pH 7.0 EA溶液热处理可以形成质地良好的凝胶,相比于相同条件下SPI与EI复合溶液所形成的凝胶硬度更高,主要源于蛋白在相对较高pH下,热处理可形成更多二硫键,所形成凝胶的质地结构更好,而pH较低时,二硫键则形成得少[18]。pH 7.0的SPI+EA复合溶液的持水性效果最佳,可见混合SPI可以提高蛋白体系的持水性能。选择pH 5.5作为凝胶条件,接近两者等电点,可以使凝胶的强度相对较强,但持水性比pH 7.0时相对较差,因为此时接近等电点,蛋白与水的相互作用相对弱一些。10% pH 7.0时SPI+EA复合凝胶相比于10% pH 7.0相同条件的EA凝胶更加致密、平整,因为形成了完整、质地紧致的透明状凝胶,水分含量极高,蛋白固体沉淀很少。在10% pH 5.5时,SPI+EA复合凝胶结构相比之下疏松许多,颗粒数明显增加。

a-硬度、凝胶形态;b-持水性、微观结构图7 蛋白凝胶硬度、蛋白凝胶形态、持水性和微观结构Fig.7 Hardness, gel morphology, water holding capacity and microstructure of protein gel
3 结论与讨论
纯大豆蛋白形成的凝胶二硫键含量很少,凝胶结构疏松,与蛋清蛋白相比,相差比较远,在大豆蛋白溶液中添加蛋清蛋白溶液(质量比为4∶1),可以增加所形成的凝胶中含有的二硫键,从而增加凝胶的硬度,使其拥有良好的质地,微观形貌体现了凝胶结构从疏松过渡为致密,颗粒数明显降低。此外,添加了蛋清蛋白所形成的凝胶的持水性能也有所改善。
蛋白在相对较高pH下,热处理可形成更多二硫键,而pH较低时,二硫键则形成得少[19-20]。当pH 7.0时10%纯大豆蛋白溶液无法形成凝胶,当添加了蛋清蛋白质之后可以形成具有良好结构和持水性更好的凝胶。随着蛋白浓度增加,蛋白质相互接触的机会增加,疏水作用增强,更易形成三维网络结构,且结构的强度和持水性能随之增加。利用蛋清蛋白作为大豆蛋白热致凝胶过程中游离巯基的供体,可使复合体系可形成更多二硫键,在提升硬度的同时增加也能其持水性,赋予凝胶良好的质构。

