基于PI3K/Akt/mTOR 信号通路研究小青龙汤方对小青龙汤证大鼠模型PI3K、Akt、mTOR mRNA 表达的影响
郑 爽,何丽清
(山西中医药大学,山西 晋中 030619)
小青龙汤方出自东汉张仲景《伤寒杂病论》第40 条“伤寒表不解,心下有水气,干呕,发热而咳,或渴,或利,或噎,或小便不利、少腹满,或喘者,小青龙汤主之”和第41 条“伤寒,心下有水气,咳而微喘,发热不渴,服汤已,渴者,此寒去欲解也,小青龙汤主之”[1]。药物组成为麻黄、生姜、桂枝、芍药、细辛、半夏、五味子、甘草,主治外寒内饮证,临床上以治疗肺系疾病为主。PI3K/Akt/mTOR 信号通路参与细胞增殖、凋亡与自噬的调控,影响许多呼吸系统疾病的预后与转归[2-3]。本研究观察不同剂量小青龙汤对于小青龙汤证大鼠模型肺组织中PI3K、Akt、mTOR mRNA 表达的影响,为进一步探究小青龙汤证的证候实质提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 雄性Wistar 大鼠24 只,体质量(220±20)g,购于斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002。饲养于普通动物房,饲养环境温度和湿度良好。
1.1.2 实验仪器 BIO-RADCFX96 Touch 定量PCR仪、C1000 Touch PCR 仪,美国伯乐(BIO-RAD)公司;NanoDropTMOne 微量紫外-可见光分光光度计,美国赛默飞世尔科技公司。
1.1.3 药物与试剂 小青龙汤方药,由山西中医药大学附属医院药房提供。RNA 提取试剂盒(DP431),购自天根生化科技(北京)有限公司;PCR 扩增和反转录试剂盒,购自宝日医生物技术(北京)有限公司。
1.2 实验方法
1.2.1 动物分组 造模大鼠适应性喂养1 周后,按体质量随机分为空白组、模型组、小青龙汤高剂量组和小青龙汤低剂量组4 组,每组6 只。除空白组外,其余各组制作小青龙汤证模型[4-7]。大鼠于室内温度10 ℃左右的寒冷环境中喂养,每日在(0±4)℃的低温环境下冷冻1 h,并让大鼠在冷水中游泳至水面淹没鼻尖时捞出,持续4 周。造模期间给与冷冻饲料及冰水(寒凉饮食)喂养。若大鼠出现咳嗽、呼吸急促、喘息、打喷嚏、饮食减少、反应迟钝、行动迟缓、爱扎堆、立毛、拱背、蜷曲等情况,则造模成功。
1.2.2 药物干预与取材 造模成功后,高、低剂量组大鼠每天按1 mL/100 g 体质量小青龙汤灌胃,连续灌胃15 d,大鼠的给药剂量按照《药理实验方法学》[8]人和动物间按体表面积折算的等效剂量比值计算,高、低剂量组给药量为折算后大鼠等效剂量的2 倍和1/2,药物浓度分别为0.16 g/mL 和0.04 g/mL,空白组和模型组大鼠灌服生理盐水,连续灌胃15 d 。大鼠末次灌胃1 h 后,10%水合氯醛腹腔注射麻醉,开胸取出肺组织,使用生理盐水冲洗后保存于-80 ℃冰箱。
1.2.3 RT-qPCR 法检测大鼠肺组织中PI3K、Akt、mTOR mRNA 的表达 按照RNA 提取试剂盒说明书的操作步骤提取肺组织RNA 后,检测样本RNA 浓度,根据浓度按说明书比例配置RNA 模板,每份20 μL。以37 ℃,15 min;85 ℃,5 s;4 ℃条件进行反转录。PCR 反应体系:10 μL SYBR Premix,1 μL 上游引物,1 μL 下游引物,2 μL cDNA 溶液,6 μL dH2O。PCR 扩增使用两步法:95 ℃,30 s,1 次;95 ℃,5 s,退火60 ℃,30 s,40 次。PCR以β-actin 为内参,实验结束后记录各个样品Ct值,以相对定量分析法2-ΔΔCt进行分析。PI3K、Akt、mTOR、β-actin 所用引物序列及长度如表1。

表1 RT-qPCR 检测引物序列
1.3 统计学方法
经SPSS 21.0 软件进行统计处理,若数据满足正态分布和方差齐性,以均数±标准差()表示,采用单因素方差分析进行统计;若不服从正态分布和方差齐性,以Md(P25,P75)表示,采用非参数检验中的Kruskal-Wallis 检验进行统计。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠一般情况
造模过程中,模型组死亡1 只,其余各组造模成功。造模各组大鼠均出现咳嗽、呼吸急促、喘息、打喷嚏、饮食减少、反应迟钝、行动迟缓、爱扎堆、立毛、拱背、蜷曲等情况。与空白组比较,模型组与小青龙汤治疗组大鼠体质量在造模后增加不明显,甚至出现负增长(P<0.01)。经过药物干预治疗后,与空白组比较,模型组大鼠质量增长仍不明显(P<0.05);与模型组比较,小青龙汤高、低剂量组大鼠体质量明显增加(P<0.01)。结果见表2。
表2 小青龙汤对各组大鼠体质量的影响(g,)
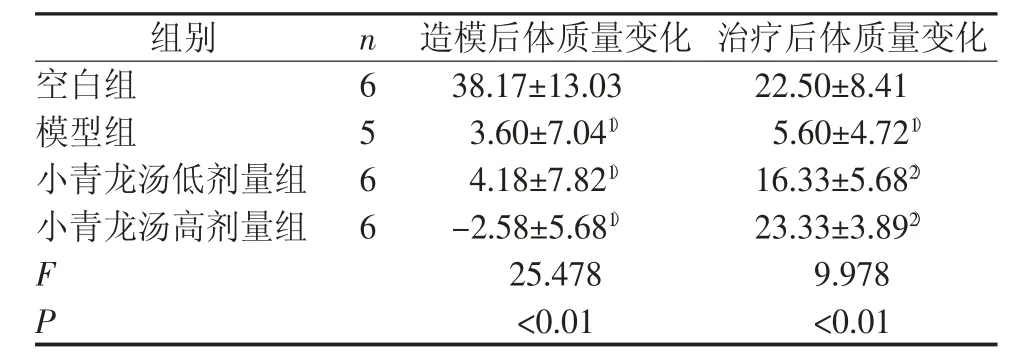
表2 小青龙汤对各组大鼠体质量的影响(g,)
注:与空白组比较,1)P<0.01;与模型组比较,2)P<0.01
2.2 各组PI3K、Akt、mTOR mRNA相对表达量比较与空白组比较,模型组PI3K、Akt、mTOR mRNA 相对表达升高(P<0.05)。与模型组比较,小青龙汤高剂量组PI3K、Akt、mTOR mRNA 相对表达降低(P<0.05,P<0.01),小青龙汤低剂量组PI3K、Akt、mTOR mRNA 相对表达降低,但差异无统计学意义(P>0.05)。结果见表3。

表3 各组大鼠肺组织中PI3K、Akt、mTOR mRNA 相对表达量Md(P25,P75)
3 讨论
小青龙汤是临床上治疗外寒内饮的常用方剂,在抗炎、平喘、抗过敏等方面效果显著,能够改善肺部通气状况、干预气道重塑。关于小青龙汤治疗支气管哮喘和变应性鼻炎等肺系疾病的文献报道有很多[9-10],但对小青龙汤证这一外寒内饮证的发生发展缺乏分子生物学基础的研究和探讨。前期我们已经运用数据挖掘技术研究古今小青龙汤相关医案,深入分析小青龙汤证的本质[11],运用NMR、GC-MS、LC-MS 3 种代谢组学技术检测小青龙汤证的特征小分子代谢物,发现小青龙汤的作用机制与能量代谢、免疫调节和减轻炎症反应相关[12]。故本次实验基于PI3K/Akt/mTOR 信号通路,研究小青龙汤对于小青龙汤证大鼠模型肺组织PI3K、Akt、mTOR mRNA 表达的影响,进一步探究小青龙汤证候实质。
PI3K/Akt/mTOR 信号通路是人体的经典信号通路之一。PI3K 是一种存在于细胞质中的脂类激酶,能够磷酸化磷脂酰肌醇D3 位。Akt 是PI3K 下游的关键蛋白,是一种丝氨酸/苏氨酸蛋白激酶[13]。mTOR 属于PIKK(磷脂酰肌醇3 激酶)激酶家族,由mTORC1 和mTORC2 复合体组成。PI3K 受到上游生长因子等刺激而激活,磷酸化合成PIP3(三磷酸肌醇),PIP3 结合Akt 并激活PDK1(磷酸肌醇依赖酶),PDK1 改变Akt 的蛋白结构,使Akt磷酸化并被激活,激活后的Akt 会直接或者间接活化其下游的mTORC1 和mTORC2 复合体,进而作用于mTOR 的下游底物,影响到微管组织的解聚、脂肪蛋白质合成与分解、细胞自噬和凋亡及肌动蛋白细胞骨架的调节等。有研究表明,抑制PI3K/Akt/mTOR 信号通路的表达可以降低肺部炎性反应的发生[14-15],调控肺部上皮细胞自噬[16]。通过影响PI3K 的表达,抑制Akt 和mTOR 的磷酸化水平,减轻炎症,影响气道重塑[17-18]。PI3K/Akt/mTOR 信号通路在免疫调节[19]、能量代谢[20]、减轻炎症反应[21]等方面均起到调节作用。这与我们前期对于小青龙汤证证候实质的研究结果相吻合。
本次实验结果表明,造模后空白组大鼠体质量显著升高,其余各组体质量较造模前增加不明显,甚至减轻,提示大鼠在造模过程中,因感受外邪,内有水湿,正气受损,结合大鼠一般情况表明小青龙汤证大鼠造模成功。经小青龙汤治疗后,除模型组外,其余各组大鼠体质量均显著升高,表明小青龙汤治疗后机体有所恢复。与空白组比较,模型组PI3K、Akt、mTOR mRNA 相对表达量均升高,表明小青龙汤证发生发展与PI3K、Akt、mTOR mRNA 的表达上调相关。与模型组比较,高剂量组大鼠肺组织中PI3K、Akt、mTOR mRNA 相对表达量明显下降,表明小青龙汤高剂量治疗效果明显,其作用机制与其能够下调PI3K、Akt、mTOR mRNA 的相对表达量有关。
综上所述,小青龙汤证的发生发展与PI3K、Akt、mTOR mRNA 的上调相关,小青龙汤治疗机制与其能够下调PI3K、Akt、mTOR mRNA 的相对表达量有关。但本研究只是初步验证了小青龙汤对于PI3K/Akt/mTOR 信号通路的调节作用,由于中药多通路多靶点的特点,下游靶蛋白尚未明确,是否与其他信号通路协同作用,有待更进一步的研究。

