番茄microRNA调控生长发育及逆境响应的研究进展
李 宁,王 娟,王柏柯,戴 麒,黄少勇,帕提古丽,高 杰,余庆辉
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆农业大学林学与园艺学院,乌鲁木齐 830042)
0 引 言
【研究意义】植物在生长发育和逆境响应过程中,伴随着基因表达在转录水平、转录后水平和翻译后水平通过不同的机制进行调节。近年来,在转录水平上的基因调控得到了很好的研究,植物microRNAs引起广泛关注[1]。番茄miRNAs在生长发育及响应逆境的研究,有助于进一步解析番茄在不同逆境胁迫下基因表达的调控机制,为番茄育种提供新的基因资源,奠定更为完善的理论基础。为寻求番茄品质和产量之间最佳平衡,将来研究应重点围绕miRNAs及其靶基因对番茄的调控机制,尽早明确调控抗逆和发育的相关靶基因,并进行克隆功能验证,定向改变番茄果实品质及生长周期,为番茄耐逆高产新品种的分子育种和品种改良提供新方案。【前人研究进展】miRNAs(microRNAs)是一类在植物和动物基因组中自然发生、高度保守且短小的非编码RNA分子。植物miRNAs是一类长度为20~24 nt的内源性非编码小RNA[2],通过对靶基因(mRNA)的降解或抑制其翻译,在转录后水平介导基因的表达,参与包括生长发育、转座子沉默、信号转导、对胁迫应激反应等生物学过程的调控[3]。番茄(Solanumlycopersicum)不仅是研究肉质果实成熟的模式植物,又是我国重要的出口优势农产品之一[4],位居蔬菜单项产品出口第2位,仅番茄酱年均出口量约占世界贸易量的1/3[5]。研究影响番茄在生长发育过程中不同的逆境胁迫,对提升番茄风味和品质有重要意义。【本研究切入点】当前,随着研究的不断深入,检索总结国内外相关miRNAs起源、作用机制,调控番茄生长发育及响应生物胁迫和非生物胁迫的研究进展[6]。【拟解决的关键问题】采集相关文献、官网等资料,包括miRNAs的合成、作用机制及相关网站,分析番茄miRNAs在生长发育及响应胁迫过程中的功能,对加快番茄品种的分子育种和改良奠定理论基础。
1 材料与方法
1.1 材 料
收集查阅国内外文献资料、相关网站和番茄转录组的前沿研究进展。
1.2 方 法
整理汇总并对比分析番茄miRNAs研究数据。
2 结果与分析
2.1 miRNA的合成及作用机制
2.1.1 植物miRNA的合成
miRNA通常位于基因区间,但也会位于基因内含子的正义或反义链上。在细胞核中由RNA聚合酶II(Pol-II)转录,初级转录为具有“7-甲基鸟嘌呤核苷酸”帽子(m7GpppN)和多聚腺苷酸尾巴的pri-miRNA[7-8]。随后Dicer同源物DCL1(DICER-LIKE酶)对其实施2次切割,先后生成具有茎环结构的pre-miRNA以及miRNA/双体结构,随后miRNA/miRNA*(miRNA*为miRNA的互补序列)的3’末端会被甲基转移酶HEN1(HUAenhancer1)进行甲基化[9-10]。Pre-miRNA在HASTY(Exportin 5在植物中的同源蛋白)的协助下从核内转运到细胞质中[11]。
在细胞质中,双链复合物中miRNA与AGO(Argonaute)蛋白质结合成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC),进而指导AGO对互补靶基因的mRNA进行切割,从而抑制靶基因的表达[12-13]。RISC加载后,miRNA/miRNA*双螺旋主要由AGO蛋白解旋[14]。双链中miRNA*直接脱离被迅速降解,另一条成熟的单链miRNA保留在这一复合体中,并结合到与其互补的mRNA的位点通过碱基配对调控基因表达[15]。
2.1.2 植物miRNA的作用机制
miRNA对基因的调控是通过构成RISC来进行的,RISC是其调控的物质基础,AGO蛋白是RISC复合体中的核心蛋白。miRNA-RISC识别mRNA,通过靶标切割或翻译抑制,负调控靶基因的表达,miRNA-RISC对靶基因mRNA的作用主要取决于它与靶基因转录体序列互补的程度[15]。在植物中最为常见的方式是假设miRNA与靶基因mRNA的结合位点完全互补,将会引起目的基因mRNA在互补区的特异性断裂,最终导致基因沉默[16]。其作用方式是通过miRNAs的5’端残基识别并和靶基因mRNA的开放读码框(open reading frame,ORF)互补配对切割,主要在mRNA的第10/11个碱基间进行切割,通过细胞质降解因子(XRN4)催化降解,最终使靶向mRNA无法翻译[17]。
第2种是抑制靶基因翻译,当成熟miRNA与靶基因mRNA的3’端非翻译区(untranslated region,UTR)不完全互补配对,进而mRNA的翻译受到抑制,但不影响mRNA的稳定性和转录,miRNA将通过翻译抑制的方式来调控靶基因;并且对靶基因翻译的抑制可能需要多种miRNA分子的协同作用,miRNAs与靶基因存在着反馈抑制调节途径[18-19]。
2.1.3 miRNAs数据库
目前miRNAs的数据库日渐丰富,高通量测序的出现有助于植物miRNAs的数量呈指数增长,不仅可以识别大量miRNAs,而且通过生物信息学和试验结果相结合为预测鉴定植物miRNAs功能注释提供大量可靠数据[16,20]。PMTED是1个植物特异性miRNA数据库,通过在大量现有微阵列数据中推断miRNAs的靶基因表达谱,从而研究miRNAs功能。PMRD数据库包含了来自120种模式植物以及主要农作物的8 400多个miRNAs条目,包括拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)、小麦(Triticumaestivum)、大豆(Glycienemax)和玉米(Zeamays)等几百种植物的miRNA,参与调控植物生长发育和胁迫响应等生物学过程[21]。表1
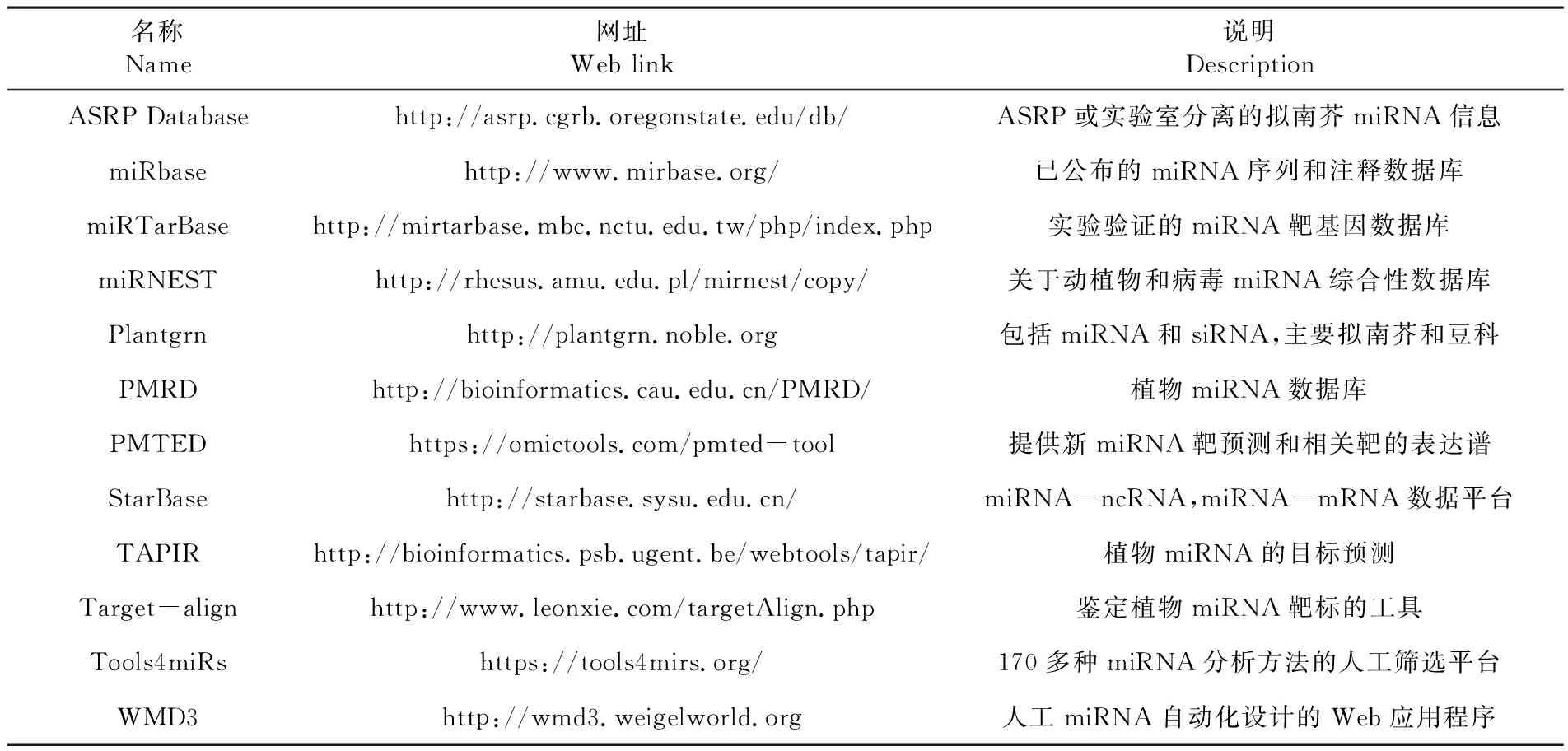
表1 部分植物相关miRNAs计算工具和数据库Table 1 Computational tools and databases of some plant-related microRNAs
2.2 miRNAs在番茄生长发育的作用
miRNA在番茄生长发育中起到重要作用,当番茄过表达miR171时,通过抑制靶基因GRAS基因家族(SLGRAS24),导致番茄植株变大。缺氧处理后,野生番茄的形态学发生改变推测是生长素稳态相关的miR159、miR171和miR396表达差异所导致[22]。番茄miR167在调节生长素信号传导中的具有进化保守作用,其上调表达导致靶基因生长素响应因子(auxin response factor,ARF6/8)的表达下降,从而影响生长素信号通路[23]。番茄通过SlARF10调节气孔孔径来减少水分损失,维持叶片水分平衡,Sl-miR160通过对SlARF10的转录后调控,增加了脱落酸(abscisic acid,ABA)合成信号响应,从而保证植物正常发育和环境适应[24]。
番茄花梗脱落过程中,乙烯能够影响miRNA的表达和调控,最终促进花梗脱落。在脱落过程中,乙烯可以介导miR160和miR167的表达,二者是生长素信号的重要介质。进一步研究发现,miR172在花梗脱落过程中表达显著升高,靶基因APETALA2乙烯响应转录因子(AP2c)上调,而乙烯负调控miR172的表达[25]。番茄7B-1是一种光周期敏感的雄性不育突变体,赤霉素信号转导途径MYB转录因子(gibberellin- and abscisic acid-regulated MYB,GAMYB1)的表达与7B-1花药发育和茎中的miR159水平呈负相关,miR396在7B-1花药和茎中促进胱抑素(cystatin)的分裂,miR159-GAMYB1和miR396-cystatin级联反应与7B-1的小孢子和花药发育调控密切相关[26]。miRNA159/GAMYB1/2对番茄胚珠发育和果实发育至关重要。过表达SlmiR159的番茄,其植株表现果实早熟与单性结实,但果实形状未发生改变。此外,在转基因株系中SlGAMYB1/2能够导致与胚珠、雌配子体发育和生长素信号传导相关通路的错误调节[27]。
在番茄gib-3突变体中,miRNA160、miRNA167及其靶点可能参与顶端分生组织的细胞分裂,miRNA调控的SlARF6、SlARF8、SlARF10和SlARF16的表达与果皮细胞层发育呈负相关,由此推论ARFs表达水平的升高可能是生殖细胞分裂终止的主要因素[28]。在番茄生长过程中,过表达miR164能够影响番茄植株形态及果实单个发育阶段的必需时间。将来miR164可用于改善重要品种的农艺性状[29]。番茄Sly-miR1917通过调节特异性转运蛋白(SlCTR4)剪接变异体SlCTR4sv(乙烯信号的负调节器)的表达参与植物乙烯反应,过表达Sly-miR1917增强了乙烯生物合成和信号转导相关基因的上调,并加快花梗脱落和果实成熟[30],与miR172促进花梗脱落功能相似。乙烯参与了番茄果实发育和成熟过程中miRNA积累调控。Sly-miR157在正常番茄果实和果实无色不成熟突变体(Colourless non-ripening,Cnr)中调节关键成熟基因SQUAMOSA启动子结合蛋白(SQUAMOSA promoter-bindinglike,SPL)LeSPL-CNR的表达。LeSPL-CNR可能影响LeMADS-RIN、LeHB1、SlAP2a和SlTAGL1的表达,在番茄果实成熟过程中,Sly-miR156不影响果实成熟,SlymiR157和SlymiR156形成一种附加关键调控层,影响红熟期果实的软化[31]。RIN通过结合其启动子区域直接抑制miR172a转录,并影响miR172的积累[32]。
2.3 miRNAs对逆境胁迫的响应
2.3.1 miRNAs与干旱胁迫
干旱是制约全球农业生产的主要因素,据估计每年全球一半农作物受干旱胁迫,超过其他逆境胁迫造成损失的总和[33]。众所周知对植物耐旱性的基础研究已经确定了许多干旱胁迫相关的抗性基因,过表达这些胁迫响应基因能够提高植物的应激耐受性。然而除了蛋白质编码基因外,植物中的miRNAs在应激条件下的表达也发生了变化,研究表明miRNAs介导的植物胁迫响应是通过调控靶基因来实现的,值得注意的是,越来越多的研究表明,miRNAs在植物耐旱性和抗旱性方面发挥着关键作用。然而,关于干旱胁迫下番茄中miRNAs及其靶点的信息仍然非常有限[34]。
Liu等发现野生番茄潘那利渐渗系IL9-1在干旱胁迫下,sly-miR6024、sly-miR1009和其对应靶基因(solyc06g72130、solyc12g099800)显著上调,一些保守的miRNAs在番茄中也首次被鉴定为对干旱有反应,如sly-miR1919、sly-miR5300和sly-miR9477。[35]。此外,miR156、miR169、miR172和miR319在拟南芥、水稻和小麦中受到干旱胁迫的诱导,表达水平发生了显著变化,而且这些miRNAs在番茄中同样受干旱胁迫诱导表达[36]。野生番茄潘那利渐渗系IL2-5在干旱处理后,sly-miR166c-5p和sly-miR-429表达明显下调,相应的靶基因solyc03g02340和solyc01g08980在应激后表达显著升高。番茄渐渗系IL2-5干旱胁迫后,Sly-miR716下调表达,其靶基为膜联蛋白(Ca2+依赖性磷脂结合蛋白,Annexin V),该蛋白在植物抗逆境和发育中起着重要作用[37]。
miR165、miR166、miR398、miR9472、miR9476和miR9552都是参与番茄响应干旱胁迫的关键性miRNA。其中miR9552表现出对干旱、组织和基因型特异性,sly-miR9552a-3p仅在敏感基因型番茄根部表达。miR9552的靶基因是UDP葡萄糖基转移酶(UGT),抑制其表达将会增加根中UGT水平,从而降低敏感基因型的抗旱性[38]。
过表达miR1916的转基因番茄植株对干旱响应敏感,是通过降低渗透调节和活性氧清除的途径进行调控。miR1916的潜在靶基因是编码富含羟脯氨酸糖蛋白家族蛋白的SGN-U376418 mRNAs。与野生型相比,叶绿素含量的增加有助于增强miR1916转基因植物的耐旱性。miR1916在不同干旱胁迫时期的表达水平可能不同,是番茄抗旱性的负调节因子,对茄科植物的非生物胁迫反应具有潜在的影响[39]。
2.3.2 miRNAs与盐胁迫
土壤盐碱是限制作物生产的主要环境因素之一。目前转基因耐盐植物表现不理想,主要是复杂的遗传机制导致[34]。目前,非编码RNA中如miRNAs正迅速成为解码植物应激反应转录和转录后对基因调控的有效平台。响应盐胁迫植物miRNAs不断地被发现,其作用于靶基因并通过调控植物的生长发育等生物功能抵御外界盐胁迫危害[40]。
在醋栗番茄受盐胁迫诱导后发现3种新型miRNAs(sly-miRn7c-2、sly-miRn86a-1和sly-miRn97a),但在盐处理的栽培番茄M82中受到抑制表达。sly-miR160a、sly-miR166b、sly-miR166c-5p、sly-miR169a和sly-miR9470-5p是野生醋栗番茄特有的耐盐相关miRNAs,sly-miR482e-5p潜在的靶基因编码应激相关的GRAS转录因子、CBF转录因子、F-box,推测sly-miR482e-5p在番茄耐盐性中起关键作用。参与醋栗番茄耐盐过程的sly-miRn50a,其靶基因参与角质层、亚嘌呤和蜡质层的生物合成,这种途径可以通过减少蒸发来提高植物对盐和干旱胁迫的适应性[41]。
2.3.3 miRNAs与温度胁迫
随着全球气候变化,高温正在成为限制番茄产量的一个日益严重的因素。营养期和生殖期受到热胁迫的不利影响,从而导致产量和果实品质下降。与营养生长相比,高温胁迫对番茄生殖生长的影响更大,番茄耐热性基因型间存在广泛的变异性。而低温通过使细胞内水的结晶导致细胞和组织脱水,从而影响植物生长发育[6]。
在番茄生长发育和逆境胁迫中,成熟的miR167a与前体miR167a的表达模式呈现出相反模式[42]。在高温条件下,番茄植株通常表现出柱头外露的表型,严重阻碍番茄自花授粉和结实,miR398b-3p/SLCSD1、miR393-5p/SLTIR1、miR160a/SLRF10/16、miR156e-5p/SLSPL15和miR397-5p/LACs这些级联反应参与响应热激应答调控,例如雌雄蕊的代谢途径。生长素信号介导的miR393-5p/SLTIR1和miR160a/SLARF10/16级联反应被高温处理后激活,调控雄蕊发育[43]。
野生番茄醋栗在低温和中温中均能诱导miR156和miR396的表达,并抑制miR168在番茄植株中的表达。耐热醋栗番茄中调节碳固定的基因相关miRNA有助于维持高温下叶片的正常生理活动,从而增强耐热性。在高温胁迫下,spi-miR6300_gma,其靶基因为热激蛋白(heat-shock proteins,hsp70),而spi-miR166c-3p和spi-miR166g-3p_osa的靶基因为hsp60-3A,这些miRNAs可以通过调节热休克蛋白在植物对高温反应中发挥重要作用[44]。
可变剪接和miRNA差异表达是导致野生多毛番茄和栽培番茄品种间耐寒性差异的重要原因。miR159、miR319潜在靶基因均为MYB65,miR6022靶基因是拟南芥同源盒亮氨酸拉链蛋白(Arabidopsis thaliana Homeobox-leucine zipper protein,ATHB13),这3个非生物应激级联在低温应激反应中发挥重要作用。野生多毛番茄MiR319家族成员的表达与番茄的耐冷性呈正相关[45]。在热应激的初始阶段,miR319a、miR319b和miR319d对TCP3、TCP29和TCP2有调节作用,miR319a和miR319b启动子区发现了参与类黄酮生物合成基因调控的MYB结合位点MBSI,这表明miR319与TCP3和TCP29参与了由活性氧(ROS)和Ca2+信号传导和花青素合成引起的温度应激调节反应[46]。在冷胁迫或热胁迫下,过表达sha-miR319d野生多毛番茄植株抵抗应激能力明显增强,并且超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性升高,表明sha-miR319d可能通过抑制GAMYB-like1的表达来调节番茄的耐冷性,并进一步增强抗寒、耐热和ROS信号转导[47]。
2.3.4 miRNAs对生物胁迫的响应
随着番茄疫霉对番茄生产的威胁越来越大,解析番茄疫霉抗性机制日益迫切。植物具有一系列特定的抗病原体(R)基因,miR482/2118能够调节R基因的表达,即含有富氨酸重复区和核苷酸结合位点(NBS-LRRS)。在番茄感染疫霉病初期和后期由营养生长向生殖生长转变过程中,成熟Sly-miR482/2118及其靶基因的共调节作用最强并具有时间依赖性[48]。通过短串联靶标模拟技术(STTM)沉默miR482b,随着miR482b含量降低,植株对侵染疫霉病的抗性显著增强,miR482b的RNAi植株中,NBS-LRR的表达增强使番茄对疫霉病的抗性增强,表明了miR482b-NBS-LRR是番茄-感染疫霉病相互作用网络中的一个重要组成部分[49]。
过表达Sly-miR1916的番茄植株对疫霉病和灰霉病感染的敏感性显著增强。可能通过调节α-托马汀和花青素来调节番茄植株中STR-2、UGT和MYB12的表达,从而增强对生物胁迫的敏感性[50]。miR172家族通过调节AP2/ERF转录因子的表达参与逆境胁迫。过表达miR172a的转基因番茄中具有更大的抵抗感染性,miR172-AP2/ERF级联可以调节抗氧化剂,减少ROS的积累,防止感染后细胞膜损伤[51]。过表达pi-miR1918的番茄植株在感染疫霉病后表现出更严重的疾病症状,其靶基因sly-TG2的表达与miR1918的表达呈负相关,表明可能参与了靶基因的沉默,从而增强番茄对疫霉病的易感性[52]。
番茄枯萎病(Fusariumoxysporumf.sp.lycopersici,FOL)是一种危害番茄的全球性病害。番茄根在FOL感染下,sly-miR160a和new_mir_762靶向基因分别是生长素反应因子(Auxin response factors 10B、16A、16B、17、10A)和生长素调节的IAA(Auxin-regulated IAA7),生长素不仅是影响植物生长发育和非生物胁迫的重要植物激素,而且是一种新的降低病原菌毒力的功能分子。在植物-病原相互作用途径中,验证了9个抗病相关差异表达基因包括SLWRKY40/41、受体样丝氨酸/苏氨酸蛋白激酶、MYB相关转录因子、致病相关蛋白、类钙调素蛋白、钙结合EF-hand家族蛋白和环核苷酸门控通道[53]。烟草花叶病毒(TMV)侵染番茄后,6个miRNA家族13个miRNA表达水平的变化。TMV感染也会导致miR166c5p和miR319c-5p的快速诱导和高水平的积累。在TMV感染的番茄叶片上观察到的卷曲变形可能是由于miR159和miR166水平的改变。病毒侵染后,miR159和miR166在TMV侵染的番茄叶片中大量积累。miR159的靶点是在叶片发育过程中发挥了良好作用的MYB-TFs,miR166靶向同源结构域亮氨酸拉链转录因子(HD-ZIP-TF)家族,该家族对叶片发育也很重要[54]。
为进一步研究miRNA介导的植物-昆虫相互作用机制,对敏感型栽培番茄和抗性多毛番茄在感染烟粉虱后不同阶段的miRNAs进行了鉴定,共鉴定出44个已知miRNA家族,其中33个是2个物种共有,其中有13个新miRNA家族。miR168的唯一靶基因是AGO1,它是miRNA或siRNA介导的转录后基因沉默途径的核心成分。病毒诱导显著改变了AGO1(argonaute1)和miR168的表达水平,表明它们可能在应对生物胁迫中发挥作用。miR167靶向多重耐药相关蛋白和膜联蛋白基因。前者在植物中不仅参与植物解毒,而且还参与细胞壁通透性。膜联蛋白在抗逆和植物发育中也发挥着重要作用。番茄miR397的靶基因是一个属于多酚氧化酶类的lac酶,其功能主要与伤害、外界胁迫、食草动物或病原菌攻击有关[55]。
3 讨 论
miRNA是一类进化上保守的、具有调控功能的非编码小分子RNA。miRNA以碱基互补配对的形式靶向mRNA,将其降解或抑制翻译,进而在转录后水平负调控靶基因。自21世纪初首次报道植物miRNA以来,植物miRNA的相关研究有了显著的增长,在植物中,miRNA几乎在所有的生物学过程中都发挥重要的调控作用,特别是对一些重要的农艺性状的精细调控使其可以作为品种选育或改良的重要对象。近年来,随着测序技术及表型组学的发展,miRNA被证明能够调节各种应激反应的基因、蛋白质及转录因子,参与在逆境条件下维持生物应激耐受过程[56]。尽管一些作物如水稻、番茄、玉米、大豆、烟草等全基因组序列已经完成,但与生物(病毒、细菌和真菌感染)和非生物(盐度、营养缺乏、重金属)相关的miRNAs并没有完全注释[6]。尤其是在复合胁迫条件下,植物miRNAs及其靶基因对胁迫的调控机制成为植物科学研究的重要领域。
利用高通量方法和生物信息学工具,可以识别出新的miRNAs及其靶基因,含有miRNAs或其靶基因的转基因作物植株对非生物胁迫(干旱、盐分、温度等)具有一定抗性。miRNA基因调控是一种新的、可行的提高植物抗逆境能力的方法。RNA干扰(RNA interference,RNAi)是植物针对病毒侵染的一个重要的应答反应。人工微RNA(artificial miRNA,amiRNA)是一种沉默基因表达的第2代RNAi技术[57],在转基因植物中的表达通过靶向病毒抑制转录物而产生病毒抗性,因此,amiRNA介导的方法可以为在经济重要的农作物中工程化多病毒抗性提供广泛的应用。随着miRNAs研究的深入,有望定向改变番茄果实品质及生长周期,并为番茄逆境抵抗提供新的思路和方法。
4 结 论
miRNA是一类广泛存在于植物体内,位于基因组非编码区长约21~25个核苷酸的内源性非编码小分子RNA。番茄诸多生物学过程都受到miRNA的调控,包括植株形态、器官发育、生长发育以及响应干旱、盐、温度和生物胁迫等方面。miRNAs在番茄生长发育和胁迫应答等方面起重要作用,围绕miRNAs及其靶基因对番茄的调控机制,定向改变番茄果实品质及生长周期。

