响应面法优化鹰嘴豆异黄酮提取工艺分析
蒋变玲,许雪华,孟康,常冉,陈琼,韩方凯,段红
(宿州学院 生物与食品工程学院,安徽 宿州 234000)
鹰嘴豆(Cicer arietinum L),别名鸡豌豆、桃豆,是重要的食用豆类之一,它起源于中东,印度是其最大的生产国,在我国西北部广泛种植[1-3]。鹰嘴豆中含有丰富的营养物质,世界范围内需求量大[4]。
异黄酮是豆科植物家族特有的一类酚类次级代谢产物,包括鹰嘴豆、大豆、豌豆、蚕豆和扁豆等谷物食品和饲料植物[1]。鹰嘴豆异黄酮具有多种生物活性以及保健功能,其中包括降低心血管疾病和癌症的发病风险,抗氧化自由基、治疗高脂血症和糖尿病等[5]。但自然界中的异黄酮含量十分有限,而鹰嘴豆中异黄酮含量十分丰富(0.15~0.53 mg/g),是理想的提取原料[6-8]。
目前,异黄酮的提取方法大多采用溶剂萃取并加以微波、超声波等方法联合提取[9]。而酶法是一种新的提取方法,它通过纤维素酶分解样品细胞壁,从而使细胞壁破坏,降低传质阻力,使内容物更易流出[10]。此方法优点众多,酶的结合位点在适当功率的超声波的振荡、空化等作用下发生变化,一定程度上能提高纤维素酶的活性,利用超声波联合酶解,能缩短酶解时间[11]。利用超声联合酶法提取鹰嘴豆异黄酮,此前未见报导。因此本研究采用脂鹰嘴豆生豆粉为原料,利用超声联合纤维素酶法提取鹰嘴豆生豆粉中的异黄酮,在单因素试验基础上,选出3个显著因素通过响应面软件进行优化,得出最佳条件。旨在为从鹰嘴豆中高效提取异黄酮提供一定的参考。
1 材料与方法
1.1 仪器与设备
DHG-9145A型电热鼓风干燥箱,上海一恒科学仪器有限公司;HH-S型恒温超声锅,国胜实验仪器厂;FA1104B型分析天平,上海越平科学仪器有限公司;KQ5200DE型数控超声波清洗器,昆山超声仪器有限公司;SHZ-D型循环水式真空泵,巩义市予华仪器有限责任公司;UV-5100H型紫外可见分光光度计,上海元析仪器有限公司。
1.2 材料与试剂
鹰嘴豆生豆粉,新疆天山奇豆生物科技有限公司;鹰嘴豆芽素A标准品,上海如吉生物科技有限公司;纤维素酶(绿色木酶,5.0×104U/g),上海源叶生物。
1.3 实验方法
1.3.1 标准曲线的建立
参照温海超等[6]方法,将1.0mg鹰嘴豆芽素A标准品用少量70%乙醇完全溶解,定容至10 mL。再将其梯度稀释成0、0.000 2、0.000 5、0.001 0、0.001 5、0.002 0 mg/mL标准待测夜。在波长241、261、281 nm下测其吸光度值,以校正吸光度值ΔA为纵坐标,鹰嘴豆芽素A为横坐标绘制标准曲线,其中ΔA的计算公式如下

1.3.2 异黄酮提取量的测定
原料预处理:鹰嘴豆生豆粉于50℃干燥箱中烘干至恒重,过40目筛备用。
鹰嘴豆异黄酮含量测定:准确称取1.0 g鹰嘴豆生豆粉置于具塞锥形瓶中,以35%乙醇溶液为酶解液,加入不同量的纤维酶,在不同超声温度、超声时间和液料比条件下进行酶解,反应完成后向锥形瓶中加入一定量的无水乙醇至最终乙醇浓度为65%以终止酶解反应,放入超声波清洗机中提取20 min,抽滤后定容至100 mL,取1 mL稀释10倍,测其吸光度值,鹰嘴豆异黄酮提取量的公式为

式中:C为根据鹰嘴豆芽素A计算得到的异黄酮浓度(μg/mL),V为定容体积(mL),N为稀释倍数,M为鹰嘴豆生豆粉质量(g)。
1.3.3 单因素实验
1.3.3.1 酶添加量对鹰嘴豆异黄酮提取量的影响
控制其他实验条件一致,选取超声温度55℃,超声时间60 min,液料比30∶1,乙醇浓度35%,考察不同酶添加量(以U/g底物表示,200、250、300、350、400 U/g)对鹰嘴豆异黄酮提取量影响。
1.3.3.2 超声温度对鹰嘴豆异黄酮提取量的影响
控制其他实验条件一致,选取超声时间60 min,纤维素酶加入量为300 U/g,液料比30∶1,乙醇浓度35%,考察不同超声温度(45、50、55、60、65℃)对鹰嘴豆异黄酮提取量的影响。
1.3.3.3 超声时间对鹰嘴豆异黄酮提取量的影响
控制其他实验条件一致,选取超声温度55℃,纤维素酶加入量为300 U/g,液料比30∶1,乙醇浓度35%,考察不同超声时间(30、45、60、75、90 min)对鹰嘴豆异黄酮提取量影响。
1.3.3.4 酶解液液料比对鹰嘴豆异黄酮提取量的影响
其他实验条件一致,选取超声温度为55℃,超声时间为60 min,纤维素酶加入量为300 U/g,乙醇浓度35%,考察不同液料比(表示为酶解液/样品,10∶1、20∶1、30∶1、40∶1、50∶1)对鹰嘴豆异黄酮提取量影响。
1.3.3.5 乙醇浓度对鹰嘴豆异黄酮提取量的影响
其他实验条件一致,选取超声温度为55℃,超声时间为60 min,纤维素酶加入量为300 U/g,液料比为30∶1,考察不同乙醇浓度(25%、35%、45%、55%、65%)对鹰嘴豆异黄酮提取量的影响。
1.3.3.6 超声功率对鹰嘴豆异黄酮提取量的影响
其他实验条件一致,选取超声温度为55℃,超声时间为60 min,纤维素酶加入量为300 U/g,液料比为30∶1,乙醇浓度35%,考察不同功率(60、70、80、90、100 W)对鹰嘴豆异黄酮提取量的影响。
1.3.4 响应面实验设计
经SPSS软件进行单因素方差分析,选取对鹰嘴豆异黄酮提取量影响较大的3个因素进行优化。响应面实验设计见表1。

表1 响应面实验设计Tab.1 Response surface test design
1.3.5 数据处理
利用Design-Expert 8.0和SPSS对实验数据进行处理。
2 结果与分析
2.1 标准曲线绘制

图1 鹰嘴豆芽素A标准曲线Fig.1 Chickpea A standard curve
以标准品浓度和相应吸光度值为横、纵坐标,得到回归方程

2.2 单因素实验结果分析
2.2.1 纤维素酶使用量对鹰嘴豆异黄酮提取量影响
由图2可知,纤维素酶使用量在200~300 U/g范围内,鹰嘴豆中异黄酮的提取量逐渐增加,这是由于随着酶添加量增加,其对鹰嘴豆细胞壁的作用逐渐增强,细胞壁通透性增大,异黄酮类物质更易流出,鹰嘴豆异黄酮提取量增加[10];当纤维素酶添加量为300 U/g时,异黄酮提取量达到最大,为1.25 mg/g;继续增加纤维素酶的使用量,由于其会包裹住鹰嘴豆生豆粉颗粒,使鹰嘴豆异黄酮类物质难以溶出[12],鹰嘴豆异黄酮提取量下降。酶添加量不宜过多,故选取250、300、350 U/g进行优化。

图2 酶添加量对鹰嘴豆异黄酮提取量影响Fig.2 Effects of enzyme addition on the extraction of isoflavones
2.2.2 超声温度对鹰嘴豆异黄酮提取量影响
由图3可知,超声温度低于55℃时,随着温度升高,鹰嘴豆异黄酮的提取量逐渐增加;超声温度大于55℃时,鹰嘴豆异黄酮的提取量逐渐减小。这是由于随着温度的增加,纤维素酶活性逐渐增大,酶解反应加快,异黄酮类物质溶出量增多,温度继续升高,纤维素酶肽链结构改变,生理活性降低,酶逐渐变性失活[13],鹰嘴豆异黄酮的提取量下降。超声温度不宜过高,故选取50、55、60℃进行优化。
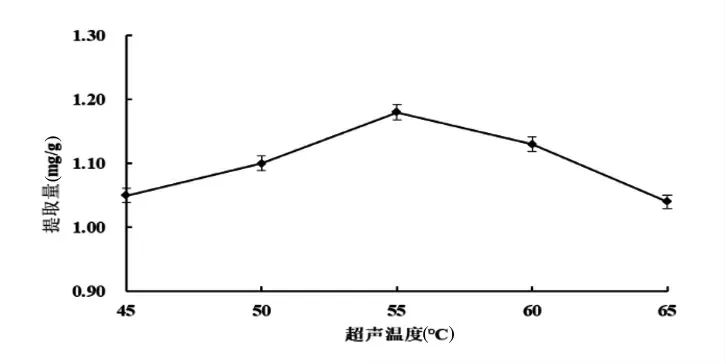
图3 超声温度对鹰嘴豆异黄酮提取量影响Fig.3 Effects of ultrasonic enzymatic hydrolysis temperature on the extraction of isoflavones
2.2.3 超声时间对鹰嘴豆异黄酮提取量影响
由图4可知,当超声时间小于60 min时,鹰嘴豆异黄酮的提取量增加;当超声时间大于60 min时,鹰嘴豆异黄酮的提取量逐渐减小。随着时间的增加,酶解反应趋于完全,且纤维素酶活性下降,粘液等杂质也会溶出[14],影响鹰嘴豆异黄酮提取量,使鹰嘴豆异黄酮提取量下降,故选取45、60、75 min优化。

图4 超声时间对鹰嘴豆异黄酮提取量影响Fig.4 Effects of ultrasonic enzymatic hydrolysis time on the extraction of isoflavones
2.2.4 酶解液液料比对鹰嘴豆异黄酮提取量影响
由图5可以看出,酶解液液料比在10∶1~30∶1之间,鹰嘴豆异黄酮的提取量增加;当酶解液液料比大于30∶1时,鹰嘴豆异黄酮提取量减少。这是由于液料比升高,增大了鹰嘴豆生豆粉与纤维素酶的接触面积,加快了酶促反应速率,鹰嘴豆异黄酮溶出量增加[15]。而当酶解液液料比大于30∶1时,随着溶剂的增加,可能使其他物质溶出,进而影响到鹰嘴豆异黄酮的提取量。

图5 液料比对鹰嘴豆异黄酮提取量影响Fig.5 Effects of ratio of material to liquid on the extraction of flavonoids
2.2.5 乙醇浓度对鹰嘴豆异黄酮提取量的影响
由图6可知,当酶解液的乙醇浓度在25%~35%之间时,鹰嘴豆异黄酮的提取量有稍微上升趋势;当乙醇浓度在35%~55%之间,鹰嘴豆异黄酮的提取量显著降低;当乙醇浓度在55%~65%范围,鹰嘴豆异黄酮的提取量趋于平缓,推测乙醇浓度的增加会影响酶的活性,当乙醇浓度在65%时,纤维素酶几乎完全失活。这与刘长娇等人[16]报道较为一致。

图6 乙醇浓度对鹰嘴豆异黄酮提取量影响Fig.6 Effectsof ethanol concentration on theextraction of flavonoids
2.2.5 超声功率对鹰嘴豆异黄酮提取量的影响
由图6可知,高大维等[17]报道超声功率对纤维素的活性有一定的影响。本文发现,随超声功率的增加,鹰嘴豆异黄酮的含量呈波动时下降,在超声功率为80 W时,异黄酮提取量最高为1.34 mg/g,而后显著下降。
2.3 响应面实验结果与分析
2.3.1 响应面实验结果分析
响应面实验设计及结果见表2。

表2 响应面实验设计及结果Tab.2 Response surface test design and results
根据Design-Expert 8.0软件对表2中的实验数据进行多元回归拟合,拟合得到方程为

2.3.2 方差分析
由表3可知,实验设计模型P<0.01,差异极具有统计学意义。鹰嘴豆异黄酮提取量与3个变量之间有良好的一致性。失拟项P=0.268 4>0.05,模型失拟,不具有统计学意义,表明能充分反映实际情况。决定系数R2=0.965 5,说明该模型优化的响应值真实可靠,本模型可以用于对鹰嘴豆异黄酮提取量进行分析和预测。通过表3实验结果可知,C、A2、B2对鹰嘴豆异黄酮提取量影响极具有统计学意义。由F值可知,超声时间对鹰嘴豆异黄酮提取量影响最大,酶添加量次之,超声温度影响最小。
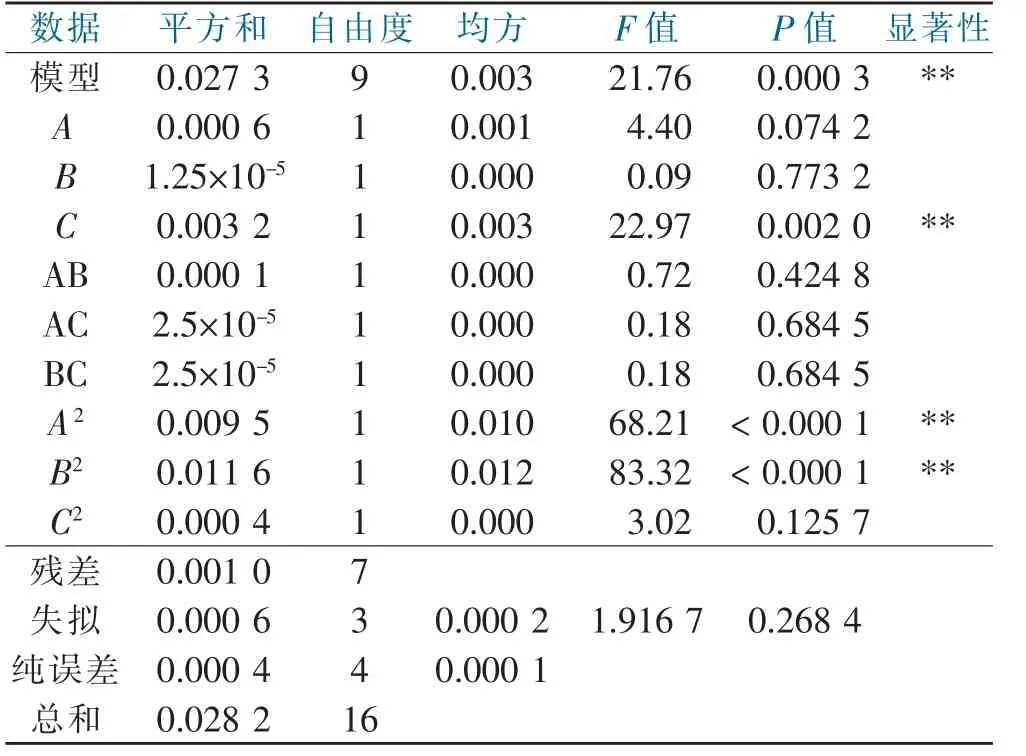
表3 方差分析Tab.3 Analysis of variance
2.3.3 响应面分析
根据响应面曲面图中曲线坡度的陡峭程度,判断各因素对提取量的影响大小[18]。由表3结合图6,图7和图8可知,AB、AC、BC之间交互作用均不显著。

图6 酶添加量与超声温度对鹰嘴豆异黄酮提取量影响曲面图Fig.6 Effect of enzyme addition amount and ultrasonic enzymatic hydrolysis temperature on the extraction of isoflavones

图7 超声功率对鹰嘴豆异黄酮提取量影响Fig.7 Effects of ultrasonic power on the extraction of flavonoids

图7 酶添加量与超声时间对鹰嘴豆异黄酮提取量影响曲面图Fig.7 Effect of enzyme addition amount and ultrasonic enzymatic hydrolysis time on the extraction of isoflavones
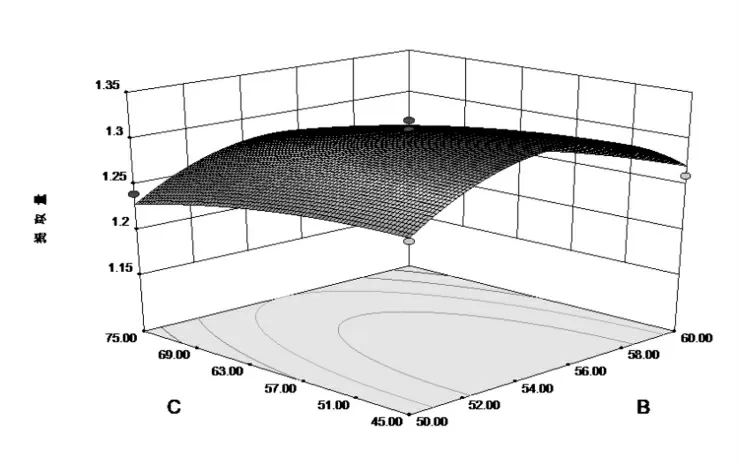
图8 超声温度酶解与时间对鹰嘴豆异黄酮提取量影响曲面图Fig.8 Ultrasonic enzymatic hydrolysis enzymatic hydrolysis and time on the isoflavone extraction amount
2.3.4 验证实验
利用Design-Expert 8.0软件进行分析,鹰嘴豆异黄酮提取量的最佳条件为:酶添加量6.122 mg/g、酶解液30 mL,55.21℃超声处理44.96 min,在此条件下鹰嘴豆异黄酮提取量为1.320 24 mg/g。为便于实际操作,修正实验条件为纤维素酶添加量6.1 mg/g、液液料比1∶30,55℃超声处理45 min。在此条件下重复3次,测得鹰嘴豆异黄酮提取量为1.320 24 mg/g,与预测值1.320 76 mg/g接近,证明所得实验结果可靠。本文所得异黄酮提取量高于温海超等[6](0.150 7 mg/g)、吴敏等[7](0.529 mg/g)以及程珍等[8](0.16 mg/g)所测得的鹰嘴豆中异黄酮含量,因此本实验的鹰嘴豆异黄酮提取率高于传统方法。
3 结论与讨论
异黄酮的提取方法较多,酶法主要采用纤维素酶使植物组织细胞受到破坏,进而降低细胞壁传质阻力,提高提取效率[6]。大量研究表明,超声联合酶法对鹰嘴豆异黄酮及黄酮的提取效率优于同等条件下超声波、纤维素酶单独提取效率,且高于传统提取方法[19-21]。
超声联合纤维素酶法提取鹰嘴豆异黄酮。结果表明,酶添加量306.03 U/g,液料比30∶1,55.21℃超声处理45 min为最佳条件,在这些条件下鹰嘴豆异黄酮的提取量为1.320 24 mg/g,接近预测理论值。与传统方法相比,该方法显著提高了鹰嘴豆异黄酮的提取量,且该提取工艺操作简便、安全环保,有很好的应用前景,为鹰嘴豆异黄酮的提取提供一定的参考。

