氮素添加对贝加尔针茅草原土壤团聚体微生物群落的影响
李 明,赵建宁,秦 洁,祁小旭,红 雨,杨殿林,*,洪 杰
1 农业农村部环境保护科研监测所, 天津 300191 2 内蒙古师范大学生命科学与技术学院, 呼和浩特 010022 3 内蒙古鄂温克族自治旗草原工作站, 呼伦贝尔 021100
大气氮沉降是全球性环境变化的重要现象之一,其导致的一系列生态问题已受到世界各国的普遍关注[1]。我国已成为继美国和北欧之后的世界第三大氮沉降地区,不断加剧的全球氮沉降对森林和草原生态系统的碳循环和其他生态过程产生了深刻的影响[2]。我国拥有各类天然草原近4×108hm2,约占国土总面积的40%,是最大的陆地生态系统之一。其中北方温带天然草原面积3.13×108hm2,占我国草地总面积的78%,是我国草地生态系统的主体,对区域生态系统维持、农牧业发展有着举足轻重的地位,不仅是畜牧业生产的重要基地,也是防止土地风蚀沙化、涵养水源的重要生态屏障[3- 4]。近年来,氮沉降的不断增加影响了草原生态系统的土壤养分和植被群落,在工业发达的欧洲和北美,高氮沉降已经严重威胁到草原生态系统的生物多样性和生态系统功能[5]。因此研究氮沉降对草原生态系统的影响具有重要的意义。
土壤微生物是土壤生态系统中的重要组成部分,是土壤有机质和土壤养分转化和循环的主要动力,与土壤有机质的分解、腐殖质的形成密切相关,是草地土壤质量变化的重要指标[6]。Chen等[7]分别对高寒草甸、温带草甸和温带草原三个典型草地生态系统进行养分添加试验,结果表明,在高寒草甸和温带草甸中氮素添加使得土壤酸化对真菌和丛枝菌根真菌的丰度产生了负效应,但对温带草原的影响并不显著。王丽娜等[8]对退化高寒草地的研究发现不同退化草地对氮素输入的响应存在差异,随着土地退化的加剧,土壤微生物量碳、氮对氮素添加响应的敏感性降低。王志瑞等[9]对内蒙古草甸草原研究表明氮素添加并未显著影响土壤微生物生物量,且对土壤呼吸和酶活性也无显著影响。Shi等[10]在温带草原微生物群落对氮素添加的响应研究中发现氮素添加显著提高了土壤微生物总PLFAs和细菌PLFAs,但对真菌PLFAs无显著影响。在不同的生态系统中,土壤微生物对氮素添加的响应不同,多数研究表明,氮素添加会降低微生物多样性[11- 12],也有部分研究认为施氮会提高微生物多样性[13]。有研究表明,氮素添加会改变土壤微生物群落结构,适量的氮素添加对微生物是有利的,但过高浓度的氮素添加并不利于微生物的生长,土壤pH值是驱动微生物群落改变的重要因子[14]。
土壤团聚体是土壤结构的基本单元,是形成良好土壤结构的物质基础,土壤团聚体根据粒径不同可分为大团聚体(>0.25mm)和微团聚体(<0.25 mm)。现阶段广泛认为>0.25 mm的大团聚体可在一定程度上反应土壤结构的优劣[15]。土壤团聚体是微生物活动的主要场所,它对土壤微生物的动态平衡有着直接的影响。由于土壤中团聚体的形状、大小、组成以及空间分布的差异,导致土壤团聚体中水分和空气的分布不均,不同大小的团聚体组分为微生物提供了空间上不均匀的栖息地,对土壤团聚体内微生物与环境间的物质交换与能量流动有着直接的影响,也进一步影响了微生物群落在团聚体中的分布[16- 17]。土壤团聚体作为微生物在微观尺度上的载体,土壤团聚体粒径分布在氮素添加条件下发生改变,从而导致微生物群落在不同粒径团聚体的重新分配。朱孟涛等[18]在研究生物质炭对水稻土壤团聚体微生物的影响中发现不同粒径土壤团聚体中微生物的群落结构存在显著差异,且施用生物质炭显著改变土壤微生物的群落结构和多样性。Briar等[19]研究表明大团聚体>1 mm土壤大团聚体比<0.25 mm微团聚体含有更多的微生物量、真菌和革兰氏阳性菌。土壤团聚体中的微生物在微环境物质和元素循环中起着重要作用,然而团聚体尺度上微生物群落结构对氮素添加的响应,以及不同团聚体微生物对氮素添加的响应是否一致,这类研究目前还相对匮乏。
为揭示氮沉降增加对我国北方温带草原生态系统土壤微生物群落的影响,以贝加尔针茅草原为研究对象,采用模拟氮沉降的方法进行氮素添加处理,研究不同氮素添加处理下贝加尔针茅草原土壤团聚体中微生物群落结构的变化,以期为氮沉降增加背景下如何保持贝加尔针茅(Stipabaicalensis)草原土壤质量以及微生物多样性提供理论依据。
1 材料与方法
1.1 研究区域概况及试验设计
试验样地位于内蒙古呼伦贝尔市鄂温克旗境内的贝加尔针茅草甸草原(48°27′—48°35′N、 119°35′—119°41′E),地势平坦,海拔高度约760 m,属半干旱大陆性季风气候。年降雨量330 mm,年平均气温为-2.4—2.2℃,年平均无霜期100—120 d,年均氮沉降量14.7 kg/hm2[20]。植被类型为贝加尔针茅草甸草原,贝加尔针茅为建群种,在群落中占据绝对优势,羊草(Leymuschinensis)为优势种,变蒿(Artemisiacommutata)、寸草苔(Carexduriuscula)、日荫菅(Carexpediformis)、扁蓿豆(Pocockiaruthenica)、祁洲漏芦(Rhaponticuuniflorum)、草地麻花头(Serratulayamatsutanna)、肾叶唐松草(Thaictrumpetaloideum)、多茎野豌豆(Viciamulticaulis) 等为常见伴生种,共有植物66种,分属21科49属。土壤类型为暗栗钙土。
试验氮素添加处理强度和频度参考国际上同类研究的处理方法[21- 23],以研究不同氮素添加处理对草原生态系统的影响。于2010年6月开始模拟氮沉降试验,采用裂区设计,共4个重复试验,每个重复试验设6个施氮水平,施氮量依次为: 0、15、30、50、100、150 kg hm-2a-1,(不包括大气沉降的氮量),分别用N0、N15、N30、N50、N100、N150表示。试验样地四周用围栏保护,重复间设5 m的隔离带,小区面积8 m×8 m,各小区之间间隔2 m。氮肥选NH4NO3,分两次施肥,每年的6月和7月中旬各施入处理的50%,氮肥溶解在8 L水中后均匀喷洒于各小区内,对照小区同时喷洒相同量的水[24]。
1.2 样品采集
于2018年8月上旬采集土壤样品,每个小区依“S”形采集10个点的原状土样轻微混合,采样深度为的0—15 cm。土壤取出后剥除土块外围挤压变形的土壤,并去除植物根系及其他土壤入侵物,较大的土块沿着自然断裂面掰成直径约为1 cm的小块。采集的土壤样品装入硬质塑料盒内,确保在运输过程中不受挤压,带回实验室后储存在4℃冰箱中,待用。同时取土测定基本理化性质,结果如表1所示。
1.3 测定方法
分离土壤团聚体有湿筛法和干筛法两种常用方法,但湿筛法在用水浸泡过程中,容易对土壤微生物群落造成破坏,而干筛法相对减少了对微生物群落的影响,且据有关研究,在旱地土壤中,干筛法分离出的团聚体更接近田间实际[25]。故本研究采用干筛法分离土壤团聚体,将剔除石砾、植物残根等杂物的新鲜土壤样品在4℃下风干至含水量为8%左右,混合均匀后过8mm的标准筛备用。团聚体分级以0.25 mm为界,>0.25 mm的土壤团聚体称为大团聚体,<0.25 mm的团聚体称为微团聚体,为了更深入的研究氮素添加对不同粒径土壤团聚体的影响,以2 mm和0.25 mm标准筛将土壤分为3个粒径的土壤团聚体[26]。每次称取100g在4℃风干的土样放置在套筛的最上层,垂直振动10 min,每分钟振动60次,分离出>2 mm、0.25—2 mm和<0.25 mm的3个粒径的土壤团聚体,将各级团聚体分为两部分,一部分风干用于测量土壤理化性质;另一部分土样置于-70℃超低温保存,用于微生物磷脂脂肪酸(phospholipid fatty acid, PLFA)测定。
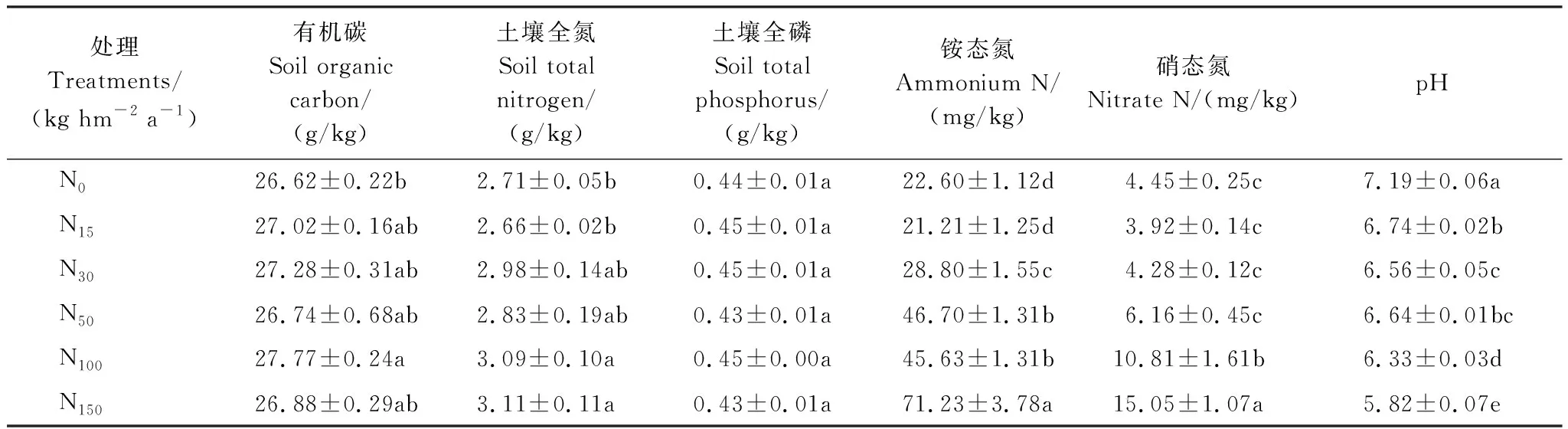
表1 氮素添加条件下土壤基本理化性质(平均值±标准误)
土壤有机碳采用水合热重铬酸钾氧化-比色法;全氮采用凯氏法,即硒粉-硫酸铜-硫酸钾-硫酸消煮法,之后采用流动分析仪(AA3,Bran+Luebbe Crop,德国)测定;全磷采用高氯酸-硫酸消煮-钼锑抗比色-紫外分光光度法;土壤硝态氮、铵态氮采用氯化钙浸提法,之后采用流动分析仪测定;土壤pH采用玻璃电极法(MP511 pH计)按土水比1∶2.5测定[27]。
土壤PLFA测定:采用Bligh-Dyer[28]法进行土壤团聚体微生物脂类的提取和磷脂脂肪酸分析,将-70℃保存的新鲜土壤进行冻干处理,称取3g冻干土样,加入氯仿-甲醇-柠檬酸单相提取剂震荡离心提取总脂,用氮气吹干后,加氯仿经活化柱分离得到磷脂脂肪酸,磷脂通过甲醇甲苯混合液甲酯化为磷脂脂肪酸甲酯,用氮气吹干后加入内标。采用HP6890气相色谱-HP5973质谱联用仪(GC-MS)进行分析,脂肪酸的命名采用Frostegard[29]方法命名,定量方法采用峰面积和内标曲线法,以十九烷酸甲酯作为内标,根据不同脂肪酸的分子结构划分为不同的微生物类群。PLFA含量用nmol/g表示,PLFA的生物表征如表2所示[27]。根据不同微生物类群磷脂脂肪酸的分子结构和基因位置,将其分为真菌(Fungi, F)、细菌(Bacteria, B)、革兰氏阳性细菌(gram-positive bacterial,G+)和革兰氏阴性细菌(gram-negative bacterial,G-)。土壤微生物PLFA总量以检测到的特征脂肪酸加和表示。
土壤团聚体微生物群落特征用所测得PLFA数据计算多样性指数:辛普森多样性指数(Simpson diversity index,Ds)、香农-维纳多样性指数(Shannon-wiener diversity index,H)、丰富度指数(Margalef index,D)来表示[27],如下所示:
Simpson多样性指数:
Ds=1-∑Pi2
Shannon-wiener多样性指数:H=-∑PilnPi
Margalef丰富度指数:D=(S-1)/lnN
式中,Pi为第i种PLFA占微生物总PLFAs的比例,S为一个样品中检测出的PLFA种数,N为样品中总PLFA的含量。
1.4 数据统计与分析
利用Excel 2013和SPSS 20.0软件对试验数据进行统计分析,采用单因素方差分析(One-way ANOVA)和最小显著差异法(least significant difference, LSD)对不同氮添加处理间均值的方差分析和差异性进行比较(P=0.05)。图表制作采用Origin 2018软件处理。

表2 表征微生物的磷脂脂肪酸)标志物
2 结果与分析
2.1 氮素添加对土壤理化性质的影响
氮素添加显著影响了土壤的理化性质(表1),随着氮素添加量的增加有机碳、全氮、硝态氮和铵态氮呈升高趋势,土壤有机碳在N100处理时显著升高(P<0.05),土壤全氮在N100和N150处理均显著高于对照(P<0.05),N150处理铵态氮和硝态氮极显著高于N0处理(P<0.01);土壤全磷在各氮素添加处理中差异不显著(P>0.05)。土壤pH随氮素添加量的增加极显著降低(P<0.01)。
2.2 氮素添加对土壤团聚体中微生物群落结构的影响。
氮素添加显著影响了土壤团聚体中微生物PLFAs的含量(图1)。随着氮素添加量的增加,各粒径土壤团聚体中总PLFAs、真菌PLFAs、细菌PLFAs和真菌/细菌比值均呈升高趋势。各氮素添加处理中N50和N100对土壤团聚体微生物PLFAs的影响与对照相比最为显著,N100处理显著提高了>2 mm土壤团聚体总PLFAs、真菌PLFAs和细菌PLFAs的含量(P<0.05),提高了0.25—2 mm土壤团聚体总PLFAs和真菌PLFAs含量(P<0.05);<0.25 mm土壤团聚体总PLFAs、真菌PLFAs和细菌PLFAs含量在N50处理时最高,且显著高于对照处理(P<0.05)。N150处理与N100处理相比,显著降低了>2 mm和0.25—2 mm的土壤团聚体总PLFAs、真菌PLFAs含量(P<0.05),但与对照处理相比并未减少。0.25—2 mm土壤团聚体G+/G-比在N100处理下显著高于对照,真菌/细菌在N50处理显著高于对照(P<0.05),>2 mm和<0.25 mm土壤团聚体G+/G-和真菌/细菌与对照无显著差异(P>0.05)。N150处理0.25—2 mm土壤团聚体真菌/细菌较N50处理显著降低(P<0.05),但与对照无显著差异。
同一氮素添加处理下不同粒径土壤团聚体中微生物PLFAs的含量也存在显著差异,微生物总PLFAs和真菌PLFAs含量在同一处理下均表现为0.25—2 mm土壤团聚体最高,<0.25 mm土壤团聚体最低,细菌PLFAs含量在各粒径中差异不显著。N50- 100处理<0.25 mm土壤团聚体总PLFAs含量显著低于0.25—2 mm土壤团聚体(P<0.05);N100处理<0.25 mm土壤团聚体真菌PLFAs和细菌PLFAs含量显著低于0.25—2 mm土壤团聚体(P<0.05)。同一氮素添加处理下,0.25—2 mm土壤团聚体G+/G-在N30- 100处理显著高于>2 mm和<0.25 mm土壤团聚体,真菌/细菌比在不同粒径团聚体间无显著差异。
氮素添加显著降低了3个粒径土壤团聚体微生物的Margalef丰富度指数(P<0.05),而对Simpson多样性指数、Shannon-wiener多样性指数无显著差异(表3)。同一氮素添加处理,除N15处理对不同粒径土壤团聚体的Simpson多样性指数、Shannon-wiener多样性指数有显著影响外,其他处理影响均不显著。N15- 100处理<0.25 mm土壤团聚体Margalef丰富度指数显著高于同处理下0.25—2 mm土壤团聚体。
2.3 土壤团聚体微生物群落与土壤化学因子的相关性分析。
对土壤团聚体微生物群落与化学因子之间进行相关性分析可知(表4),土壤团聚体化学因子与微生物群落结构有显著的相关性。土壤团聚体有机碳、全氮和全磷与F、G+/G-和F/B均呈极显著的正相关关系(P<0.01),总PLFAs与有机碳和全氮显著相关(P<0.05),而与全磷无相关关系。有机碳与丰富度指数呈显著负相关关系;全磷与Simpson多样性指数、Shannon-wiener多样性指数极显著正相关(P<0.01)。土壤团聚体C/N与总PLFAs 和G+/G-呈显著负相关关系,与丰富度指数呈显著正相关关系(P<0.05);土壤pH与丰富度指数呈显著正相关关系(P<0.05)。土壤团聚体有机碳、全氮、C/N、C/P和N/P与Simpson多样性指数、Shannon-wiener多样性指数均无显著相关关系。
3 讨论
土壤微生物是土壤中营养周转的主要参与者,而碳、氮是影响土壤微生物群落结构和功能的2种重要因素,氮素的添加能够影响微生物群落的变化,进而影响微生物群落功能和土壤营养过程[30]。土壤团聚体是微生物的重要栖息场所,也是土壤的重要结构单元,其形成和稳定性都与微生物有着密切的联系[25]。研究土壤团聚体微生物群落结构与理化因子的相关性是揭示氮素添加对土壤生态系统影响机制的重要途径。本文通过研究氮素添加对贝加尔针茅草原土壤团聚体的影响,结果表明,氮素添加显著影响了土壤团聚体有机碳和全氮的含量以及微生物群落结构。
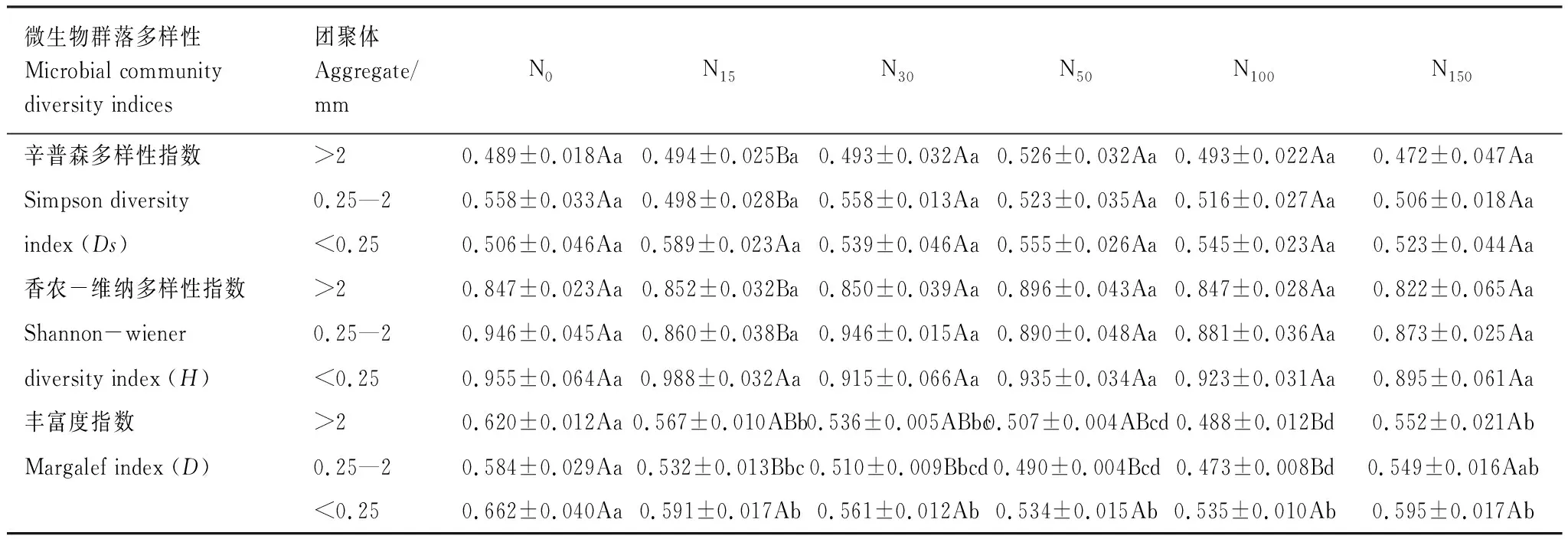
表3 氮素添加处理对土壤团聚体微生物群落多样性的影响 (平均值±标准误)
同行不同小写字母表示团聚体处理之间差异显著(P<0.05),同列不同大写字母表示团聚体粒径之间差异显著(P<0.05)
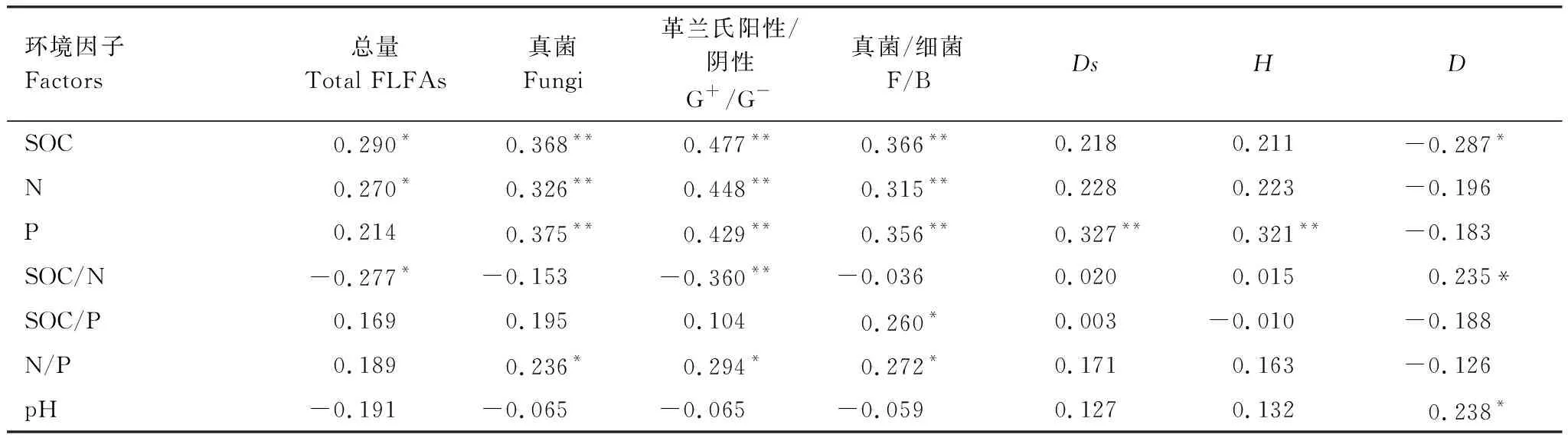
表4 土壤团聚体微生物群落与环境因子的相关性分析
3.1 氮素添加对土壤理化性质的影响
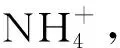
3.2 氮素添加对土壤团聚体微生物群落结构特征的影响
土壤微生物是陆地生态系统的重要组成部分,在土壤有机质的分解、腐殖质的形成及土壤养分的转化和循环等生物化学过程中发挥着重要作用,是土壤乃至整个生态系统物质循环的重要维持者、贡献者和土壤环境灵敏的指示者[39]。氮素添加对土壤微生物具有双重影响效果,一方面氮素的添加增加了土壤无机态氮含量,有利于微生物的生长[14];另一方面,氮素的添加会导致土壤酸化和养分不均衡等土壤环境引起的微生物数量及活性的降低[40]。结果表明,通过连续8年的氮素添加试验,土壤团聚体微生物总PLFAs和真菌PLFAs含量随着氮素添加量的增加呈升高趋势,这与赵学超等[41]对内蒙古多伦草原的氮素添加试验研究结果一致。说明氮素添加对土壤团聚体微生物总PLFAs和真菌PLFAs有显著的促进效应,且以中度水平的氮素添加量对土壤团聚体微生物量的促进效果最为明显。基于前期的研究结果表明,可能是由于草原生态系统氮素养分匮乏,氮素的添加促进了草地植物的生长和凋落物的积累从而增加了有机碳的含量[42]。而土壤有机碳是影响土壤真菌群落的重要因子,有机碳是腐生性真菌的能源物质,有机碳的增加促进了真菌的生长[24,43]。前期的研究中发现0.25—2 mm土壤团聚体有机碳含量显著高于其他两个粒径[44],这同样也解释了0.25—2 mm土壤团聚体总PLFAs和真菌PLFAs含量高于其他粒径的原因。N150相比N100处理土壤团聚体微生物总PLFAs、真菌PLFAs和细菌PLFAs含量显著下降的原因可能是高浓度的氮素添加导致土壤pH下降,不利于微生物的生长[14]。
土壤革兰氏阳性菌/革兰氏阴性菌的比值可用于指示土壤的营养状况,该比值越高表示营养胁迫越强[45]。当环境中某一营养元素的浓度大于或小于临界水平时即会形成营养胁迫。>2 mm和0.25—2 mm土壤团聚体G+/G-随着氮素添加量的增加逐渐升高,表示随着氮素添加量的增加,大团聚体中营养胁迫程度越来越高;而在同一氮素添加处理下,0.25—2 mm土壤团聚体G+/G-高于其他粒径,说明0.25—2 mm土壤团聚体相比于其他粒径土壤团聚体营养胁迫程度更高。Penuelas等[46]认为随着氮素的持续输出,土壤中磷的限制性会逐渐增强。外源氮素增加是导致陆地生态系统磷素限制的一个重要的贡献因子[47]。而在资源受限的土壤中革兰氏阳性菌生长会更占优势[48],故G+/G-的升高可能是由于土壤中磷限制增强的原因。
土壤中有机质的分解途径可分为真菌途径和细菌途径,在不同的土壤生态系统中,由于有机物的来源不同,导致这两条途径所发挥的作用也不同。以真菌分解途径为主的土壤氮和能量的转化较缓慢,有利于氮和有机质的积累;而细菌分解途径为主的土壤,有机质和氮的矿化速率快,有利于养分的供应。因此土壤中真菌/细菌比可以反映整个土壤生态系统结构和功能对不同土壤条件的响应[49]。研究发现,N50处理促进了0.25—2 mm土壤团聚体真菌/细菌;N150处理相较于N50处理0.25—2 mm土壤团聚体真菌/细菌降低,但与对照无显著影响。这与张爱林等[24]的研究结果相一致。原因可能是氮素的添加对真菌群落的影响更大,由于偏酸性土壤更适合真菌的生长,一定程度的氮素添加导致土壤pH下降,为真菌的生长提供了适宜的环境,而过高的氮添加同样也不利于真菌的生长[24]。
微生物群落多样性是表征土壤质量变化的敏感指标,与土壤中的物质和能量转换、土壤肥力有着密切的联系,对土壤管理具有重要的指示意义[50]。氮素添加降低了3个粒径土壤团聚体微生物群落的Margalef丰富度指数,且0.25—2 mm土壤团聚体微生物群落的Margalef丰富度指数显著低于<0.25 mm土壤团聚体。这可能是由于氮素添加导致土壤pH的改变引起的,土壤pH是反应土壤盐碱化程度的主要指标,可以通过影响微生物代谢的酶活性以及细胞膜的稳定性,从而改变微生物对土壤环境中营养物质的吸收,是影响微生物生命活动的重要因素[51]。已有研究表明,土壤微生物群落丰富度指数和多样性指数与土壤pH呈显著正相关关系,随着pH的降低而降低,土壤微生物对土壤pH有一定的耐受范围,过低的土壤pH会抑制微生物的生长和活动,因而本研究中pH可能是导致土壤微生物群落多样性降低的原因之一[52]。
3.3 土壤团聚体微生物群落与化学因子的相关性分析
土壤理化性质与土壤微生物群落结构有着重要的联系,土壤理化性质的改变会影响土壤微生物群落的结构组成[27]。本研究结果表明,土壤团聚体微生物总PLFAs、F、G+/G-和F/B与有机碳、全氮和全磷呈正相关关系,而与C/N值负相关,这与谷晓楠等[53]对长白山高山草甸带土壤微生物的研究结果一致。土壤微生物作为草原生态系统的分解者,对土壤养分的循环具有极其重要的作用。土壤微生物参与土壤碳、氮等元素的循环过程和土壤矿物的矿化过程,与土壤有机碳有着密切的关系,同时对土壤团聚体的形成及其稳定性起着重要的作用[54]。相关研究表明,土壤有机碳与真菌/细菌比有关,可能是影响土壤有机碳稳定性的主要原因,但内在机制非常复杂[55]。土壤微生物对有机碳的利用和转化主要有真菌和细菌分别主导的两条途径,而真菌对有机碳的储存能力比细菌更强,所以土壤有机碳含量与真菌和细菌的相对组成密切相关[56]。Degens等[57]发现,菌丝对土壤团聚体有显著影响,有利于团聚体的形成,大团聚体的形成有赖于菌根菌丝体和其他根际微生物产生的有机质。土壤微生物自身的代谢产物难以被分解,从而增加了土壤碳的稳定程度,微生物产生的粘多糖和菌丝促进土壤团聚体的形成,从而物理性的阻碍了有机碳的分解;而且微生物分泌的胞外多聚糖可以促进矿物结合态有机碳的形成,使土壤固定的活性有机碳更多的向稳定性碳转变,增强碳的稳定性[58]。土壤C/N通常被认为是土壤氮素矿化能力的标志,C/N降低时,充足的氮素使得微生物可矿化基质增多,反而促进了微生物量的增加,这可能是土壤团聚体C/N与微生物群落总PLFAs和真菌PLFAs含量呈负相关的原因[59- 60]。
4 结论
贝加尔针茅草原连续8年氮素添加模拟氮沉降增加控制试验,研究了氮素添加对草原土壤团聚体微生物群落结构的影响。研究结果表明,氮素添加提高了土壤有机碳、全氮、硝态氮和铵态氮含量,同时导致pH降低。氮素添加显著提高了土壤团聚体微生物总PLFAs和真菌PLFAs,其中以0.25—2 mm土壤团聚体最为显著;且在同一处理下0.25—2 mm土壤团聚体微生物总PLFAs、真菌PLFAs、G+/G-和F/B显著高于其他粒径。氮素添加对土壤团聚体微生物的促进效果呈非线性增长趋势,高浓度的氮添加对微生物PLFAs含量的促进效果反而会减弱。氮素添加显著降低了土壤团聚体微生物的Margalef丰富度指数,对土壤微生物群落Simpson多样性指数和Shannon-wiener多样性指数无显著影响。土壤团聚体微生物总PLFAs、真菌PLFAs含量、G+/G-、F/B与土壤有机碳、全氮和全磷含量呈显著正相关关系,与C/N负相关。综上所述,适宜的氮素添加可以促进微生物的生长,但过高浓度氮素输入的促进作用反而会减弱;不同粒径土壤团聚体微生物群落存在差异,0.25—2 mm土壤团聚体可能更适合微生物的生存。

