基于高通量测序技术对浙江传统发酵蔬菜微生物多样性的解析
鲍 伟,韩姣姣,张旨轩,芦晨阳,周 君,明庭红,李 晔,苏秀榕,*
(1.宁波大学 农产品质量安全危害因子与风险防控国家重点实验室,浙江 宁波 315211;2.宁波大学海洋学院,浙江 宁波 315832;3.宁波大学食品与药学学院,浙江 宁波 315832)
自古以来,中国就有谷物、蔬菜、牛奶、肉类、茶叶和豆类在内的一系列原料的发酵产品,如白酒、陈醋、酸菜和酱油,除此之外,还有一些地方发酵产品,如浙东地区的宁波三臭(臭冬瓜、臭苋菜梗和臭菜心)、广东南雄的酸笋和长沙臭豆腐等。微生物发酵不仅延长食品的保质期,还在口感、风味和营养方面赋予了食品其他特性。发酵食品中有古生菌、细菌、真菌等多种微生物,其检测方法还基于体外培养,在这种状态下许多微生物通过培养基无法被检测到[1]。
高通量测序技术能同时检测可培养和不可培养微生物,可广泛应用于微生物群落的组成和变化分析[2-3],其快速发展同时也促进了基因组学技术在传统发酵食品微生物研究中的应用[4]。魏本良等[5]利用Illumina HiSeq测序平台对西北地区特色发酵食品浆水中细菌16S rRNA基因V3-V4区进行测序,发现其优势发酵菌为发酵乳杆菌(Lactobacillus fermentum,33.39%)、乙醇片球菌(Pediococcus ethanolica,21.13%)和L. parafarraginis(13.28%);宁亚丽等[6]利用高通量测序技术解析出朝鲜族传统米酒中的优势细菌属为Lactobacillus和肠杆菌属(Enterobacter),优势真菌为酿酒酵母和伯顿丝孢毕赤酵母(Pichia burtoni);自然发酵豆腐乳清的优势菌为Lactobacillus、Enterobacter、芽孢杆菌属(Bacillus)、醋酸杆菌属(Acetobacter)和Picha等[7];郫县豆瓣在发酵过程中的优势菌群为葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)、Pediococcus、Lactobacillus、棒状杆菌属(Corynebacterium)和Bacillus[8]。此外,袁晓阳等[9]采用人工培养的方式对宁波臭冬瓜主要发酵菌种进行了研究,分离出自然发酵腌制冬瓜中的6 株主要发酵菌种:短小芽孢杆菌(B. pumilus)、极小棒状杆菌(C. parvum)、腐败希瓦菌(Shewanella putrefaction)、汉逊酵母(Hansenula)、酿酒酵母(Saccharomyces cerevisiae)和植物乳杆菌(L.plantarum);孙丽等[10]利用5.8S rDNA-ITS克隆文库法分析了腌制冬瓜中酵母菌的多样性,发现腌制早期优势酵母菌为普鲁兰类酵母(Aureobasidium pullulans),腌制中、后期,酵母菌群中优势菌种转变为热带假丝酵母(Candida tropicalis);万力婷等[11]采用16S rDNA基因克隆文库的方法研究了苋菜梗在腌制过程中细菌多样性的变化,结果表示,苋菜梗腌制第0天优势菌群为Lactobacillus、Pediococcus和Weissella,第10天优势菌群为Lactobacillus和产碱杆菌属(Alcaligenes),到腌制中后期Alcaligenes、拟杆菌属(Bacteroides)和梭菌属(Clostridium)为优势菌群,且细菌群落组成趋于稳定。以上研究均是对发酵产品混合物中微生物多样性的研究,而对于发酵产品的汁液、固形物以及培养物中的微生物组成及多样性研究还鲜有报道。
本实验以卤水、臭冬瓜、臭苋菜梗、酸笋和酸茭白为研究对象,利用16S rDNA和ITS测序技术,分别对汁液、固形物及其培养物的细菌和真菌进行测序,剖析这些发酵食品的微生物多样性,确定结构比例并找出优势菌群,以期为进一步研究传统发酵食品中微生物或功能性成分提供理论支持。
1 材料与方法
1.1 材料与试剂
卤水、臭冬瓜、臭苋菜梗、酸笋、酸茭白 宁波三臭居公司。
厌氧培养基 青岛海博生物技术有限公司;E.Z.N.A.®Soil试剂盒 上海玉博生物科技有限公司;AMPure XT beads试剂盒 美国贝克曼公司。
1.2 仪器与设备
TL-08X普通型无菌均质器 江苏天翎仪器有限公司;NanoDrop 2000分光光度计 赛默飞世尔科技有限公司。
1.3 方法
1.3.1 样品处理
分别取卤水、臭冬瓜、臭苋菜梗、酸笋和酸茭白的汁液和培养物,以及后4 种食品的固形物;固形物是指将食品表面用无菌水冲洗干净,然后从内部取样;培养物是指将样品厌氧培养24 h后的产物,其中卤水取汁液培养,其余4 种按照固液比1∶1用均质器打碎混匀后培养。上述样品采集后经无菌密封好后放入-80 ℃超低温冰箱保存备用。
1.3.2 高通量测序
1.3.2.1 DNA提取
根据E.Z.N.A.®Soil试剂盒说明书进行样品总DNA的提取;用NanoDrop 2000分光光度计和1%琼脂糖凝胶电泳检测总DNA浓度和纯度。
1.3.2.2 PCR扩增及测序
细菌采用16S rDNA基因可变区(V3-V4)区域通用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’);真菌采用ITS2可变区引物fITS7(5’-GTGARTCATCGAATCTTTG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)分别进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,2%琼脂糖凝胶电泳检测,AMPure XT beads试剂盒对目标片段进行回收纯化、构建文库,利用Illumina MiSeq测序平台进行测序。
1.4 数据分析
利用FLASH软件根据PE reads之间的overlap关系将成对的reads拼接成一条序列[12],并去除barcode序列,通过PRINSEQ软件去除短于50 bp的片段和reads尾部质量值在20以下的碱基,只保留长度大于400 bp(细菌)或者300 bp(真菌)的序列,然后过滤低复杂度序列,去除非扩增区域[13]。最后利用Mothur[14]软件中的pre.cluster算法进行测序错误校正,同时利用chimeras.uchime算法去除序列中的嵌合体。
利用Uclust软件对可操作分类单元(operational taxonomic unit,OTU)进行聚类分析(属的序列相似性阈值为0.97,种的序列相似性阈值为0.99),并选择OTU数目变化与Uclust参数之间最佳相似性值[15]。对于细菌序列通过Mothur对α多样性包括Chao1指数、Observed指数以及Shannon指数进行分析[16],同时基于Unifrac metric计算方法对其β多样性指数进行分析[17]。最后采用RDP classifier软件对处理后的序列进行物种分类、群落变化的分析[18]。对于真菌序列则从每个OTU中选择代表性序列,与NCBI的GenBank进行BLAST比对,确定真菌序列的分类信息。最后利用Excel 2016、GraphPad Prism8软件绘制样品各分类水平下的群落结构图等。
2 结果与分析
2.1 α多样性分析
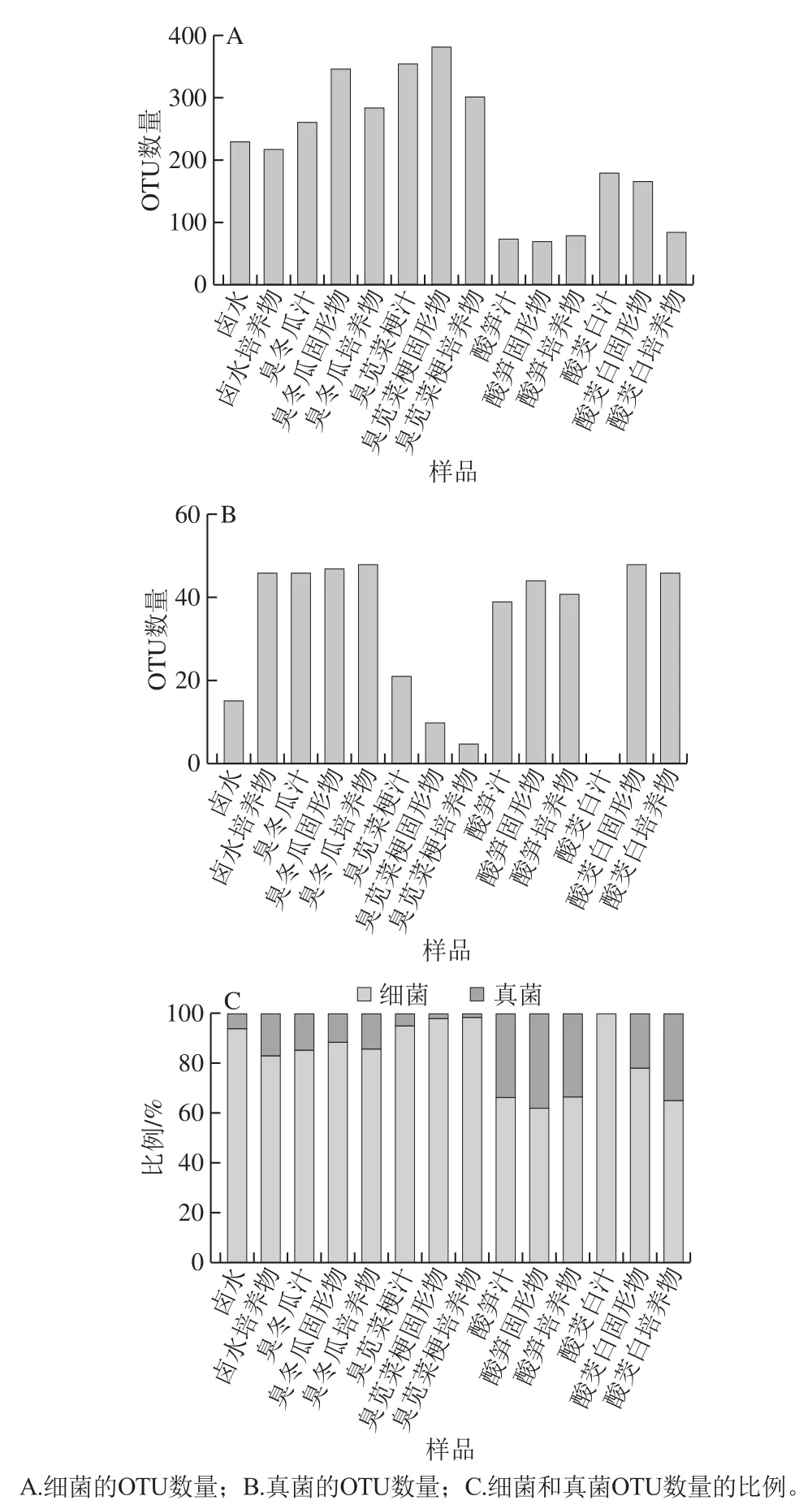
图 1 样品中细菌和真菌的OTU数量分析Fig. 1 Numbers of bacterial and fungal OTUs and ratio between them in samples
测序后对14 个样品的原始序列进行筛选,除去不合格的序列后,基于97%相似性得到的细菌和真菌OTU数量如图1A、B所示。臭苋菜梗固形物中鉴定出的细菌OTU最多,为384 个,酸笋固形物中的细菌OTU最少,为72 个(图1A);而臭冬瓜培养物和酸茭白固形物中鉴定出的真菌OTU最多(48 个),臭苋菜梗培养物中的真菌OTU最少(5 个),而酸茭白汁中未检测出真菌存在(图1B)。14 个样品微生物中的细菌比例均高于真菌。其中,卤水、臭苋菜梗汁、固形物、培养物和酸茭白汁中的细菌占93%以上,其余样品的细菌占比在62.39%~88.07%之间(图1C)。
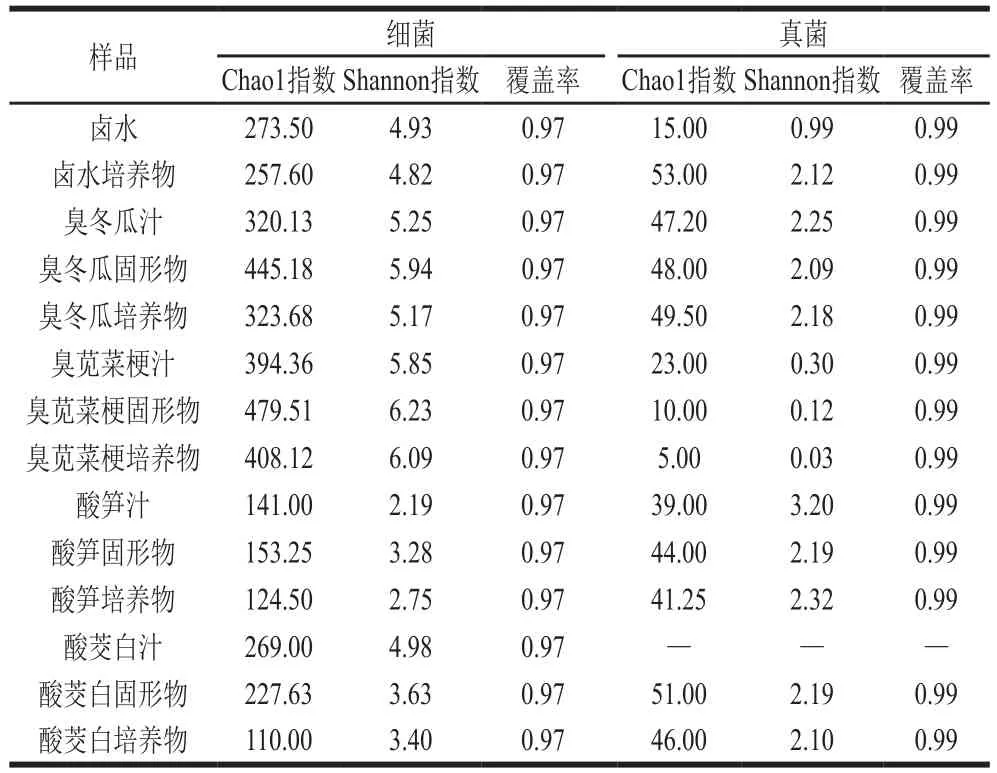
表 1 样品中细菌和真菌的α多样性Table 1 Alpha diversities of bacteria and fungi in samples
如表1所示,在14 个样品中,细菌的Chao1指数在110.00~479.51之间,Shannon指数在2.19~6.23之间,覆盖率为0.97;真菌的Chao1指数在5.00~53.00之间,Shannon指数在0~3.20之间,覆盖率为0.99。通过计算样品的多样性指数发现,臭苋菜梗固形物的细菌Chao1指数(479.51)和Shannon指数(6.23)最高,说明它的物种丰度最高,菌群结构更复杂;相反地,酸茭白培养物中的细菌丰度最低(Chao1指数为110.00),酸笋汁中的菌群结构最简单(Shannon指数为2.19)。卤水培养物中的真菌丰度最高(Chao1指数为53.00),酸笋汁中的菌群结构最复杂(Shannon指数为3.20),而臭苋菜梗培养物中的真菌丰度和多样性均最低(Chao1指数为5.00,Shannon指数为0.03)。其余样品的丰度指数和多样性指数表现出不同的差异,说明这些样品中细菌和真菌种类和数量分布上也有所不同。
2.2 菌群结构分析
利用UPGMA(Unweighted Pair Group Method with Arithmetic Mean)方法对样品进行聚类,14 个样品共聚为两大支,酸笋3 个样品的细菌属聚为一类,差异较小,其余11 个样品的细菌属另聚为一类;而卤水与臭苋菜梗3 个样品的真菌属聚为一类,差异较小,其余样品的真菌属另聚为一类(图2)。

图 2 样品UPGMA层次聚类分析Fig. 2 UPGMA hierarchical cluster analysis of bacterial and fungal communities in samples
2.3 样品间微生物组成分析
2.3.1 细菌群落组成
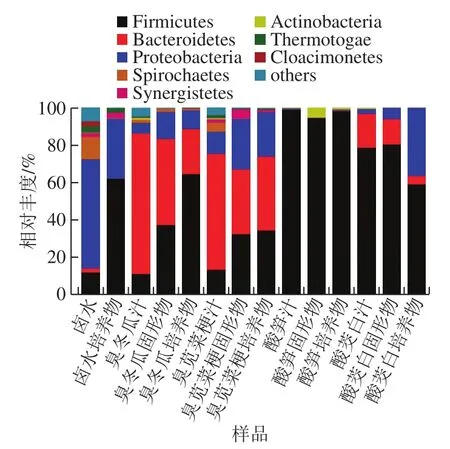
图 3 各样品在门分类水平的细菌组成Fig. 3 Composition of bacterial community at phylum level in different samples
如图3所示,卤水中主要细菌的优势菌门为变形菌门(Proteobacteria,58.21%)、厚壁菌门(Firmicutes,12.06%)、螺旋体门(Spirochaetes,12.05%)和热孢菌门(Thermotogae,3.45%);而卤水经厌氧培养后,Firmicutes的相对丰度增加到62.06%,Proteobacteria、Spirochaetes和Thermotogae的相对丰度分别降低到31.86%、0.26%和2.44%。臭冬瓜汁中的优势菌门为拟杆菌门(Bacteroidetes,75.00%)、Firmicutes(11.12%)和Proteobacteria(5.61%);臭冬瓜固形物中的优势菌门与汁液中相同,但相对丰度发生变化,为Bacteroidetes(45.93%)、Firmicutes(37.31%)和Proteobacteria(14.42%);而臭冬瓜培养物中的主要优势菌门为Firmicutes(64.44%)、Bacteroidetes(24.06%)和Proteobacteria(9.93%)。臭苋菜梗汁中的优势菌为Bacteroidetes(61.8%)、Firmicutes(13.47%)和Proteobacteria(11.75%);其固形物中的优势菌门为Bacteroidetes(34.51%)、Firmicutes(32.52%)、Proteobacteria(26.96%)和互养菌门(Synergistetes,5.05%);臭苋菜梗培养物中的优势菌门相对丰度与固形物相比无明显变化,除Synergistetes的相对丰度降低到1.18%。酸笋汁和培养物中均只有Firmicutes一种优势菌,相对丰度为98.85%和98.28%;酸笋固形物的优势菌门为Firmicutes和放线菌门(Actinobacteria),相对丰度为94.43%和5.34%。酸茭白汁、固形物和培养物中的优势菌门均为Firmicutes(78.70%、80.39%和59.10%)、Bacteroidetes(18.02%、78.70%和2.56%)和Proteobacteria(2.56%、6.07%和36.52%)。
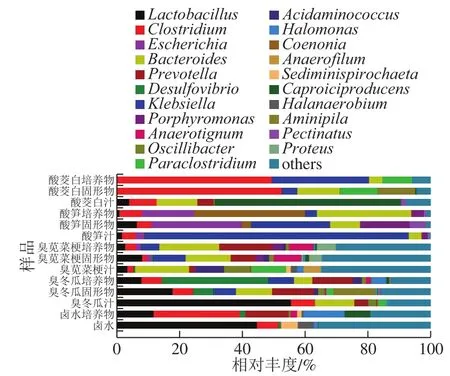
图 4 各样品在属分类水平的细菌组成Fig. 4 Composition of bacterial community at genus level in different samples
14 个样品共鉴定出256 个属(图4)。其中,卤水中125 个,卤水培养物中108 个,臭冬瓜汁中74 个,臭冬瓜固形物中93 个,臭冬瓜培养物中77 个,臭苋菜梗汁中140 个,臭苋菜梗固形物中139 个,臭苋菜梗培养物中102 个,酸笋汁中34 个,酸笋固形物中33 个,酸笋培养物中39 个,酸茭白汁102 个,酸茭白固形物中94 个,酸茭白培养物中58 个。其中,卤水中的优势菌属为Lactobacillus(44.69%)和Clostridium(6.77%);卤水培养物中为Clostridium(27.4%)、普雷沃氏菌属(Prevotella,13.81%)、嗜盐单胞菌属(Halomonas,13.09%)、Lactobacillus(11.83%)和Caproiciproducens(8.18%);臭冬瓜汁中为Lactobacillus(55.55%)、Bacteroides(12.46%)、Clostridium(7.52%)和Prevotella(4.35%);臭冬瓜固形物中为Lactobacillus(17.88%)、Aminipila(13.50%)、Prevotella(13.28%)、Bacteroides(11.45%)和克雷伯氏菌属(Klebsiella,7.15%);臭冬瓜培养物中为脱硫弧菌属(Desulfovibrio,33.90%)、Prevotella(12.91%)、Klebsiella(8.09%)、Lactobacillus(8.00%)和Bacteroides(5.85%);臭苋菜梗汁中为Bacteroides(17.22%)、Paraclostridium(11.19%)、氨基酸球菌属(Acidaminococcus,9.06%)、颤杆菌克属(Oscillbacter,8.35%)和厌氧菌属(Anaerofilum,5.58%);臭苋菜梗固形物中为Bacteroides(14.28%)、Klebsiella(10.41%)、Anaerotignum(8.85%)、Lactobacillus(8.17%)和Prevotella(7.83%);臭苋菜梗培养物中为Bacteroides(19.10%)、Prevotella(16.64%)、Anaerotignum(7.73%)和变形菌属(Proteus,5.98%);酸笋汁中为Klebsiella(83.87%);酸笋固形物中为埃希菌属(Escherichia,28.67%)、Klebsiella(24.97%)、紫单胞菌属(Porphyromonas,15.67%)、Bacteroides(9.66%)、Lactobacillus(6.58%)和Pectinatus(5.34%);酸笋培养物中为Coenonia(35.49%)、Bacteroides(30.04%)、Escherichia(16.59%)和Clostridium(7.11%);酸茭白汁中为Caproiciproducens(59.13%)、Bacteroides(12.96%)、Clostridium(8.75%)和Prevotella(5.07%);酸茭白固形物中为Clostridium(52.56%)、Bacteroides(13.52%)、Aminipila(12.10%)和Paraclostridium(11.82%);酸茭白培养物中为Clostridium(49.36%)、Klebsiella(30.82%)和Paraclostridium(9.36%)。
2.3.2 真菌群落组成分析

图 5 各样品在门分类水平的真菌组成Fig. 5 Composition of fungal community at phylum level in different samples
除酸茭白汁中未检测出真菌外,其余所有样品的优势菌门只有2 种,分别是子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。其中卤水、臭苋菜梗汁、臭苋菜梗固形物和臭苋菜梗培养物中Ascomycota相对丰度为98%以上,而其余9 个样品中Ascomycota相对丰度为62.09%~67.84%,Basidiomycota相对丰度为30.57%~36.70%(图5)。
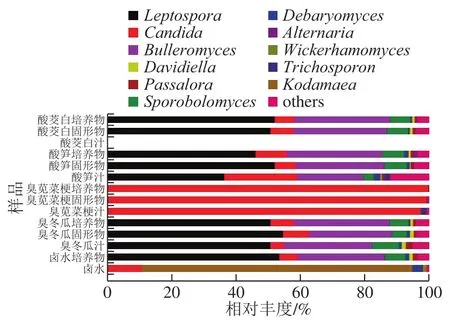
图 6 各样品在属分类水平的真菌组成Fig. 6 Composition of fungal community at genus level in different samples
14 个样品中共鉴定出47 个属(图6),分别为卤水中10 个,卤水培养物中31 个,臭冬瓜的汁、固形物和培养物中各28 个,臭苋菜梗汁中12 个,臭苋菜梗固形物中8 个,臭苋菜梗培养物中5 个,酸笋汁中27 个,酸笋固形物中25 个,酸笋培养物中26 个,酸茭白固形物中29 个,酸茭白培养物中27 个。其中,卤水培养物、臭冬瓜汁、臭冬瓜固形物、臭冬瓜培养物、酸笋汁、酸笋固形物、酸笋培养物、酸茭白固形物和酸茭白培养物中优势菌属相同,均为布勒担孢酵母属(Bulleromyces)、假丝酵母属(Candida)、Leptospora和掷孢酵母属(Sporobolomyces),且在卤水培养物中相对丰度分别为Bulleromyces(27.07%)、Candida(5.62%)、Leptospora(53.38%)和Sporobolomyces(6.57%);臭冬瓜汁中为Bulleromyces(27.38%)、Candida(4.22%)、Leptospora(50.57%)和Sporobolomyces(8.34%);臭冬瓜固形物中为Bulleromyces(25.58%)、Candida(8.18%)、Leptospora(54.48%)和Sporobolomyces(4.80%);臭冬瓜培养物中为Bulleromyces(29.68%)、Candida(7.21%)、Leptospora(50.68%)和Sporobolomyces(6.05%);酸笋汁中为Bulleromyces(20.49%)、Candida(22.63%)、Leptospora(36.29%)和Sporobolomyces(3.31%);酸笋固形物中为Bulleromyces(27.47%)、Candida(6.49%)、Leptospora(51.94%)和Sporobolomyces(7.10%);酸笋培养物中为Bulleromyces(29.59%)、Candida(9.68%)、Leptospora(45.99%)和Sporobolomyces(6.97%);酸茭白固形物中为Bulleromyces(29.27%)、Candida(6.94%)、Leptospora(50.59%)和Sporobolomyces(6.62%);酸茭白培养物中为Bulleromyces属(29.79%)、Candida(6.08%)、Leptospora(51.91%)和Sporobolomyces(6.36%);而Candida在臭苋菜梗的汁、固形物和培养物中的比例均占97%以上;除此之外,柯达酵母属(Kodamaea,84.17%)和Candida(10.49%)是卤水中的优势菌属。
3 讨 论
根据14 个样品UPGMA层次聚类结果(图2),发现酸笋的汁、固形物和培养物细菌结构相似,并且与其他样品细菌结构具有差异性,而同属酸味食品的酸茭白与臭味食品的细菌结构有相似之处,这可能是原材料不同导致后期在发酵过程中菌群结构发生变化;另一方面,样品中真菌的层次聚类分析结果显示,卤水、苋菜梗的汁、固形物和培养物的真菌结构相似,而与其余样品真菌结构具有差异性,这可能是因为卤水来源于臭苋菜梗汁,而在贮藏过程中其真菌结构变化不大所致。
从14 个样品中均检测出Lactobacillus,但其相对丰度有所差异,在“臭”味食品中丰度较高而在“酸”味食品中丰度较低。乳酸的形成离不开Lactobacillus的作用[19]。另外,Lactobacillus对有机酸具有一定的耐受能力[20],能降低酵母菌的好氧代谢速度,从而延长前发酵期,有利于有益菌的生长[21-22]。对于蔬菜而言,发酵蔬菜品质的形成与乳酸菌在发酵过程中的生长代谢作用有重要的关系,如增进营养价值、改善食品风味、抑制杂菌生长等[23],因此,乳酸菌也被作为一种发酵剂投入到一些发酵蔬菜的生产中,如腌冬瓜[24]、泡菜[25]、酸菜[26]等。
臭冬瓜、臭苋菜梗属于“臭”味发酵食品,用卤水作为发酵剂。贺静等[27]利用454高通量测序技术分析了湖南地区卤水主要是厌氧球菌属(Anaerococcus)、卟啉单胞菌属(Porphyromonas)、放线杆菌属(Actinobacteria)、肉杆菌属(Sarcobacterium)、消化链球菌属(Peptostreptococcus)、四体球菌属(Tetrasporium)、Acidaminococcus、Bacteroides、依格纳季氏菌属(Ignatella)、Lactobacillus和Halomonas等;赵国忠等[28]鉴定出安徽地区卤水为漫游球菌(Roamcoccus)、嗜冷杆菌属(Psychobacterium)、沙克乳杆菌(L. saccharomyces)、地衣芽孢杆菌(B. licheniformis)和鸟肠球菌(Enterococcus avium);而本研究中的浙江地区卤水中检测出的优势菌为Lactobacillus、Clostridium、盐厌氧菌属(Haloanaerobic)和Sediminispirochaeta,此外Porphyromonas、Bacteroides、Lactobacillus和Halomonas也被检测出,但相对丰度较低,由此说明不同地区的卤水菌群多样性存在差异,这可能是由于原材料和发酵环境所致。卤水经培养后,Clostridium、Prevotella、Halomonas和Caproiciproducens相对丰度增加,而Lactobacillus相对丰度降低。冬瓜中含有较多的碳水化合物和蛋白质,而苋菜梗中更多的是纤维素,卤水在冬瓜和苋菜梗中发酵,由于提供卤水发酵的培养基不同,微生物多样性也发生了改变。赵永威等[29]采用16S rDNA测序对冬瓜腌制过程中的微生物多样性解析,得到其在腌制后期的优势菌为Weissella、Bacillus和Staphylococcus。在本研究中,门水平下,臭冬瓜汁和臭苋菜梗汁中的Bacteroidetes相对丰度分别是卤水中的37 倍和31 倍,而Proteobacteria相对丰度分别是卤水中的1/10和1/5;在属水平下,与卤水相比,臭冬瓜汁中的Bacteroides和Lactobacillus相对丰度分别增加了12.38%和10.86%,而卤水中的Sediminispirochaeta和Haloanaerobic在臭冬瓜汁中未被检测出;臭苋菜梗汁中的Lactobacillus降低了41.22%,Bacteroides和Aminococcus分别增加了17.14%和9.06%,而Acidaminococcus在卤水和臭冬瓜汁中均未被检测出。除此之外,臭冬瓜汁和臭苋菜梗汁中还产生了新的菌属:Paraclostridium(2.86%、11.19%)、颤杆菌属(Oscillacus,2.68%、8.35%)、Anaerofilum(0.01%、5.58%)和Anaerotignum(0.27%、0.22%)。而臭冬瓜固形物和培养物中的Lactobacillus的相对丰度比臭冬瓜汁分别降低了37.67%和47.55%,臭冬瓜固形物中含有较多的Aminipila(13.50%)和Prevotella(13.28%),臭冬瓜培养物中含有大量的Desulfovibrio(33.90%);臭苋菜梗固形物和培养物与汁液相比,Klebsiella、Prevotella和Anaerotignum相对丰度增加,Acidaminococcus、Oscillacus、Anaerofilum和Paraclostridium相对丰度降低。卤水中的真菌数量远小于细菌。卤水中的真菌主要是酵母菌,酵母菌在发酵前期与细菌共生,主要起到分解的作用,随着后期蔬菜浸卤、盐浓度的上升以及密封导致的氧气减少,细菌逐渐占优势地位,而真菌数量慢慢减少,这在臭豆腐卤液的研究中也被证实[22]。在本研究中,卤水的优势真菌为奥默柯达酵母(Kodamaea ohmeri,84.17%)和C. tropicalis(8.90%)。陶森等[30]从腌鱼中分离出的K. ohmeri耐盐能力达到12%,刘建利等[31]在民间面引子中也检测出了C. tropicalis。然而,卤水在冬瓜和苋菜梗发酵后,其优势真菌发生改变。臭冬瓜汁中的优势真菌为Leptospora rubella、白布勒弹孢酵母(Bullera pseudoalba)和赤色掷孢酵母(Sporobolomyces ruberrimus),而臭苋菜梗中为C. tropicalis(96.84%)。此外,臭冬瓜和臭苋菜梗的固形物和培养物与汁液的真菌组成相似。
酸笋和酸茭白属于“酸”味食品,是竹笋和茭白浸没在符合饮用要求的水中自然发酵而形成的发酵食品[32]。虽然是相同的发酵方式,但由于原材料不同,在发酵过程中产生的微生物有所差异。在门水平,酸笋3 种样品中的优势菌门只有Firmicutes,而酸茭白3 种样品中优势菌门除Firmicutes还有Bacteroidetes和Proteobacteria,尤其在酸茭白培养物中,Proteobacteria的相对丰度达到36.52%;在属水平,酸笋和酸茭白的汁液、固形物及培养物的细菌结构均不同,酸笋汁中的优势菌属为Klebsiella,而酸茭白汁中的优势菌属为Caproiciproducens、Bacteroides和Clostridium,其中Caproiciproducens是一种产己酸菌[33];酸笋固形物中的优势菌属为Klebsiella、Escherichia和单胞菌属,而酸茭白固形物中的优势菌属为Clostridium、Paraclostridium、Bacteroides和Aminipila;酸笋培养物中的优势菌属为Bacteroides、Escherichia和Coenonia,而酸茭白培养物中的优势菌属为Clostridium、Pectinatus和Klebsiella。“酸”味食品的真菌组成很相似,但酸笋汁中的Candida的丰度相对于其他样品较高。
4 结 论
本实验对4 种江浙传统发酵食品的14 个样品的微生物多样性进行研究,发现Lactobacillus和Candida在所有样品中都存在,说明在“臭”和“酸”两类发酵食品中,Lactobacillus占据主要作用;其次,发酵食品的汁、固形物和培养物中的菌群结构和多样性也存在部分差异,这可能归因于菌群的生长环境不同。通过本研究对江浙传统发酵食品不同部位及培养物的微生物菌群组成与多样性有了一定了解,也为其他发酵食品微生物多样性探究进一步提供参考。

