谷物植物化学物中α-葡萄糖苷酶抑制剂的筛选及其分子机制
石嘉怿,张 冉,梁富强,,程玉鑫,张 太
(1.南京财经大学食品科学与工程学院,江苏 南京 210023;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
谷物尤其是全谷物及其制品因含有多种植物化学物,包括多酚类物质、膳食纤维、维生素、矿物质等,具有多种健康效应,已经成为健康膳食的重要组成部分。国际糖尿病联盟的最新数据显示,目前我国的糖尿病患者人数高达1.164亿,居世界首位,预计到2045年可达1.472亿[1],其中90%~95%为II型糖尿病患者,糖尿病已经成为了严重威胁人们健康的慢性疾病之一。α-葡萄糖苷酶是调控餐后血糖的关键酶之一。阿卡波糖、米格列醇、伏格列波糖是目前常用的α-葡萄糖苷酶抑制剂,然而它们的使用对机体胃肠道具有严重的副作用[2]。因此,从全谷物植物化学物中筛选发现无毒副作用的天然α-葡萄糖苷酶抑制剂是控制餐后血糖、预防糖尿病的一个重要途径。
大量研究表明,增加全谷物食物的摄入能够降低包括II型糖尿病在内的多种人类慢性疾病的发生风险[3]。研究认为这与其富含黄酮类、酚酸、烷基间苯二酚、生物碱、植物淄醇等多种植物化学物密切相关[4]。近年来,越来越多的研究显示富含谷物植物化学物的提取物或化合物单体表现出α-葡萄糖苷酶抑制活性[5-6],说明谷物是日常膳食中天然安全抑制剂的重要来源。并且与其他来源不同,谷物中植物化学物多以结合态存在,经膳食能够在肠道中酵解后大量释放[7]。Parizad等的研究认为有色谷物提取物抑制小鼠肠道α-葡萄糖苷酶的活性可能是由于提取物中酚类物质的协同效应[8]。因此,可以推断膳食中的谷物植物化学物更利于α-葡萄糖苷酶的抑制从而更好地使其发挥抑制活性。作为控制餐后血糖关键靶点之一,α-葡萄糖苷酶是一种主要存在于人小肠绒毛黏膜细胞刷状缘的酶类。然而,目前大多数研究均是以酵母源α-葡萄糖苷酶为靶点。因此,以人源α-葡萄糖苷酶为靶点,从谷物植物化学物中筛选天然α-葡萄糖苷酶抑制剂,对控制餐后血糖水平从而预防II型糖尿病具有重要意义。
本实验构建了谷物植物化学物小分子数据库,以人源α-葡萄糖苷酶(PDB ID:5NN8)[9]为靶点,采用分子对接的方法并结合ADME和Lipinski性质从中筛选潜在的人源α-葡萄糖苷酶抑制剂;通过体外酶活力比较目标化合物的抑制活性,并采用分子动力学模拟结合独立梯度模型(independent gradient model,IGM)分析,探究导致其活性差异的分子机制,以期为全谷物食物中天然、高效、无毒副作用人源α-葡萄糖苷酶抑制剂的筛选和发现提供依据。
1 材料与方法
1.1 材料与试剂
牡荆素和异牡荆素(纯度>95%)上海源叶生物科技有限公司;酵母菌(S. cerevisiae)来源的α-葡萄糖苷酶(EC 3.2.1.20)(活力≥100 U/mg)美国Sigma公司;对硝基苯基-α-D-葡萄糖吡喃苷(p-nitrophenyl-α-D-glucopyranoside,pNPG)(纯度98%)、芹菜素(纯度≥98%)上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
PHS-25 pH计上海精密科学仪器有限公司;SpectraMax M2e多功能酶标仪美国Molecular Devices公司;SHA-C水浴振荡器常州国华电器有限公司。
1.3 方法
1.3.1 谷物植物化学物数据库的建立
通过检索PubMed和Web of Science中的相关文献以及Phenol-Explorer数据库(http://phenol-explorer.eu/),最终确定265 种主要来源于谷物的植物化学物。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载或利用Chemdraw软件绘制植物化学物的2D结构,保存为.sdf格式。
1.3.2 受体和配体的准备
将所有的小分子化合物导入MOE软件转换为3D结构,利用软件的Energy minimize模块进行能量最小化(能量收敛标准为0.004 kJ/mol),导入到.mdb数据库中,构建用于筛选的配体数据库。
从蛋白质数据库(RCSB protein data bank,RCSB PDB)(https://www.rcsb.org/)下载目的蛋白人源α-葡萄糖苷酶-阿卡波糖复合物的3D晶体结构(PDB ID:5NN8,2.45 Å)。在MOE分子对接软件中对α-葡萄糖苷酶依次进行删除水分子、质子化、加氢及能量最小化等处理。
1.3.3 基于ADME和Lipinski性质的筛选
将小分子化合物化学结构转换为SMILES格式,通过SwissADME(http://www.swissadme.ch/)在线预测平台获得化合物的ADME和Lipinski性质。将P-糖蛋白(P-glycoprotein,P-gp)和细胞色素P450(cytochrome P450,CYP450)底物均设置为No,Lipinski性质为Yes(0和1),以此为标准进行第一轮筛选。
1.3.4 基于分子对接的筛选
MOE软件用于分子对接筛选。为检验分子对接方法的可靠性和准确性,首先将蛋白配体复合物(PDB ID:5NN8)中原有的配体分子阿卡波糖从晶体结构中提取出来,然后重新对接到α-葡萄糖苷酶受体中,对比重新对接前后配体构象的差异,以均方根偏差(root mean square deviation,RMSD)小于2 Å为标准。对接参数设置:Placement method:triangle matcher;Scoring function:London dG;Refinement:induced fit;Refinement score:GBVI/WSA dG。
1.3.5α-葡萄糖苷酶抑制活性测定
采用pNPG法测定酵母源α-葡萄糖苷酶抑制活性[10],略有改动。牡荆素、异牡荆素和芹菜素3 种黄酮类化合物母液(溶于二甲亚砜)用0.2 mmol/L磷酸盐缓冲液(phosphate buffered saline,PBS)稀释至不同浓度,96 孔板上测定抑制活性。设置样品组(25 μL样品溶液+25 μL 0.5 U/mLα-葡萄糖苷酶)、对照组(25 μL PBS+25 μL 0.5 U/mLα-葡萄糖苷酶)、背景组(25 μL样品溶液+25 μL PBS)、空白组(50 μL PBS)。37 ℃下孵育15 min后,每孔加入50 μL pNPG底物(0.5 mmol/L),继续孵育。15 min后每孔加入100 μL 0.5 mol/L的Na2CO3终止反应,使用多功能酶标仪在405 nm波长处测定吸光度。按照下式计算抑制率,并计算半数抑制浓度(median inhibition concentration,IC50)。

1.3.6 同源模建和分子对接
同源模建获得酵母源α-葡萄糖苷酶的3D结构。从UniprotKB数据库(https://www.uniprot.org/uniprot/P 5 3 3 4 1)下载酵母源α-葡萄糖苷酶的氨基酸序列(P53341),上传至Swiss Model(https://swissmodel.expasy.org/)预测平台,以3AXH为模板同源建模获得α-葡萄糖苷酶的3D结构。以获得的α-葡萄糖苷酶3D结构为受体,分子对接过程的具体参数设置同1.3.4节,分析芹菜素、牡荆素和异牡荆素与酵母源α-葡萄糖苷酶的相互作用模式。
1.3.7 分子动力学模拟
选择1.3.6节中分子对接的复合物构象,采用Gromacs 2019.5软件包进行分子动力学模拟。使用PRODRG2 Server(http://prodrg1.dyndns.org/submit.html)构建配体(牡荆素、异牡荆素和芹菜素)的拓扑结构文件,利用pdb2gmx模块构建α-葡萄糖苷酶-配体复合物的结构文件,采用Gromacs53a6力场,使用SPC水模型。动力学模拟的盒子设置为十二面体,加入钠离子维持体系的电中性。首先采用最陡梯度法对模拟体系进行能量最小化,其次分别进行100 ps的热浴和压浴系综模拟,使体系达到平衡状态(310 K、1 bar)。稳定后进行20 ns的位置非限制性分子动力学模拟,时间步长设置为2 fs,分析结果。
1.3.8 独立梯度模型分析
Multiwfn程序中的IGM分析是研究受体和配体间弱相互作用、使其可视化的一种新的方法[11]。因此,根据1.3.7节中分子动力学模拟结果,提取配体-受体复合物的稳定构象,采用Multiwfn 3.7软件包分析牡荆素、异牡荆素和芹菜素与α-葡萄糖苷酶之间的弱相互作用,利用VMD 1.9.3软件进行可视化分析。
1.4 数据处理与分析
采用SPSS Statistics软件进行数据统计和单因素方差分析,P<0.05表示显著差异,采用Origin 2018软件绘图。
2 结果与分析
2.1 基于ADME和Lipinski性质的筛选结果
膳食植物化学物的吸收、分布、代谢、排泄(absorption, distribution, metabolism, excretion,ADME)性质是影响其发挥生物活性的重要因素。肠道细胞中高表达的CYP450生物转化作用和P-gp的主动外排作用是决定膳食植物化学物ADME性质的重要因素[12]。因此,首先以SwissADME软件中CYP450及P-gp作为界定参数提高筛选的可靠性。此外,具有潜力的植物化学物应该具备良好的类药性[13]。因此,选择Lipinski 5 项原则作为谷物植物化学物数据库进一步筛选的标准。据此,从265 种中筛选出了6 类、76 种非CYP450和P-gp底物,具有较好的肠道吸收特性且具有良好Lipinski性质(图1白色区域)的植物化学物,包括20 种黄酮类、35 种酚酸类、5 种燕麦蒽酰胺类、8 种苯并噁唑嗪酮类、6 种植物甾醇、2 种其他化合物。

图 1 基于ADME和Lipinski性质的筛选Fig. 1 Screening of α-glucosidase inhibitors based on ADME and Lipinski properties
2.2 基于分子对接的筛选结果
对接结果显示对接后的配体分子与原配体分子的RMSD为0.51 Å,小于2 Å,且能够较好地重现晶体结构中原配体和受体的结合构象(图2A),表明参数设置合理,可以用于构建数据库中植物化学物的进一步筛选。
对接结果中的打分值S负值越大,提示配体和受体结合的能力越强,这些化合物可能具有更强的抑制潜力[14]。第一轮筛选出的6 类植物化学物对接打分的平均值见图2B,打分较好的分别是植物甾醇和黄酮类化合物两类。由图2C可知,分析阿卡波糖与人源α-葡萄糖苷酶的相互作用模式可知,氨基酸残基Asp282、Asp616、Asp518、Asp404、Arg600、His674、Met519、Phe649、Trp613、Leu405、Trp516、Trp376、Leu650、Trp481、IIe441、Trp618在两者的结合中具有重要作用[15]。因此,根据分子对接打分的S值,并分析相互作用模式,从76 种植物化学物中筛选出了10 种具有潜力的人源α-葡萄糖苷酶抑制剂(谷物植物化学物),它们均能以合理的构象进入到活性口袋中(图2D),并与关键氨基酸残基相互作用(表1)。史永恒等研究了何首乌中2,3,5,4’-四羟基二苯乙烯-2-β-D-葡萄糖苷的降血糖的靶点[16],结果表明其与5NN8表现出良好的结合能力,并具有体外的抑制作用,是潜在的降血糖先导化合物。Jiang Mingzhu等的研究表明,两种大豆三肽与5NN8具有良好的结合能力,富含这两种肽的酶解物在小鼠体内表现出显著的降血糖效果[17]。因此,上述谷物植物化学物在机体中的抑制活性和降血糖效应值得深入研究。
2.3 牡荆素、异牡荆素和芹菜素的酵母源α-葡萄糖苷酶抑制活性和作用机制
分子对接显示牡荆素和异牡荆素作为两种碳苷黄酮类的同分异构体,均能与人源α-葡萄糖苷酶中的关键氨基酸位点结合,具有较好的结合能力。由于目前体外酶活性抑制主要采用的是酵母源α-葡萄糖苷酶,因此,研究也采用pNPG法考察上述两种化合物的体外酶抑制活性,结果如图3A、B所示。牡荆素和异牡荆素均具有一定的体外抑制活性,呈现剂量效应,IC50分别为117 μmol/L和164 μmol/L,与前人的研究结果[18-19]相近,表明抑制能力为牡荆素>异牡荆素,与分子对接打分一致。作为芹菜素苷元的两种碳苷类衍生物,Choi等的研究发现糖基取代增强了对II型糖尿病靶点PTP1B的抑制活性[20],提示碳苷黄酮类物质更具预防糖尿病的潜力。因此,进一步评价芹菜素的α-葡萄糖苷酶抑制能力,结果见图3C,IC50为16 μmol/L,与前人的研究结果[21]接近。上述结果表明三者抑制酵母源α-葡萄糖苷酶的能力为芹菜素>牡荆素>异牡荆素。然而,2.2节中芹菜素的分子对接打分为-5.202 7,提示芹菜素的抑制能力可能小于牡荆素和异牡荆素,因此,牡荆素、异牡荆素和芹菜素活性差异的分子机制值得进一步研究。
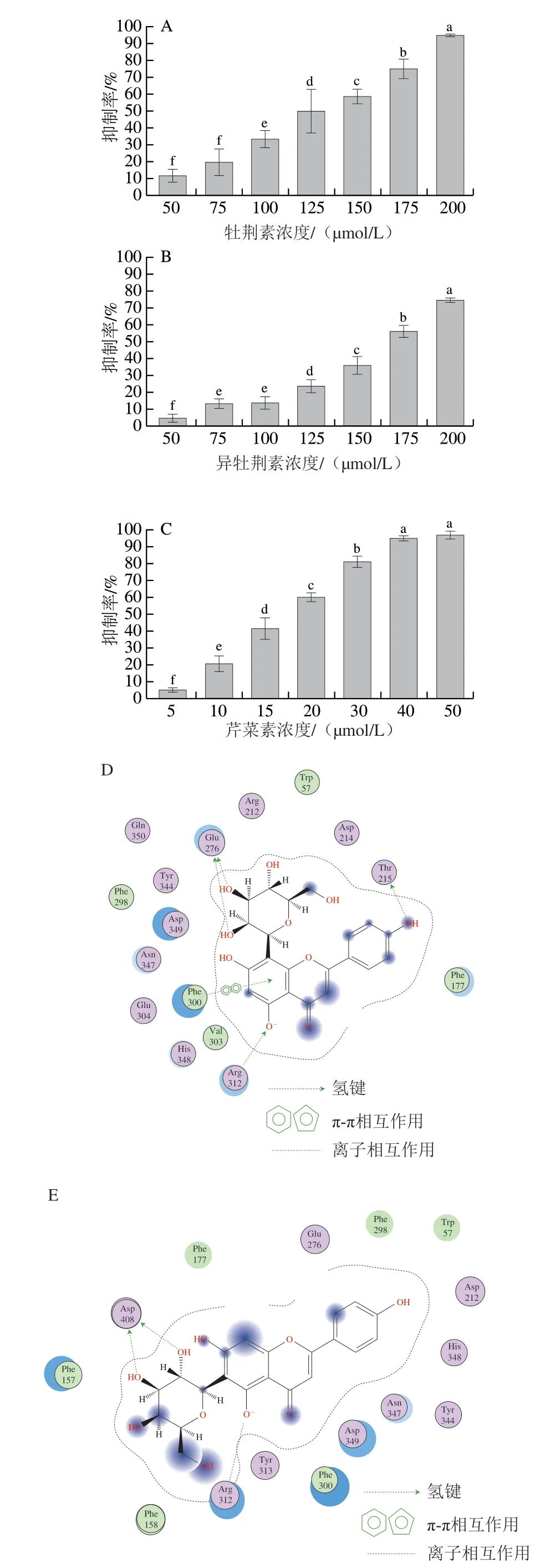

图 3 牡荆素、异牡荆素和芹菜素α-葡萄糖苷酶的抑制活性和相互作用分析Fig. 3 Inhibitory activity and interaction mechanism of vitexin,isovitexin and apigenin against α-glucosidase
体外酶活性抑制实验采用的是酵母源α-葡萄糖苷酶,然而目前其三维结构尚未解析,因此采用同源模建的方法建立了其三维结构。研究表明,Asp214、Asp349、Glu276、Asp408、Arg312和Thr215等是酵母源α-葡萄糖苷酶催化底物pNPG的关键氨基酸残基[22]。图3D~F显示3 种黄酮类化合物均能与这些关键活性位点结合,然而,其分子对接打分S值反映的抑制潜力从强到弱为芹菜素>牡荆素>异牡荆素,不能很好地解释3 种黄酮物质的活性差异。这也提示在天然膳食活性成分的筛选中,分子对接作为一种辅助手段,其结果仍需要进一步结合验证[23]。根据糖基连接方式不同,黄酮苷类化合物可以分为碳苷和氧苷两大类,芹菜素苷元形成的碳苷黄酮是谷物中分布最广泛的一类[24]。近年来黄酮类化合物的抑制活性及分子机制的研究主要集中于氧苷和苷元,对于碳苷黄酮及其与苷元活性差异的分子机制研究较少。Li Yanqin等的研究表明异槲皮苷(IC50=185 μmol/L)和芦丁(IC50=196 μmol/L)的抑制活性明显低于其苷元槲皮素(IC50=17 μmol/L)[25]。Chen Jiguang等的研究也发现飞燕草素抑制α-葡萄糖苷酶的IC50为5.291 μmol/L,而氧苷飞燕草素-3-O-葡萄糖苷和飞燕草素-3-芸香糖苷在2 mmol/L时仍未显示抑制活性[26]。这些均提示仅根据分子对接及其结合模式分析不能很好地解释导致上述3 种黄酮类物质抑制α-葡萄糖苷酶活性差异的分子机制,因此,需要进一步结合其他的理论和方法。
2.4 分子动力学模拟
RMSD指模拟过程中蛋白质构象与原始构象之间的平均偏差,是判断模拟过程中体系是否稳定的重要依据;回旋半径(radius of gyration,Rg)表示蛋白质在分子动力学过程中的体积和构象变化,其越小表示蛋白的致密性越大[27]。α-葡萄糖苷酶及其与牡荆素、异牡荆素和芹菜素复合物20 ns模拟的RMSD结果如图4A所示,可以看出在9 ns后4 种体系RMSD的变化趋于稳定(0.28 nm左右),说明模拟体系达到平衡状态。由图4B可以看出在模拟9 ns后4 种体系的Rg达到平衡状态,3 种复合物体系的Rg大于α-葡萄糖苷酶Rg,表明3 种黄酮物质与之形成复合物使α-葡萄糖苷酶在模拟过程中体积膨胀。不同模拟阶段的复合物构象叠合结果见图4C,在20 ns模拟过程中牡荆素、异牡荆素和芹菜素均能以合理的构象存在于α-葡萄糖苷酶的活性口袋中。上述结果进一步表明,牡荆素、异牡荆素和芹菜素不仅均能与其活性中心的关键氨基酸残基相互作用,且能以合理构象稳定存在于α-葡萄糖苷酶活性口袋中,并形成稳定的受体-配体复合物,因此可以表现出体外抑制活性。
将分子动力学结果中的运动轨迹文件导入VMD软件中进一步分析三者在α-葡萄糖苷酶活性口袋中的运动轨迹,结果如图4D~F所示。运动轨迹显示与牡荆素和异牡荆素相比,芹菜素能够在靠近活性中心位置稳定运动,且运动范围明显不同于牡荆素和异牡荆素。根据在活性口袋中的运动轨迹可以推测,与牡荆素和异牡荆素相比,芹菜素可能由于在α-葡萄糖苷酶活性口袋中心位置的运动更为稳定,利于阻止底物pNPG进入口袋中与关键氨基酸残基的结合,从而发挥更强的抑制活性。MTH1蛋白是癌症治疗的重要靶点,Wang Mian等通过分子动力学证实由于立体位阻效应的存在导致蛋白的3 种抑制剂在结合口袋中的运动轨迹不同,认为这是决定三者活性差异的重要因素[28]。作为芹菜素的衍生物,C6和C8位的糖苷取代使牡荆素和异牡荆素的分子体积增大[19]。因此,可以推断两者在与α-葡萄糖苷酶相互作用形成配体-受体复合物的过程中可能存在更大的空间立体位阻效应,导致其在活性口袋中运动轨迹及范围不同于它们的苷元芹菜素,从而导致抑制活性的差异。
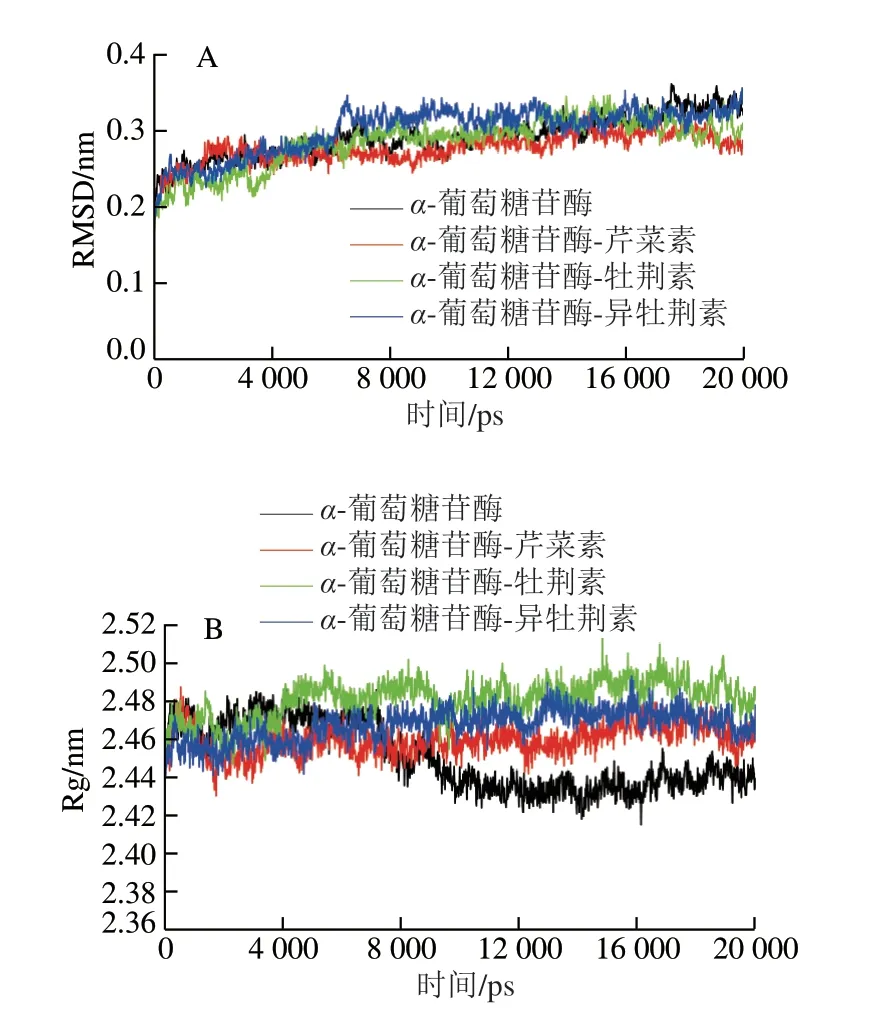

图 4 分子动力学模拟结果和芹菜素、牡荆素、异牡荆素在活性口袋中的运动轨迹Fig. 4 Results of molecular dynamic simulation and movement trajectory of vitexin, isovitexin and apigenin in the active pocket
2.5 IGM分析弱相互作用
为了进一步分析比较3 种黄酮化合物与α-葡萄糖苷酶相互作用的位阻效应,采用Multiwfn程序包分析了配体和受体分子间的弱相互作用,结果如图5所示。图5A~C中红色点表示分子间相互作用,其中负向区域(sign(λ2)ρ=-0.02)存在峰提示氢键相互作用,正向区域(sign(λ2)ρ=0.02)存在峰提示立体位阻效应。图5D~F分别为牡荆素、异牡荆素和芹菜素的等值面图,可以看出牡荆素和异牡荆素中由于糖苷取代增大了二者在相互作用过程中立体位阻效应。杨梅素和二氢杨梅素是两种结构中仅有C2—C3双键差别的黄酮类物质,He Jianlin等的研究表明两者与α-葡萄糖苷酶的分子对接打分非常接近,然而抑制活性差异却很大(IC50分别为2.09 μg/mL和85.95 μg/mL),进一步的IGM分析表明,与位阻效应相比,氢键是导致二者活性差异的主要原因[29]。根据IGM分析结果可以推断,牡荆素、异牡荆素与芹菜素相比由于存在更强的立体位阻效应导致其在相互作用过程中运动轨迹不同,可能是导致两种碳苷黄酮物质与其苷元芹菜素活性差异的结构基础。


图 5 α-葡萄糖苷酶和芹菜素、牡荆素及异牡荆素的弱相互作用和等值面分析Fig. 5 Weak interaction and isosurface analysis between α-glucosidase and apigenin, vitexin or isovitexin
3 结 论
本实验结合植物化学物的ADME和Lipinski性质,基于分子对接的筛选方法,从常见的谷物植物化学物中筛选了一些具有潜力的人源性α-葡萄糖苷酶抑制剂。酵母来源的体外酶活性抑制结果表明,3 种黄酮类化合物——牡荆素、异牡荆素和芹菜素具有一定的抑制能力,然而其抑制能力排序与其分子对接打分结果不完全一致。分子动力学模拟和IGM分析表明,由于糖苷取代导致的立体位阻效应可能是导致两种碳苷黄酮与其苷元芹菜素活性差异的分子结构基础。研究表明分子对接辅助有助于从膳食植物化学物中高通量快速筛选天然、无毒副作用的α-葡萄糖苷酶抑制剂。然而,研究中的酶活抑制活性评价仍然采用的是酵母源α-葡萄糖苷酶。因此,这些具有潜力的谷物植物化学物在机体中抑制人源α-葡萄糖苷酶的能力及降血糖效应仍有待进一步研究。

