5 种不同纯度藻蓝蛋白的抗氧化特性
梅 邢,王 广,田 瑞,刘 宇,夏兰欣,田 成,3,李 伟,3,程 超,3,
(1.湖北民族大学生物科学与技术学院,湖北 恩施 445000;2.风湿性疾病发生与干预湖北省重点实验室,湖北 恩施 445000;3.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
自由基是生物体生命活动过程中由机体生物化学反应所产生的中间产物,这种中间产物在正常的生理情况下处于产生和消除的动态平衡状态,但是当生理状态出现失衡时,自由基产生和消除的动态平衡就被打破,从而产生疾病[1]。藻蓝蛋白是藻胆蛋白的一种,由脱辅基蛋白和藻胆素通过一个或两个硫醚键共价连接而成[2],广泛存在于蓝藻中。目前很多文献一致认为藻蓝蛋白具有抗氧化能力,如Romay等[3]首先报道了藻蓝蛋白可以有效地清除羟基及烷氧自由基,并且评价了其作为体内外抗氧化剂的潜力。但关于藻蓝蛋白的抗氧化机理却存在争议,有人认为藻蓝蛋白中发挥抗氧化作用的是其色基基团,如王庭健[4]发现基因重组别藻蓝蛋白丧失了抗氧化活性,可能是由于在转录表达过程中丢失色基的缘故。此外,螺旋藻藻蓝蛋白光照下能产生自由基,但在光照下通过提高pH值、添加十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、脲及碱可使藻蓝蛋白变性,导致其产生自由基能力消失,清除自由基能力明显增强[5],该研究同样说明藻蓝蛋白的色基部分对清除自由基能力贡献较大。2009年Madhyastha等[6]将C-藻蓝蛋白暴露在蓝光下,发现其抗氧化作用增强,原因是C-藻蓝蛋白的脱辅基蛋白α链出现了微小变化,β链的76~97位氨基酸发生了重排导致,由此可见脱辅基蛋白的变化也会直接影响藻蓝蛋白的整体抗氧化特性;Rinalducci等[7-8]报道藻胆蛋白的蛋白质部分降解后其产生自由基的能力增强,此结果说明蛋白降解后色基与蛋白比值增加会使藻胆蛋白的抗氧化能力消失,反而促进自由基的产生。Estrada等[9]发现冷冻、pH值升高或降低均会导致藻胆蛋白发色团周围氨基酸残基的电荷变化,同时也会影响藻胆色素与脱辅基蛋白以及色素与色素之间的相互作用,这些因素都会影响藻胆蛋白清除自由基的能力,这说明藻胆蛋白色基周围的蛋白部分会影响其抗氧化能力。由此可见,蛋白和色基两部分对藻胆蛋白的整体抗氧化的贡献存在一定的争议。鉴于此,本实验以5 种不同色基和蛋白含量的藻蓝蛋白为原料,选择了3 种不同抗氧化机理的4 个抗氧化体系,即基于活性氧自由基的超氧阴离子自由基清除体系、基于氢原子转移的氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)体系、基于电子转移的2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基体系和铁离子总还原能力(ferric ion reducing antioxidant power,FRAP)体系,测定不同色基和蛋白质量浓度的藻蓝蛋白抗氧化能力,以期能更好地分析藻蓝蛋白抗氧化基团。
1 材料与方法
1.1 材料与试剂
藻蓝蛋白A(来自螺旋藻)西安韵乐生物科技有限公司;藻蓝素B(来自螺旋藻)东京化成工业株式会社;藻蓝蛋白C(来自葛仙米)湖北民族大学食品科学与工程实验室;藻蓝蛋白E、F(来自螺旋藻)西安欣禄生物科技有限公司。ABTS、Trolox 东京化成工业株式会社;过硫酸钾、乙醇、邻苯三酚、磷酸二氢钾、磷酸氢二钾、巯基乙醇、甘氨酸、溴酚蓝、SDS(均为分析纯)国药集团化学试剂有限公司;2,4,6-三(2-吡啶)-1,3,5-三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ)梯希爱(上海)化成工业发展有限公司;盐酸武汉市种田化工有限责任公司;三羟甲基氨基甲烷北京拓英坊科技有限公司;甲叉双丙烯酰胺、丙烯酰胺(均为分析纯)北京拜尔迪生物有限公司;预染蛋白Marker 26616(10~180 kDa)加拿大Fermentas公司。
1.2 仪器与设备
FA2104电子天平上海天平仪器厂;UV9000S紫外-可见分光光度计上海元析仪器有限公司;F97Pro荧光分光光度计上海棱光技术有限公司;U3000高效液相色谱仪美国赛默飞世尔科技公司;YY-6C型电泳仪北京六一生物科技有限公司。
1.3 方法
1.3.1 不同藻蓝蛋白的高效液相色谱分析
色谱柱:分子筛色谱柱(4.6 mm×300 mm,5 μm);流动相:pH 7.0、0.5 mol/L磷酸二氢钾及磷酸氢二钾的缓冲液;流速为0.3 mL/min;检测波长为620 nm。以藻蓝素B为标准样品,根据分离图谱确定其他4 种样品的藻蓝蛋白[10]。
1.3.2 不同藻蓝蛋白的荧光光谱分析
配制质量浓度2 mg/mL的藻蓝蛋白A、B、E、F溶液以及质量浓度5 mg/mL的藻蓝蛋白C溶液,测定条件:扫描速率12 000 nm/min、激发波长500~700 nm、发射波长500~700 nm,进行荧光光谱扫描[11-12]。
1.3.3 不同藻蓝蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
用样品溶解液配制质量浓度1 mg/mL的藻蓝蛋白溶液,配制分离胶质量分数为10%,浓缩胶质量分数为3%,标准蛋白Marker上样量10 μL,5 种藻蓝蛋白的上样量15 μL,进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),开始时电流为10 mA,待样品进入分离胶后改为30 mA,当染料前沿距硅胶框底边1 cm左右时,停止电泳[13]。
1.3.4 不同藻蓝蛋白的紫外-可见光谱分析
配制质量浓度1 mg/mL的藻蓝蛋白溶液,用紫外-可见分光光度计在200~800 nm波长处进行光谱扫描,用藻蓝蛋白溶液在最大可见光波长处吸光度与蛋白质特征波长处吸光度之比(Amax/A280nm)表示藻蓝蛋白纯度[14]。
1.3.5 FRAP法测定不同藻蓝蛋白的总抗氧化能力
将300 mmol/L、pH 3.6的醋酸缓冲液、10 mmol/L TPTZ溶液、20 mmol/L三氯化铁溶液以体积比10∶1∶1配制成FRAP工作液,分别取50、100、200、400、600、800 μmol/L和1 000 μmol/L Trolox溶液0.1 mL于试管中,加入2.9 mL FRAP工作液、37 ℃水浴10 min,于593 nm波长处测定吸光度,同时以0.1 mL蒸馏水加入2.9 mL FRAP工作液作空白对照[15-17],以Trolox浓度为横坐标,A593nm为纵坐标绘制Trolox标准曲线,标准曲线方程为:y=0.000 9x-0.120 3,R2=0.992 7。
藻蓝蛋白溶液抗氧化能力的测定:用蒸馏水配制质量浓度0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5 mg/mL和5.0 mg/mL藻蓝蛋白溶液,取0.1 mL于试管中,加入2.9 mL FRAP工作液,37 ℃水浴10 min,在593 nm波长处测定吸光度,记录吸光度。根据吸光度计算Trolox当量,以每毫升所含Trolox的浓度表示FRAP,单位为μmol/mL。
1.3.6 不同藻蓝蛋白对ABTS阳离子自由基的清除能力
取5 mL 7 mmol/L ABTS和88 μL过硫酸钾溶液混合静置过夜,得到ABTS工作液,将ABTS工作液用蒸馏水稀释至734 nm波长处的吸光度为0.700±0.020(A0)。用蒸馏水分别配制质量浓度0.2、0.4、0.6、0.8 mg/mL和1.0 mg/mL的藻蓝蛋白A、B、E和F溶液,配制质量浓度0.1、0.2、0.3、0.4 mg/mL和0.5 mg/mL的藻蓝蛋白C溶液各5 mL,然后分别取1 mL的藻蓝蛋白溶液,再加入4 mL的ABTS工作液,混合10 s后静置6 min,在734 nm波长处测定吸光度,记录吸光度Ai,用蒸馏水作为对照,记录吸光度Aj[18-19]。按公式(1)测定ABTS阳离子自由基清除率。

1.3.7 不同藻蓝蛋白对超氧阴离子自由基的清除能力
用蒸馏水配制质量浓度0.3、0.6、1.2、2.4 mg/mL和4.8 mg/mL藻蓝蛋白溶液各5 mL,取25 ℃水浴保温20 min的Tris-HCl(0.05 mol/L、pH 8.2)缓冲溶液3.7 mL,加入1 mL藻蓝蛋白溶液,加入25 ℃水浴保温20 min的15 mmol/L邻苯三酚0.3 mL,摇匀,倒入比色皿中,立即于420 nm波长处读取吸光度,每隔30 s测定一次吸光度,共测定4 min,重复3 次。以测定时间为横坐标,A420nm为纵坐标绘制曲线,求其斜率vi,即为加入藻蓝蛋白的邻苯三酚的氧化速率。同时用蒸馏水代替藻蓝蛋白溶液测定邻苯三酚自氧化的速率v0[20-22]。按公式(2)测定超氧阴离子自由基清除率。

式中:v0为邻苯三酚自氧化速率;vi为加入藻蓝蛋白的邻苯三酚氧化速率。
1.3.8 不同藻蓝蛋白对氧自由基的吸收能力
用75 mmol/L磷酸缓冲液(pH 7.4)配制质量浓度分别为10、20、40、60、80 μg/mL和100 μg/mL的藻蓝蛋白A、B、E、F溶液及质量浓度分别为100、120、140、160、180 μg/mL和200 μg/mL的藻蓝蛋白C溶液各10 mL,2.1 μmol/L荧光素钠、100 mmol/L 2,2’-偶氮二(2-甲基丙基咪)(2,2’-azobis(2-methylpropionamidine)dihydrochloride,AAPH)以及浓度为10、20、40、60、80、100 μmol/L的Trolox溶液。加入1 mL荧光素钠及1 mL样品溶液于试管中,37 ℃水浴保温20 min,再加入1 mL 100 mmol/L AAPH,激发波长为485 nm、发射波长为535 nm,每1 min测定一次荧光强度,连续测定90 min。测定结束后计算荧光强度-时间曲线即荧光衰减曲线面积(AUCSample)[23-24],另两组中一组只加入荧光素钠和磷酸缓冲液,测定其荧光衰减曲线面积(AUCFL),一组加入缓冲液和荧光素钠及AAPH,测定其荧光衰减曲线面积(AUCAAPH),同时做Trolox标准抗氧化物质的对照实验,以Trolox浓度为横坐标,以荧光熄灭曲线的延迟部分面积(netAUC)为纵坐标绘制标准曲线,拟合回归方程为y=1.297 5x+5.291 4,R2=0.987 6。将藻蓝蛋白所测的netAUC带入Trolox回归方程,计算藻蓝蛋白的Trolox当量,以每升所含Trolox的浓度表示ORAC,单位为μmol/L。
1.4 数据处理与分析
所有实验重复3 次,以平均值±标准差表示,实验数据采用SPSS 21.0软件分析,并进行新复极差差异显著性分析和皮尔逊偏相关分析。使用Origin 2018软件作图。
2 结果与分析
2.1 不同藻蓝蛋白的高效液相色谱分析结果

图 1 藻蓝素B的高效液相色谱图Fig. 1 High performance liquid chromatogram of phycocyanin B
以藻蓝素B为标准样品进行高效液相色谱分析,结果见图1~3,根据检测波长620 nm处高效液相色谱峰对应的紫外-可见扫描光谱图确定该峰是否为藻蓝蛋白分离峰。由图1可知,藻蓝素B主要分离峰保留时间为10.25 min,图2中此峰对应的紫外-可见扫描光谱显示吸收峰分别位于280、357、620 nm,这与王肖肖等[25]研究报道的藻蓝蛋白吸收峰非常吻合,因此可以将该样品确定为藻蓝蛋白,对比其他4 种样品高效液相色谱图(图3)可以看出,样品均为藻蓝蛋白。

图 2 藻蓝素B高效液相色谱图中保留时间为10.25 min分离峰的紫外-可见扫描光谱图Fig. 2 Ultraviolet-visible spectrum of separation peak of at retention time of 10.25 min in high performance liquid chromatogram of phycocyanin B

图 3 4 种藻蓝蛋白的高效液相色谱图Fig. 3 High performance liquid chromatograms of four different phycocyanins
2.2 不同藻蓝蛋白的荧光光谱分析结果

图 4 5 种藻蓝蛋白的荧光发射光谱Fig. 4 Fluorescence emission spectra of five different phycocyanins
藻蓝蛋白所有色基在功能上可分为两种类型,其中一种是吸收能量并产生荧光的“荧光型”色基[26]。不同原料来源的藻蓝蛋白最大荧光发射峰存在一定的差异,因此报道的荧光光谱也有一些区别[27],但大部分蓝藻中藻蓝蛋白的最大荧光发射峰在635~650 nm之间[28]。实验所用5 种藻蓝蛋白的荧光发射光谱见图4,5 种藻蓝蛋白的最大发射波长均在650 nm左右,这与文献[29]报道的结果吻合。
2.3 不同藻蓝蛋白的SDS-PAGE结果

图 5 5 种藻蓝蛋白的SDS-PAGE电泳图Fig. 5 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis of five different phycocyanins
由图5可知,A、B、E、F 4 种藻蓝蛋白的目的条带比较清晰,C样品由于藻蓝蛋白纯度低,所以条带略淡。SDS-PAGE图中,比较清晰的条带分子质量为14.5 kDa左右,可能是藻蓝蛋白的β亚基(图中箭头);另外,有一条比较淡的条带,分子质量为16 kDa左右,可能是藻蓝蛋白的α亚基(图中箭头),此结果与张成武等[30]的研究结果一致。
2.4 不同藻蓝蛋白的紫外-可见扫描光谱分析结果
表1为不同纯度藻蓝蛋白色基及蛋白质的特征吸收峰,藻蓝蛋白的色基含量以可见光区最大吸收波长的吸光度表示,蛋白质含量以280 nm波长处的吸光度表示。
由表1可知,5 种不同纯度藻蓝蛋白的蛋白质含量由高到低依次为C、E、F、B、A;色基含量由高到低依次为E、A、F、B、C,纯度由高到低依次为A、B、F、E、C。
不同藻蓝蛋白紫外-可见扫描光谱如图6所示。除藻蓝蛋白C以外,其他4 种藻蓝蛋白可见光区的吸收峰主要集中在610~620 nm,而样品C除了620 nm波长处的吸收峰外,在560 nm左右波长处还有一个微弱的吸收峰,结合文献[26]判断藻蓝蛋白C可能为R-藻蓝蛋白,其他4 种为C-藻蓝蛋白。

表 1 不同藻蓝蛋白的色基、蛋白质吸光度及纯度结果Table 1 Chromophore contents, protein contents and purities of different phycocyanins

图 6 5 种藻蓝蛋白紫外-可见扫描光谱Fig. 6 Ultraviolet-visible spectra of five different phycocyanins
2.5 不同藻蓝蛋白的抗氧化作用
目前用于评价物质抗氧化能力的方法较多,如ABTS阳离子自由基清除体系、超氧阴离子自由基清除体系、ORAC体系等,杨继涛[31]将这些抗氧化能力测定体系分为4 类:1)活性氧自由基清除体系,如羟自由基和超氧阴离子自由基体系;2)基于氢原子转移体系,如ORAC、硫代巴比妥酸反应物法、硫酸氰铁法;3)基于电子转移的抗氧化体系,包括1,1二苯基-2-三硝基苯肼、ABTS、FRAP、总酚估计法;4)金属离子螯合能力体系。每一种抗氧化体系对评价物质的抗氧化能力都各有优缺点,基于此本实验选择了4 种抗氧化体系从3 个方面来比较不同色基含量的藻蓝蛋白抗氧化能力。
2.5.1 不同藻蓝蛋白在FRAP体系的总抗氧化能力

图 7 5 种藻蓝蛋白的FRAPFig. 7 FRAP of five different phycocyanins
由图7可知,不同藻蓝蛋白在FRAP体系中的总抗氧化能力存在明显差异,在藻蓝蛋白质量浓度为0.5~5 mg/mL时,其总抗氧化能力与质量浓度呈良好的线性关系,计算比较FRAP为300 μmol/mL时对应的藻蓝蛋白质量浓度,结果发现,在FRAP体系中,5 种藻蓝蛋白总抗氧化能力从大到小依次为A、B、E、F、C。
2.5.2 不同藻蓝蛋白对ABTS阳离子自由基的清除能力
由图8可知,藻蓝蛋白对ABTS阳离子自由基的清除能力具有明显的剂量效应关系,当藻蓝蛋白质量浓度为0.1~1 mg/mL时,藻蓝蛋白A、B、E、F与ABTS阳离子自由基清除能力呈现良好的线性关系;但藻蓝蛋白C与ABTS阳离子自由基清除能力却呈现对数关系,即随着藻蓝蛋白C质量浓度的增加,对ABTS阳离子自由基的清除能力增加幅度越大。

图 8 5 种藻蓝蛋白对ABTS阳离子自由基的清除能力Fig. 8 ABTS cation radical scavenging capacity of five different phycocyanins
2.5.3 不同藻蓝蛋白对超氧阴离子自由基的清除能力
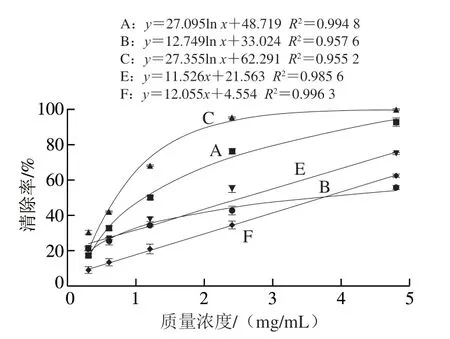
图 9 5 种藻蓝蛋白对超氧阴离子自由基的清除能力Fig. 9 Superoxide anion free radical scavenging capacity of five different phycocyanins
由图9可知,藻蓝蛋白对超氧阴离子自由基具有明显的剂量效应关系,当藻蓝蛋白质量浓度为0.1~5 mg/mL时,藻蓝蛋白E、F与超氧阴离子自由基清除能力呈现良好的线性关系;但藻蓝蛋白A、C、B与超氧阴离子自由基清除能力却呈现对数关系,且藻蓝蛋白C的对数曲线斜率大于藻蓝蛋白B和A,说明藻蓝蛋白C对超氧阴离子自由基的清除速率大于藻蓝蛋白B和A。
2.5.4 不同纯度藻蓝蛋白对氧自由基的吸收能力

图 10 5 种藻蓝蛋白对氧自由基的吸收能力Fig. 10 ORAC of five different phycocyanins
由图10可知,当藻蓝蛋白质量浓度为0~200 μg/mL时,5 种藻蓝蛋白对氧自由基的吸收能力均呈对数关系。
按照图8、9中拟合的回归方程分别计算藻蓝蛋白清除自由基的半抑制浓度(half maximal inhibitory concentration,IC50),根据图7和图10中拟合的回归方程计算FRAP IC300μmol/mL和ORAC IC50μmol/L,结果见表2。

表 2 不同抗氧化体系IC50、IC300 μmol/mL及IC50 μmol/LTable 2 IC50, IC300 μmol/mL and IC50 μmol/L values of five different phycocyanins in different antioxidant systems
由表2可知,在FRAP体系中,5 种藻蓝蛋白总抗氧化能力在0.01和0.05水平上均具有显著差异,其中藻蓝蛋白C的总抗氧化能力最好;在ABTS阳离子自由基体系中,藻蓝蛋白A和B对ABTS阳离子自由基的清除能力差异不显著,其他藻蓝蛋白均有显著差异;同样地,藻蓝蛋白C的IC50最小,说明其对ABTS阳离子自由基的清除能力最好;邻苯三酚自氧化体系中,藻蓝蛋白B和F的抗氧化效果差异不显著,藻蓝蛋白C对超氧阴离子自由基清除能力最好;在ORAC体系中,在0.01水平上藻蓝蛋白E和F的效果相当,差异不显著,抗氧化能力最好的是藻蓝蛋白A,藻蓝蛋白C的抗氧化能力最差。
将表2中的数据与5 种藻蓝蛋白的色基含量、蛋白质量浓度和纯度进行皮尔逊偏相关分析,结果见表3。

表 3 抗氧化指标与藻蓝蛋白纯度、色基及蛋白质量浓度的皮尔逊偏相关性分析Table 3 Correlational analysis of antioxidant properties with phycocyanin purity, chromophore content and protein content
由表3可知,在ABTS阳离子自由基体系中,藻蓝蛋白清除ABTS阳离子自由基的IC50与色基含量呈极显著正相关,与蛋白质量浓度、藻蓝蛋白纯度呈极显著负相关,即色基含量越高,IC50越大,对ABTS阳离子自由基清除能力越差,而藻蓝蛋白中蛋白质量浓度和纯度越高,IC50越小,对ABTS阳离子自由基清除能力越好,说明蛋白质部分对ABTS阳离子自由基的清除起主要作用;在超氧阴离子自由基体系中,藻蓝蛋白中蛋白质量浓度越高,IC50越小,对超氧阴离子自由基的清除效果越好,说明主要清除自由基的基团是蛋白质部分;在ORAC体系中,色基含量越高和纯度越大时,ORAC越小,其抗氧化效果越好,这说明色基部分对本体系的抗氧化效果起主要作用,这与Benedetti等[32]报道的藻蓝蛋白中藻蓝素可能是其清除体内自由基的主要来源一致;在FRAP体系中,蛋白质量浓度越高,FRAP越大,说明总抗氧化能力越强。
3 讨 论
本实验利用SDS-PAGE、荧光光谱和紫外-可见光谱对实验所用的5 种藻蓝蛋白进行了定性分析,同时选择了3 种抗氧化机理体系对其抗氧化能力进行测定,如基于活性氧的超氧阴离子自由基清除体系、基于氢原子转移的ORAC体系和基于电子转移的ABTS阳离子自由基体系和FRAP体系,通过紫外-可见扫描光谱鉴定藻蓝蛋白的纯度、色基含量及蛋白质量浓度与抗氧化指标的相关性分析,从而对藻蓝蛋白抗氧化机理提出猜想。实验结果表明,在基于活性氧和电子转移的抗氧化体系中,藻蓝蛋白起主要抗氧化作用的基团是蛋白质部分,在基于氢原子转移的体系中,藻蓝蛋白起主要作用的是色基基团。在ORAC法中,以AAPH作为自由基为来源,抗氧化剂通过提供氢离子而形成更为稳定的自由基,从而阻断自由基链式反应,藻蓝蛋白的发色团(藻蓝素)中开放的四吡咯链与胆红素的结构非常相似,而Stocker等[33]研究发现,胆红素具有消除过氧化物自由基的作用,其机理是胆红素可将过氧化物自由基绑定到C10位四吡咯分子的一个氢原子上,使自由基与中心碳原子形成共振稳定,最终扩展到整个胆红素,藻蓝蛋白色基实现抗氧化作用的机制可能与其类似;ABTS法和FRAP法则是基于电子转移的一种方法,Evstigneev[34]发现藻胆蛋白具有电子转移的功能,在用藻胆蛋白或藻胆体所构成的电化学池中,光照后获得了一定的光生电势,表明当存在合适的电子受体时,藻胆蛋白就能够给出电子,在这两个体系中,藻蓝蛋白的抗氧化作用与蛋白质部分呈正相关。邻苯三酚自氧化法则是由于藻蓝蛋白能催化超氧阴离子与H+结合生成O2和H2O2,通过阻止中间产物的积累从而达到对超氧阴离子的清除作用。综上,藻蓝蛋白在不同的体系中表现出不同的抗氧化机理,这主要是因为在不同体系中藻蓝蛋白发挥抗氧化作用的主要基团不同,这也是藻蓝蛋白的抗氧化作用存在差异的主要原因。

