响应面法优化羊肚菌多糖提取工艺研究
吴孔阳,原瑞材,杨同香, 郝道宽, 王 震,李闯鹏,郭肖华
(1. 洛阳师范学院 生命科学学院,河南 洛阳 471934; 2. 河南科技大学 食品与生物工程学院,河南 洛阳 471023;3. 黄淮学院 生物与食品工程学院,河南 驻马店 463000)
羊肚菌(Morchella)隶属于子囊菌亚门(Ascomycotina)、盘菌纲(Discornycetes)、盘菌目(Pezizales)、羊肚菌科 (Morchellaceae)、羊肚菌属(Morchella),是一种世界公认的珍稀食用药用菌[1]. 由于它的菌盖表面凹凸不平、状如羊肚,故名羊肚菌. 研究表明,羊肚菌多糖具有多种生物活性,包括抗氧化[2-4]、抗肿瘤[5]、免疫调节[6]、降低胆固醇[7]、抗黑色素生成[8]等. 目前,羊肚菌多糖的提取纯化及生物活性成为研究的热点.
近年来,有关羊肚菌多糖的提取着重从羊肚菌菌丝体及发酵液中进行[9-11],从子实体提取羊肚菌多糖的报道较少[12]. 多糖提取方式主要有水提醇沉法[13]、酶解提取法[14]、超声波辅助提取法等[15]. 水提取方法因其简单安全,在工业上被广泛应用. 目前对子实体羊肚菌多糖水提法研究相对较少,本实验拟开展热水浸提法获取羊肚菌多糖,并对其参数进行了优化. 采用苯酚-硫酸法对羊肚菌多糖含量进行测定,考察了水料比、提取温度、提取时间对羊肚菌多糖得率的影响,通过响应面法对提取参数进行优化,旨在为羊肚菌子实体的开发利用提供参考.
1 材料和方法
1.1 材料和仪器
材料:羊肚菌子实体由河南省南山菇业有限公司提供; 苯酚、硫酸等试剂均为分析纯.
主要仪器:紫外可见分光光度计(UV-5100),上海元析仪器有限公司; 倾斜式高速万能粉碎机(FW-400A),北京中兴伟业仪器有限公司.
1.2 实验方法
1.2.1 羊肚菌多糖提取流程
将羊肚菌在40 ℃条件下烘干4 h后,粉碎机粉碎. 称取1.000 0 g羊肚菌粉置于小烧杯中,按一定水料比加水,水浴恒温一定时间,离心机(4 000 r/min)离心10 min,得到提取液.
1.2.2 单因素实验
(1)提取时间对多糖提取率的影响
称取1.000 0g干燥的羊肚菌粉,固定水料比50∶1 (mL/g)、提取温度60 ℃,选取提取时间1 h、2 h、3 h、4 h、5h,按照1.2.1提取流程和1.3.2多糖含量的测定进行实验.
(2)水料比对多糖提取率的影响
称取1.000 0 g干燥的羊肚菌粉,在上述优化条件下,选取水料比20∶1、30∶1、40∶1、50∶1、60∶1(mL/g),按照1.2.1提取流程和1.3.2多糖含量的测定进行实验.
(3)提取温度对多糖提取率的影响
称取1.000 0 g干燥的羊肚菌粉,在上述优化条件下,选取温度25 ℃、40 ℃、55 ℃、70 ℃、85 ℃,按照1.2.1提取流程和1.3.2多糖含量的测定进行实验.
1.2.3 响应面优化实验
在单因素实验结果的基础上,结合Box-Behnken中心组合实验设计原理,对水料比(A)、提取温度(B)、提取时间(C)按照三因素三水平进行编码,实验设计中的水平及编码见表1. 最后以多糖提取率为响应值,利用软件Design Expert 10.0.4.0对试验数据进行分析.
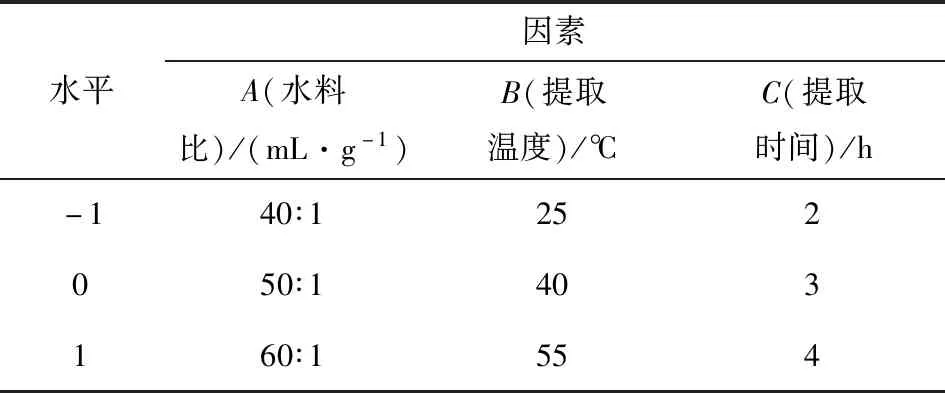
表1 因素水平编码表
1.3 多糖测定及方法
1.3.1 葡萄糖标准曲线的绘制
采用苯酚-硫酸法测定多糖含量. 精确称量无水葡萄糖1.0000 g于100 mL容量瓶中定容. 再取出1 mL溶液于100 mL容量瓶中定容. 分别取出0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL至试管中,每组浓度做三次平行,各试管分别加入蒸馏水至2 mL,加入5%苯酚1 mL、浓硫酸5 mL,于沸水浴中加热15 min. 取出放入冷水中降温,用紫外-可见光分光光度计测定各试管中样品在490 nm处的吸光值. 得到的数据经Excel回归分析得到线性回归方程,以吸光度值X为横坐标,多糖浓度Y(μg/mL)为纵坐标,绘制标准曲线.
1.3.2 羊肚菌多糖含量的测定
从提取液中取适当量的样品至试管中,每个样品做三组平行,加蒸馏水稀释至2 mL,加入5%苯酚1 mL、浓硫酸5 mL,于沸水浴中加热15 min. 取出放入冷水中降温,用紫外-可见光分光光度计测定各试管中样品在490 nm处的吸光值.
1.3.3 样品多糖得率计算
根据标准曲线线性回归方程求得多糖浓度Y; 根据式(1),求得样品多糖得率W.
W(%)=(C×V×N×10-6/M)×100
(1)
式(1)中,W为多糖得率(%);C为多糖浓度(μg/mL);V为定容体积(mL);N为稀释倍数;M为样品质量(g).
2 结果与分析
2.1 单因素实验
2.1.1 提取时间对多糖得率的影响
提取时间对多糖提取有显著的影响,提取时间对羊肚菌多糖得率的影响如图1所示. 随着提取时间的延长,多糖的浸出量也逐渐增多,在3 h时达到最大,然后随着提取时间增长,羊肚菌多糖得率趋于平缓.

图1 提取时间对羊肚菌多糖得率的影响
2.1.2 水料比对多糖得率的影响
水料比对羊肚菌多糖得率的影响如图2所示. 当水料比在20∶1、30∶1、40∶1(mL/g)时,羊肚菌多糖得率趋于一致,而在水料比为50∶1(mL/g)时,羊肚菌多糖得率最高,之后多糖得率下降.
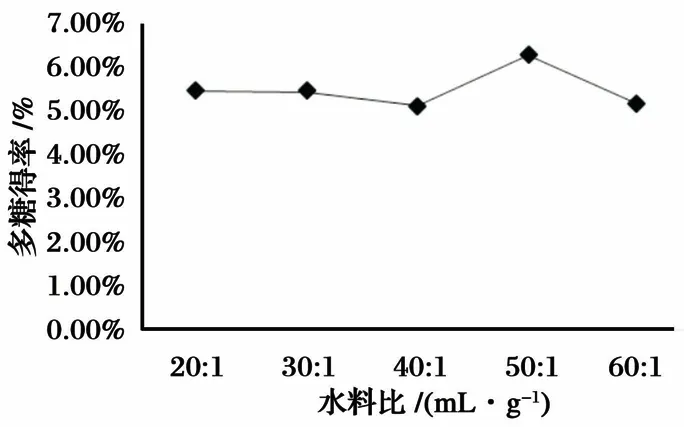
图2 水料比对羊肚菌多糖得率的影响
2.1.3 提取温度对多糖得率的影响
提取温度对羊肚菌多糖得率的影响如图3所示. 开始多糖含量随温度的升高而升高,40 ℃时达到最大,超过40 ℃时,羊肚菌多糖得率降低. 这可能是在高温提取条件下多糖的结构不稳定所致.
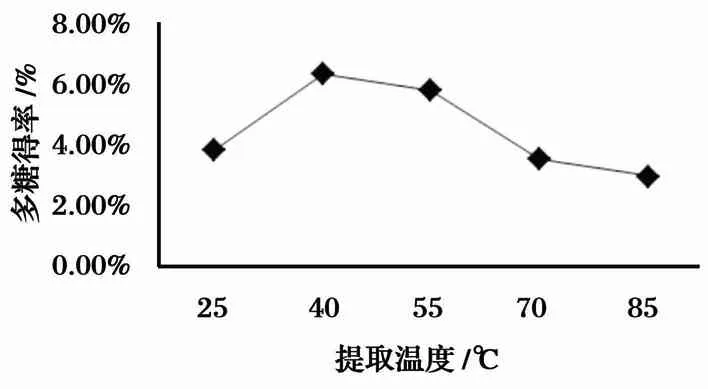
图3 提取温度对羊肚菌多糖得率的影响
2.2 响应面分析法对羊肚菌多糖提取工艺的优化
2.2.1 Box-Behnken实验设计及结果
根据单因素实验结果,在影响羊肚菌多糖得率的3个因素中分别选取三个水平进行编码(表1),并进行响应面优化实验,结果见表2.

表2 响应面实验设计及结果
2.2.2 回归模型的建立及方差分析
借助Design Expert 10.0.4.0对表2实验结果进行多元回归拟合,得二次多项式回归模型:Y=7.02535-0.051975A+1.02305B+0.38452C+0.23469AB+0.36904AC+0.0854508BC-0.86672A2-1.39369B2-0.50324C2.
回归模型方差分析结果见表3. 回归模型极显著(p=0.0042<0.01),失拟项不显著(p=0.336 4>0.05); 回归方程总决定系数R2=0.920 4,表明模型对实验拟合度较好,可用该模型对实验结果进行预测. 从表3中可以看出,模型中一次项B、二次项B2影响极显著,二次项A2影响显著. 影响得率的大小顺序为提取温度>提取时间>水料比.
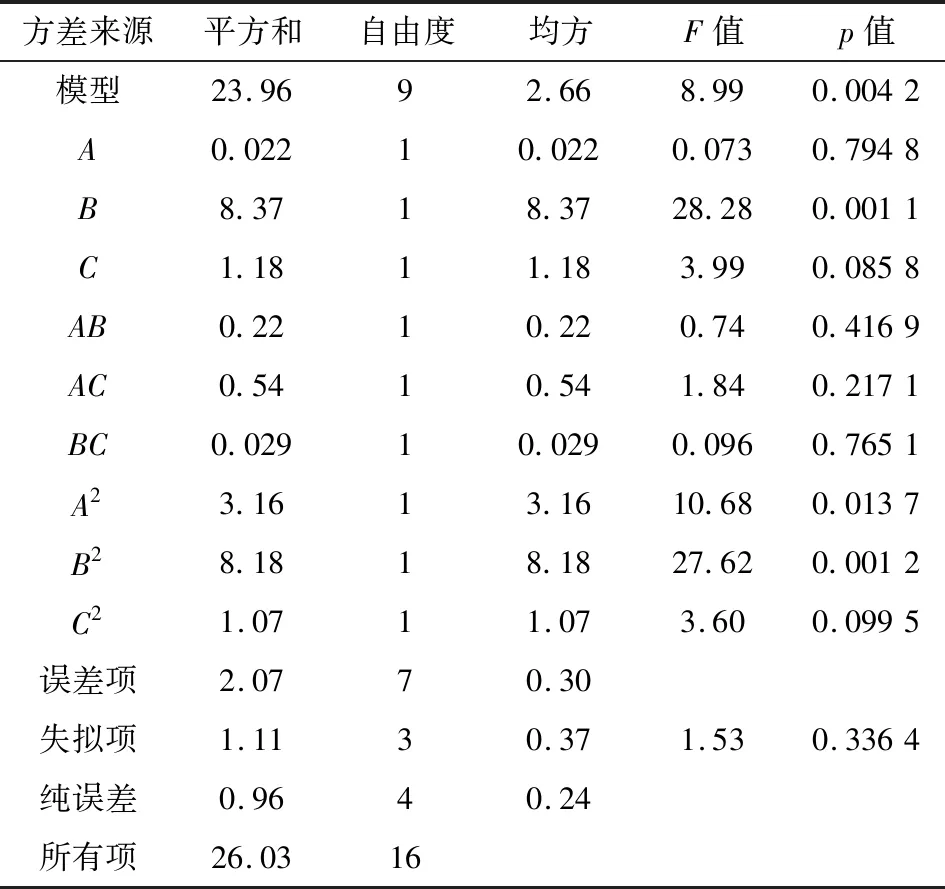
表3 回归模型的方差分析及回归系数的显著性检验
2.2.3 响应面的曲面分析
图4~图6直观地给出了各因素交互作用对羊肚菌多糖提取率影响的响应面分析图和等高线分析图. 响应面的坡度越大说明该因素对多糖得率影响越大,椭圆形的等高线图说明两因素之间交互作用显著,圆形说明交互作用不显著[13].
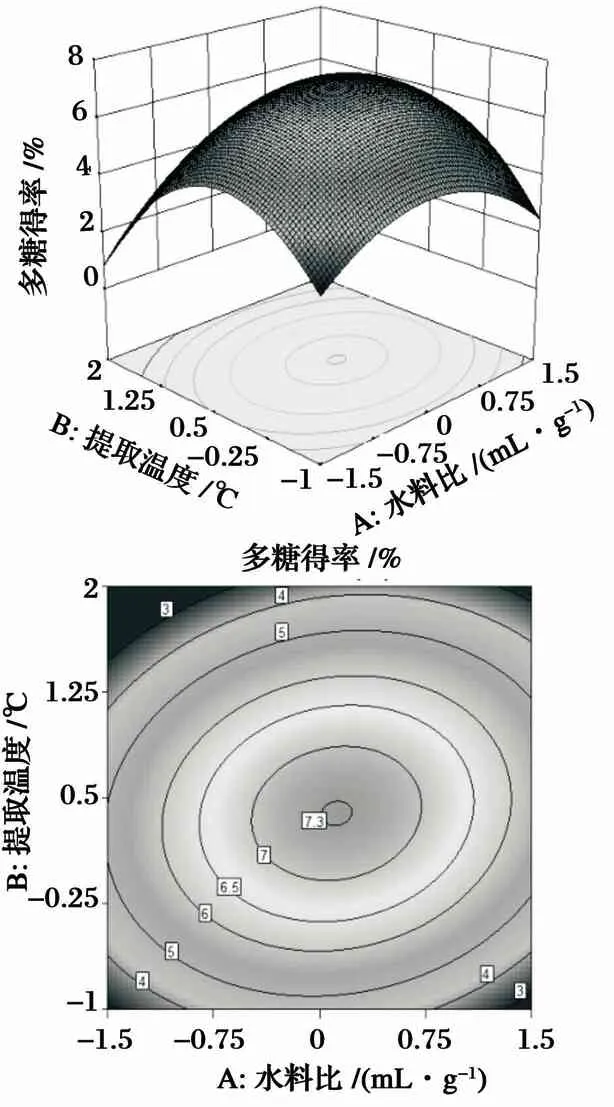
图4 提取温度与水料比的相互影响及等高线分析图
由图4可知,响应面的坡度较大,表明提取温度与水料比的交互作用对羊肚菌多糖得率影响较大. 从等高线形状可以看出,提取温度对多糖得率的影响要大于水料比. 由图5可知,响应面的坡度较大,表明提取时间与水料比的交互作用对羊肚菌多糖得率影响较大. 从等高线形状可以看出提取时间对多糖得率的影响要大于水料比. 由图6可知,响应面的坡度较大,表明提取时间与提取温度的交互作用对羊肚菌多糖得率影响较大. 从等高线形状可以看出提取温度对多糖得率的影响要大于提取时间. 由图4~图6可以看出,水料比在(45∶1)~(55∶1)(mL/g),提取温度在40~50 ℃,提取时间在3~4 h时,羊肚菌多糖得率达到最大值.
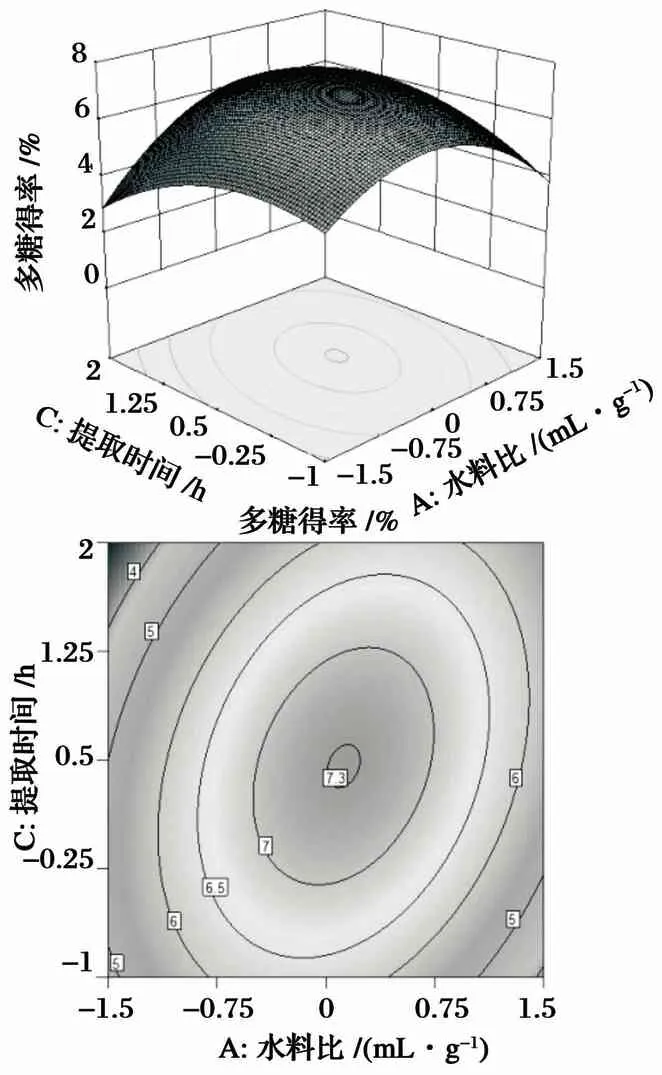
图5 提取时间与水料比的相互影响及等高线分析图
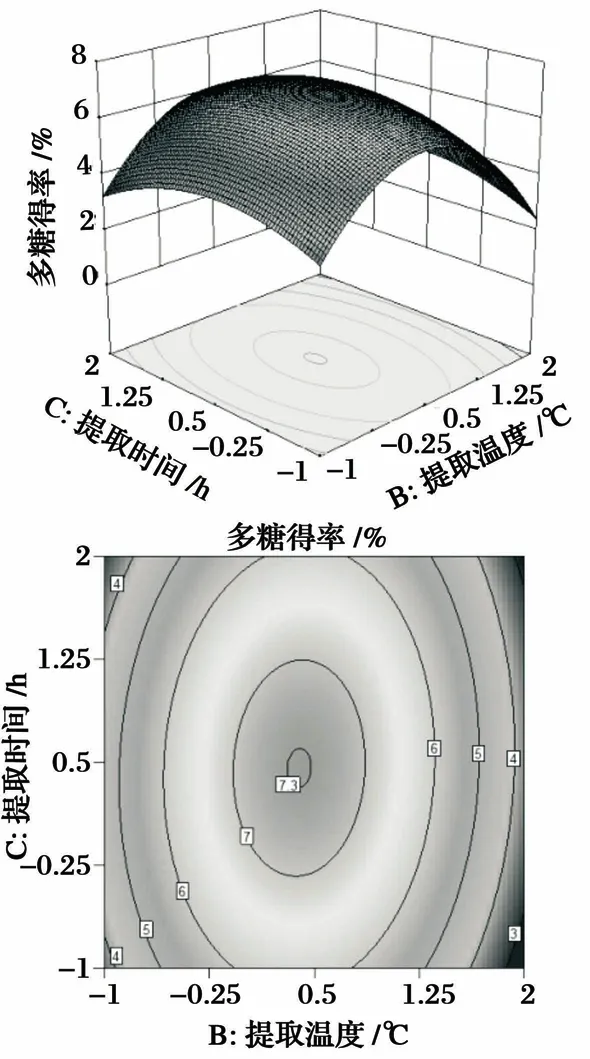
图6 提取时间与提取温度的相互影响及等高线分析图
2.2.4 确定最优值和回归模型的验证实验
通过Design-Expert 10.0.4.0软件分析得出,羊肚菌多糖提取的最佳条件为水料比51.21∶1(mL/g)、提取温度45.865 ℃、提取时间3.459 h,在此条件下预测多糖得率为 7.311 %. 综合考虑,将提取条件修正为水料比51∶1(mL/g)、提取温度46 ℃、提取时间3.5 h,在此条件下重复三次,多糖得率稳定在(7.39±0.21)%,与预测值基本一致,模型可靠,具有实际应用价值.
3 结论与讨论
本实验以羊肚菌子实体为原料,热水浸提羊肚菌多糖后直接测定多糖含量,通过单因素实验和响应面分析法相结合优化提取参数,结果确定最优提取条件为:水料比51∶1(mL/g)、提取时间3.5h、提取温度46℃. 在此优化条件下,多糖实际得率为(7.39±0.21)%,实验结果有很好的重复性,说明利用响应面设计实验来优化羊肚菌多糖热水浸提工艺是可行的.
任嘉兴等[16]对野生羊肚菌多糖提取工艺优化的研究结果显示,优化后的提取温度在88 ℃,而此研究结果提取温度为46 ℃. 这表明不同品种的羊肚菌,其所含的多糖对温度敏感性差异较大,同时也表明羊肚菌多糖种类的差异性. 范三红等[12]开展酶法结合超声波辅助提取羊肚菌多糖的研究,结果多糖实际得率为7.79%. 周益帆等[17]报道了碱提取羊肚菌多糖的工艺,多糖的得率达到5.39%. 韩融冰等[9]报道了羊肚菌深层发酵液中多糖的提取工艺. 以上这些均采用了不同的方法和工艺对来源于羊肚菌或其发酵液中的多糖提取进行研究,说明这些工艺在不同程度上能够获得多糖.

