祛风通络方对单侧输尿管梗阻大鼠肺肾组织AQP4 表达的影响∗
刘 艳,谢 君,王 竹,李睿萍,孙万森△
1 西安交通大学第二附属医院,陕西 西安710004;2 西安市胸科医院
汪昂《医方集解》云:“肺为水之上源,肾为水之下源”,水通道蛋白(aquaporin-4,AQP4)与机体水液代谢密切相关。本研究观察AQP4在单侧输尿管梗阻(unilateral ureteral obstruction,UUO)大鼠肺、肾组织的不同表达及祛风通络方的干预作用,探求肺、肾在水液代谢过程中的分子生物学基础,为祛风通络方的临床应用提供依据。
1 材料与方法
1.1 动物与药品健康SPF 级雄性成年SD 大鼠40 只,体质量(200±20)g,由西安交通大学医学院动物实验中心提供,实验动物合格证号:SCXK(陕)2017-001;缬沙坦胶囊(代文,北京诺华制药有限公司,国药准字H20040217,规格:80 mg/片);祛风通络方购于西安交通大学第二附属医院草药房,由黄芪、乌梢蛇、防风、海风藤、生地黄、桑寄生组成,每剂含生药130 g。
1.2 实验试剂兔抗大鼠一抗(美国Santa Cruz 公司,批号:sc-32739);SP 试剂盒(北京中杉金桥生物技术有限公司,批号:SP-9001);Anti-Aquaporin 4 antibody(美国abcam 公司,批号:ab952);Goat anti-Mouse IgG Secondary Antibody(批号:L3031)及Goat anti-Rabbit IgG Secondary Antibody(批 号:L3011)均 由Signalway antibody 公司提供;总RNA 极速抽提试剂盒(上海飞捷生物技术有限公司,批号:RNAfast200);PrimeScript RT Master Mix(TaKaRa 公 司,批号:RR036A);SYBR Premix Ex TaqTM Ⅱ(TaKaRa公司,批号:RR820A)。
1.3 动物分组及模型制备48 只大鼠适应性喂养1 周后按随机数字表法选出8 只作为空白组。剩余40只采用单侧输尿管结扎法[1]建立大鼠肾病模型,1 周后从造模大鼠中按随机数字表法抽取8只,腹腔注射10%水合氯醛(0.4 mL/100 g)麻醉,取大鼠肾脏组织HE 染色,若见大量肾小管萎缩,炎症细胞浸润,大量基质沉积,提示造模成功[2]。将造模成功32 只大鼠按随机数字表法分为模型组、缬沙坦组及祛风通络方大、小剂量组,每组8 只。术后第一天开始灌胃,祛风通络方大、小剂量组分别给予2、1 g/mL浓度药液2 mL,空白组、模型组灌服等体积生理盐水,每日1次,共20天。给药结束后处死大鼠,取术侧肺、肾组织,一半置于4%多聚甲醛溶液中固定,脱水、透明、浸蜡、石蜡包埋,一半用生理盐水冲洗、吸干后液氮速冻,置-80℃冰箱保存。
1.4 观察指标及方法
1.4.1 免疫组化法检测肺、肾组织AQP4表达石蜡切片梯度酒精脱蜡后以微波热修复进行抗原修复,低火微波加热3 min,高火10 min,室温放置60 min,一抗按l∶200 进行稀释,4℃过夜,PBS 冲洗4次后滴加二抗,DBA显色,脱水、封片。每个组织取3 张切片,各观察3 个视野,用Image-pro pluss 6.0 彩色图像分析系统分别扫描测量阳性细胞的积分光密度值,进行统计分析。
1.4.2 Western blot 检测肺、肾组织AQP4 蛋白表达分别取大鼠肺、肾组织100 mg研磨,加入裂解液(比例:600~700µL/100 mg)混匀,充分裂解后,转移至离心管,4℃,离心半径8 cm,1500 r/min,离心15 min,-20℃保存。Western blot步骤:制胶,电泳,转膜,封闭,倾去封闭液,加入一抗(1∶600),4℃过夜,将PVDF 膜用PBST 洗4 次,每次10 min,加入二抗(山羊抗小鼠,1∶10 000),摇床上孵育1.5 h 后回收二抗,再将PVDF膜用PBST洗3次,每次10 min。计算机扫描记录结果,采用美国BIO-RAD公司的Quantity One 软件半定量分析检测条带的灰度值。
1.4.3 RT-PCR 法检测胃及肾组织AQP4 mRNA 表达分别取大鼠肺、肾组织100 mg,总RNA 提取按照RNAfast200总RNA极速抽提试剂盒说明书进行,按逆转录试剂盒Prime Script RT Master Mix 说明书进行操作,逆转录成cDNA,以GAPDH为内参扩增AQP4 基因片段,引物序列由生工生物工程股份有限公司合成。按照实时荧光定量PCR 试剂盒说明书配制反应体系,PCR条件为:95℃预变性30 s,95℃变性5 s,60℃退火并延伸30 s,40 个循环。溶解曲线分析产物特异性,参数为95℃变性15 s,60℃退火30 s,95℃延伸15 s。在凝胶成像分析仪上成像,计算AQP4 mRNA和GAPDH mRNA平均吸光度比值。引物序列见表1。

表1 AQP4及GAPDH的引物序列
1.5 统计学方法采用SPSS 19.0 统计软件分析数据,计量资料以±s表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺、肾组织AQP4 表达各组大鼠肺、肾组织AQP4积分光密度表达结果见表2及图1—2。
表2 各组大鼠肺、肾组织AQP4积分光密度表达(±s)
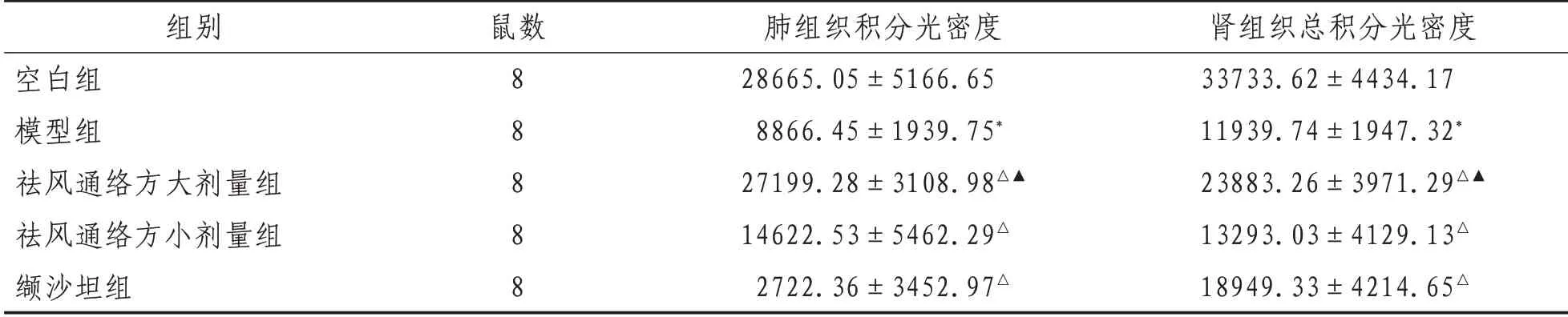
表2 各组大鼠肺、肾组织AQP4积分光密度表达(±s)
注:*表示与空白组比较,P<0.01;△表示与模型组比较,P<0.01;▲表示与祛风通络方小剂量组、缬沙坦组组比较,P<0.05

图1 各组大鼠肺组织AQP4表达(免疫组织化学法,×200)

图2 各组大鼠肾组织AQP4表达(免疫组织化学法,×200)
2.2 大鼠肺、肾组织AQP4 western blot 检测结果各组大鼠肺组织中AQP4蛋白表达结果见表3及图3—4。
2.3 大鼠肺、肾组织AQP4 RT-PCR检测结果各组大鼠肺、肾组织AQP4 RT-PCR含量变化见表4。
表3 各组大鼠肺、肾组织中AQP4蛋白含量的变化(±s)

表3 各组大鼠肺、肾组织中AQP4蛋白含量的变化(±s)
注:*表示与空白组比较,P<0.01;△表示与模型组比较,P<0.01;▲表示与祛风通络方小剂量组、缬沙坦组组比较,P<0.05

图3 各组大鼠肺组织中AQP4蛋白表达Western blot结果

图4 各组大鼠肾组织中AQP4蛋白表达Western blot结果
表4 各组大鼠肺、肾组织AQP4 mRNA含量的变化(±s)

表4 各组大鼠肺、肾组织AQP4 mRNA含量的变化(±s)
注:*表示与空白组比较,P<0.01;△表示与模型组比较,P<0.01;▲表示与祛风通络方小剂量组、缬沙坦组比较,P<0.05
3 讨论
AQP 是一种生物膜通道蛋白,是细胞膜上与水的跨膜转运密切相关的转运蛋白家族,AQP4 是水通道蛋白家族中的一员,其在肾脏主要表达于内髓集合管上皮细胞基底膜及近曲小管上皮的顶质膜内侧囊,在呼吸系统主要表达于气道黏膜上皮及肺泡上皮细胞[3-4]。AQP是机体水液转运和代谢的重要生物学基础[5]。机体的水液代谢依赖于肺气的宣降,肾阳的蒸化和脾的转输,而三焦是水液升降的通道,由于肺居上而肾居下,籍三焦而相互连系共司行水之机,所以有“肺为水之上源,肾为水之下源”之说[6]。水湿既是慢性肾脏疾病的主要致病因素,也是其主要病理产物,故治肾病必当治水湿。祛风通络方是以“肾络空虚,风伏肾络,水湿不化,久则肾络不通”为病机而组成的治疗慢性肾脏疾病的中药复方,该方具有保护肾小球滤过屏障、减轻尿蛋白、抑制系膜细胞增殖、延缓肾小球硬化进展、保护肾功能等作用[7-8]。
本研究结果发现,UUO 模型组AQP4 的表达减少,各治疗组AQP4 表达增加,其中祛风通络方大剂量组增加较明显,且肺、肾组织中AQP4的表达呈一致性,可见祛风通络方可通过调节肺、肾AQP4的表达来改善机体水液代谢功能,从而达到防治慢性肾脏疾病的目的。但是其疗效是否存在剂量及依赖关系,或者在慢性肾脏疾病治疗中是否存在最佳剂量及取得最好的疗效,尚需要进一步研究。AQP4的表达受到多种因素调节,不同组织和病理状态下,其调控方式不尽相同,需要深入研究。

