蛭龙活血通瘀胶囊对家兔颈动脉粥样硬化斑块组织p-NF-κB、NLRP3 表达的影响∗
刘孟楠,罗 钢,刘 平,刘佳利,刘 颜,周 华,杨思进△
1 西南医科大学附属中医医院心血管内科,四川 泸州646000;2 澳门科技大学中医药学院
动脉粥样硬化(atherosclerosis,AS)危害巨大,是诱发冠心病、心肌梗死、脑梗死等疾病的主要原因[1]。血脂代谢紊乱与AS的发生发展关系密切,在动物实验研究、流行病学研究及临床试验中已达到共识[1]。近年来研究报道胆固醇结晶可作为内源性信号分子激活NLRP3 炎症小体,促进炎症因子的成熟与分泌,介导AS早期炎症反应[2],而核转录因子κB(nuclear factor-κB,NF-κB)磷酸化与NLRP3炎症小体的激活关系密切,通过活化NFκB模式识别受体或细胞因子受体可启动NLRP3炎症小体介导的细胞凋亡[3],表明p-NF-κB、NLRP3炎症小体参与了AS的发生和发展。
目前对于AS 及血脂紊乱的治疗重点在于改善低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C),随着他汀类药物的广泛应用,血脂的调理更为科学有效,但AS 的危险性仍然存在[4]。针对AS诱发的冠状动脉粥样硬化性心脏病,杨思进教授研发蛭龙活血通瘀胶囊“补气通络,活血化瘀,化痰祛风”,治疗AS 类疾病中取得了较好效果,为补气、活血、祛风、化痰类中成药改善血脂代谢及防治AS提供了策略[5]。本研究旨在探讨蛭龙活血通瘀胶囊对高脂血症颈动脉粥样硬化家兔血脂的影响及该药物改善颈动脉病变组织p-NF-κB及NLRP3的可能作用机制。
1 材料与方法
1.1 实验动物清洁级新西兰大白兔40 只,雌雄各半,体质量(2.0±0.4)kg,由西南医科大学实验动物中心提供,实验动物许可证号:SYXK(川)2018-065。饲养于西南医科大学动物实验中心,光照每日12 h,室温19~22℃,湿度40~60%饲养。实验方案通过西南医科大学附属中医院动物伦理委员会审查。
1.2 药品与试剂基础饲料由西南医科大学动物实验中心提供,高脂饲料配方(以下均为质量分数):96%的普通饲料、2%的胆固醇、2%的猪油。蛭龙活血通瘀胶囊(西南医科大学附属中医院制剂室提供,批准文号:川药字Z20070528,规格:0.4 g×48 粒/瓶);阿托伐他汀(北京嘉林药业有限公司,国药准字H20093819,规格:20 mg×7片/盒);丽春红、吐温20、丙烯酰胺及BCA 蛋白浓度测定试剂盒、蛋白裂解液(RIPA)购自碧云天生物技术研究所;Tris-Hcl、NaCl 购自生工生物工程股份有限公司;0.45 µm PVDF 膜(Millipore,Schwalbach,Germany)、anti-p-NF-κB(货号:stj28018)购自英国St John′s Laboratory;anti-NF-κB(货 号:arp38197_p050)、anti-NLRP3 antibody(货号:arp63297_p050)购自美国Aviva Systems Biology公司。
1.3 实验仪器BS224 型电子天平(北京塞多利斯仪器系统有限公司);78-1 型磁力搅拌器(常州国华电器有限公司);3K15 型低温高速离心机(Sigma公司);冷冻离心机(HettichMikro 200R);Berthold LB941微孔板式多功能酶标仪(Berthold公司);MINI-PTET 型Western blotting 系统型号;COMP SYS;10 W;1.0 MM、POWERPAC HC POWER SUPPLY、SEMI DRY BLOT APPARATUS(Bio-Rad 公司);Tanon 6600发光成像工作站(Tanon公司)。
1.4 造模方法参考武晓玲等[6]报道的使用高脂饲料加空气干燥术建立颈动脉粥样硬化动物模型。实验动物术前禁食12 h,不禁水,经麻醉、颈部脱毛清洁消毒后,作颈部正中切皮,于甲状软骨上方水平分离左侧颈总动脉,长约2.5 cm。血管两端以动脉夹阻断血流,使用4.5 号头皮针于血管纵轴方向穿刺进入阻断血管两端,用生理盐水冲洗置换出管腔内血液,接流量为250 mL/min 的气流干燥内皮5 min,然后将夹闭的颈动脉内重新充满生理盐水并取下动脉夹使颈动脉恢复血供。湿润棉片轻轻压迫穿刺点2~3 min止血。缝合皮肤创口并包扎。术后肌肉注射庆大霉素预防感染,继续高脂饲料喂养4 周建立兔颈动脉粥样硬化模型。
1.5 分组给药方法家兔用普通饲料适应性喂养1 周,按随机数字表法分为正常组、模型组、蛭龙活血通瘀胶囊组、阿托伐他汀组、蛭龙活血通瘀胶囊+阿托伐他汀组。除正常组继续基础饲料喂养,其余各组均高脂饲料喂养外,手术后继续高脂饲料喂养4 周。单笼喂饲,饮水不限,每日每只进食150 g 饲料。蛭龙活血通瘀胶囊成人用量每日4.8 g,体质量按60 kg 计算,换算为动物高剂量为含生药3.12 g/(kg·d),为成人用量6 倍。阿托伐他汀组0.51 mg/(kg·d),为临床成人用量3 倍。灌胃体积均为4 mL/kg[7]。
1.6 样品采集与血脂测定第4 周末动物禁食不禁水12 h,采用空气注射法处死家兔,股动脉采血。血样室温自然凝固,4℃、离心半径8 cm,3000 r/min 离心10 min,分离血清。采用全自动生化仪检测血清胆固醇(cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)以及LDL-C 水平;沿前期颈部造模处位置做一正中切口,暴露颈总动脉,分离动脉鞘及周边组织,截取造模处颈动脉组织约2 cm备用。
1.7 颈动脉组织总蛋白提取和免疫印迹分析称取颈动脉组织约50 mg,用干净的剪刀将组织块剪碎;加400µL RIPA 裂解液于匀浆器中进行匀浆,离心半径8 cm,12 000 r/min 离心5 min,吸取上清,BCA 定量。SDS-PAGE 电泳分离蛋白,采用湿转方法将蛋白转至PVDF 膜上。5%脱脂奶粉封闭1 h,孵育相应的一抗,4℃过夜,用TBST 洗膜3 次,每次10 min。然后将膜置于封闭袋中,加入适量适当浓度的二抗,封闭袋口,室温下孵育1 h。剪开自封袋,用TBST洗膜3次,每次10 min。等体积混合化学发光试剂A液和B液,将膜蛋白面向下与此混合液充分接触;5 min 后用Tanon 6600 发光成像工作站进行检测,并使用Image Pro Plus 6.0 软件分析光密度值,检测p-NF-κB、NF-κB、NLRP3蛋白质表达水平。
1.8 HE 染色分离1 cm 长的颈动脉组织,经脱水、透明、浸蜡、包埋并制成4 µm 石蜡切片,石蜡切片脱蜡至水,切片入苏木素染液染后,冲洗分化反蓝,经伊红染色后脱水封片。400 倍光镜下观察组织情况。
1.9 统计学方法应用GraphPad Prism 8.0 软件分析数据,计量资料以±s表示,采用单因素方差分析,组间多重比较方差齐采用LSD-t检验,方差不齐采用Dunnett’s T3 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般状况家兔一般状况良好,实验过程中各组家兔未出现厌食、消瘦、明显不能耐受药物等副作用表现及突发的急性死亡。各组家兔体质量呈生理性增长,在第0、2、4 周组间比较差异均无统计学意义(P>0.05)。见表1。
表1 各组家兔不同时间体质量比较(±s) kg
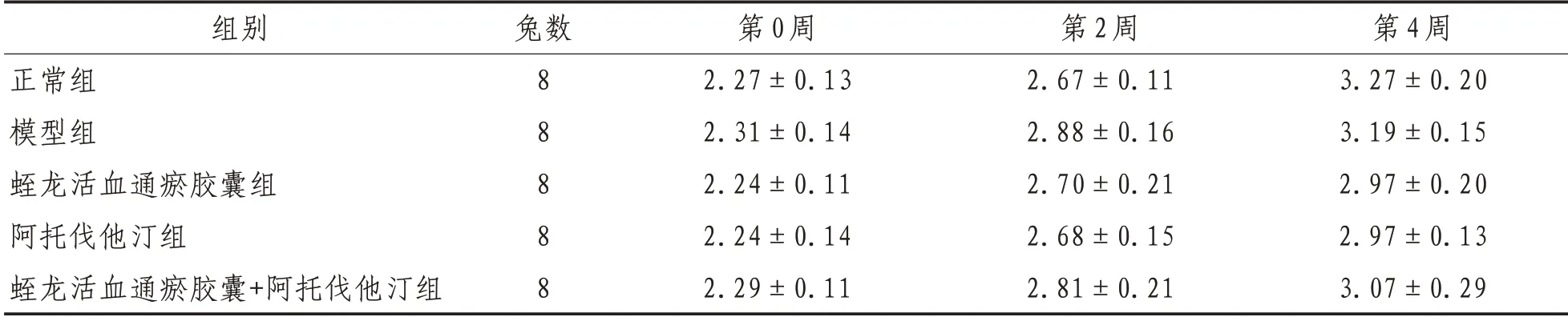
表1 各组家兔不同时间体质量比较(±s) kg
2.2 血脂水平与正常组比较,模型组TC、TG、HDL-C、LDL-C 水平均升高(P<0.01),提示高脂血症模型造模成功;各用药组HDL-C 均有所升高,但组间比较差异无统计学意义(P>0.05);与模型组比较,各给药组TC、TG、LDL-C 水平均不同程度降低,差异具有统计学意义(P<0.05);各给药组TC、TG 水平下降(P<0.01),阿托伐他汀组及蛭龙活血通瘀胶囊+阿托伐他汀组LDL-C降低(P<0.01),蛭龙活血通瘀胶囊可一定程度上降低LDL-C,但差异无统计学意义(P>0.05);与阿托伐他汀组相比,蛭龙活血通瘀胶囊+阿托伐他汀组降低TC的效果更明显(P<0.01),蛭龙活血通瘀胶囊组及蛭龙活血通瘀胶囊+阿托伐他汀降低LDL-C 的作用较阿托伐他汀组更强(P<0.05);各给药组及模型组间HDL-C 比较差异无统计学意义(P>0.05)。见表2。
表2 各组家兔血脂水平比较(±s) mmol/L
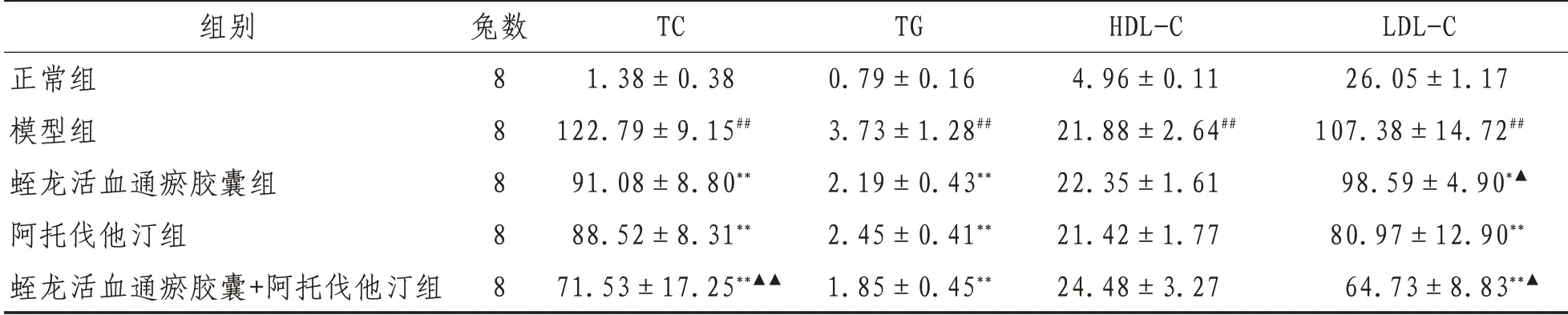
表2 各组家兔血脂水平比较(±s) mmol/L
注:与正常组比较,##表示P<0.01;与模型组比较,**表示P<0.01;*表示P<0.05;与阿托伐他汀组比较,▲▲表示P<0.01,▲表示P<0.05
2.3 颈动脉组织p-NF-κB、NLRP3 蛋白表达与模型组相比,蛭龙活血通瘀胶囊组、阿托伐他汀组和蛭龙活血通瘀胶囊+阿托伐他汀组p-NF-κB、NLRP3水平均下降,差异有统计学意义(P<0.01);与蛭龙活血通瘀胶囊+阿托伐他汀组比较,蛭龙活血通瘀胶囊组p-NF-κB、NLRP3 水平升高,差异有统计学意义(P<0.01),阿托伐他汀组p-NF-κB 水平高于蛭龙活血通瘀胶囊+阿托伐他汀组,差异有统计学意义(P<0.05)。见图1。

图1 颈动脉组织p-NF-κB、NLRP3蛋白表达
2.4 颈动脉形态学改变药物干预4 周后,光镜下正常组家兔颈动脉内皮完整,分界较清晰,内膜光滑,平滑肌细胞完整,排列整齐;模型组颈动脉内大量脂质沉积并有向管腔内凸起的斑块,中膜内层出现断裂,平滑肌细胞显著增生,可见由大量泡沫细胞构成的脂质斑块,斑块内有炎症细胞浸润并有变性坏死;治疗后蛭龙活血通瘀胶囊组,阿托伐他汀组和蛭龙活血通瘀胶囊+阿托伐他汀组炎症细胞减少,内皮细胞增生肿胀并有脂肪细胞浸润,中膜平滑肌细胞肿大增生、排列紊乱颈动脉内膜有粥样斑块沉积,其中蛭龙活血通瘀胶囊+阿托伐他汀组内皮细胞下有脂质沉积,其形态学变化接近于正常组。见图2。
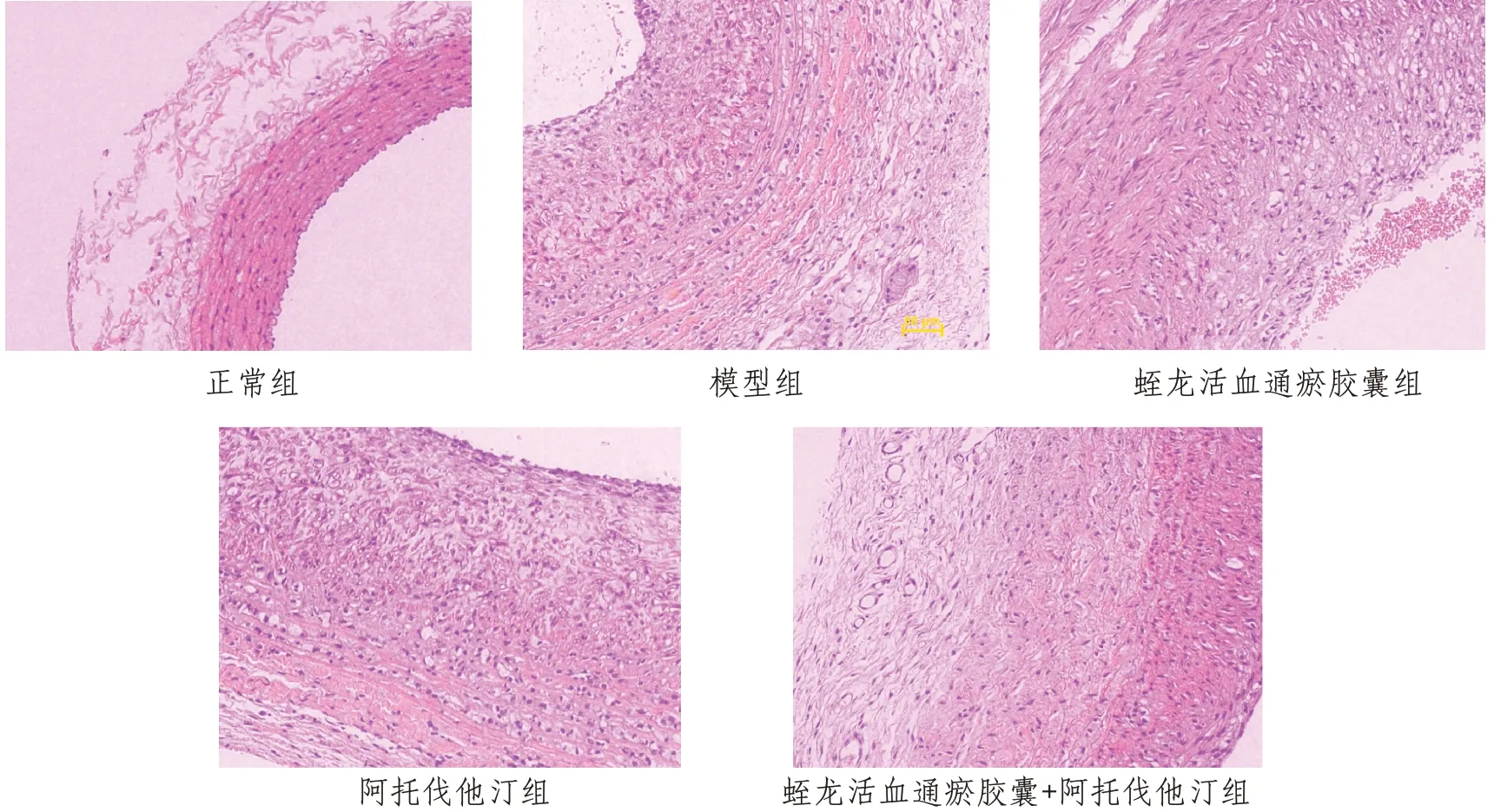
图2 各组家兔颈动脉病理变化(HE,×400)
3 讨论
本研究结果显示,蛭龙活血通瘀胶囊可以降低高脂血症颈动脉粥样硬化家兔TC、TG,降低颈动脉病变组织NF-κB 的磷酸化及NLRP3 蛋白的表达。蛭龙活血通瘀胶囊是杨思进教授在多年临床经验的基础上开发的中药复方制剂,由黄芪、桂枝、大血藤、水蛭、地龙等药组成。该中药复方制剂在治疗脑卒中、冠心病、血栓性疾病等方面临床反馈较好[5-7]。在蛭龙活血通瘀胶囊的前期研究中吴英等[8]证实该药物可降低高脂血症大鼠血脂水平。杨思进等[9]在实验中发现蛭龙活血通瘀胶囊可以降低家兔预动脉NF-κB、ICAM-1 表达,改善高血压颈动脉粥样硬化模型家兔颈动脉AS 病变。前期研究与本研究结果一致,表明蛭龙活血通瘀胶囊抗AS作用确切。
高脂血症被认为是AS 发生的主要危险因素,脂质浸润学说认为基于脂质沉积而形成的斑块是由于血液中脂质水平过高从而渗透至血管内膜造成,且有研究报道AS 的发生与TC 升高呈正相关[4]。AS 形成需要NLRP3 炎性小体的活化参与,胆固醇晶体通过激活NLRP3 炎性小体,促进血管内皮细胞焦亡,进而导致内皮功能障碍诱导AS 的发生[10-11]。NLRP3 炎症小体的活化需要启动和激活双重信号调控,NF-κB 介导了启动过程,磷酸化的NF-κB可上调NLRP3等相关炎性因子前体表达,因此p-NF-κB 为NLRP3 活化提供物质基础[12]。通过抑制p-NF-κB 降低NLRP3 及相关炎性因子前体的表达从而抑制NLRP3炎症小体的激活[13-14]。
本研究采用高脂饲料加空气干燥术建立颈动脉粥样硬化动物模型[9]。该造模方法成熟,成功率高,易于复制,可在较短时间诱发兔颈动脉粥样硬化并形成斑块。阿托伐他汀是目前临床常用的降血脂药物,故本实验将其选为对照药物[15-16]。实验结果显示蛭龙活血通瘀胶囊可以降低高脂血症颈动脉粥样硬化家兔TC、TG,抑制颈动脉病变组织p-NF-κB、NLRP3 表达,可以通过抑制平滑肌细胞增殖、抗血栓及对抗脂质浸润的作用来抑制高脂血症动脉粥样硬化动物模型颈动脉斑块的形成,且蛭龙活血通瘀胶囊与阿托伐他汀联合可提高疗效。因此,蛭龙活血通瘀胶囊发挥抗AS 的作用机制可能是通过改善血脂、抑制NF-κB 的磷酸化及NLRP3 的表达实现,但其确切机制尚待进一步深入研究。

