上肢与下肢人工血管动静脉内瘘通畅率及并发症的比较
张心蓝 赵 霞 胡良柱 孙 浩 刘杨东 傅麒宁
1 重庆医科大学附属第一医院血管外科,重庆 400016 2 重庆医科大学附属第一医院金山医院普外科,重庆 401122 3 深圳大学平湖医院血管外科,广东 深圳 518111
血液透析通路是维持性血液透析患者的“生命线”,对于自身血管条件无法建立合适自体动静脉内瘘的患者,人工血管动静脉内瘘(arteriovenous graft,AVG)是重要的替代方案。肾脏病预后质量倡议(kidney disease outcomes quality initiative,KDOQI)指南建议,在建立血管通路时应优先考虑上肢[1],但随着患者透析年限延长、既往颈部透析导管的滥用,出现上肢血管资源耗竭或中心静脉闭塞的患者增加,下肢AVG成为重要的替代方式。既往有文献指出,下肢AVG有良好的初级和次级通畅率,对于没有可用上肢血管进行手术的患者是一种合适的选择,但存在高感染率和严重的肢体缺血情况[2]。目前缺乏对下肢AVG和上肢AVG在通畅性及并发症方面进行直接对比的研究,故本研究对这一问题进行了初步探讨,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2018年2月于重庆医科大学附属第一医院金山医院建立AVG,且至少有1年随访资料的患者。纳入标准:AVG建立在上肢或下肢;内瘘成功建立后随访至截止时间点。排除标准:AVG建立在胸壁等其他非上、下肢部位;随访信息不全及失访者。根据纳入、排除标准,共纳入127例患者,其中女性74例,男性53例;年龄20~89岁,平均(53.1±13.5)岁。建立上肢AVG 110例为上肢AVG组,流入道:肱动脉104例,近心端桡动脉6例;流出道:贵要静脉61例,腋静脉23例,肘正中静脉11例,肱静脉10例,头静脉4例,颈外静脉 1例。建立下肢AVG 17例为下肢AVG组,流入道:股浅动脉9例,股动脉8例;流出道:大隐静脉近心端13例,股浅静脉3例,股静脉1例。上肢AVG组患者女性比例低于下肢AVG组,术前透析时间短于下肢AVG组,差异均有统计学意义(P<0.05)。两组患者年龄、颈部置管史、吸烟史、饮酒史、基础疾病临床特征比较,差异均无统计学意义(P>0.05)(表1)。
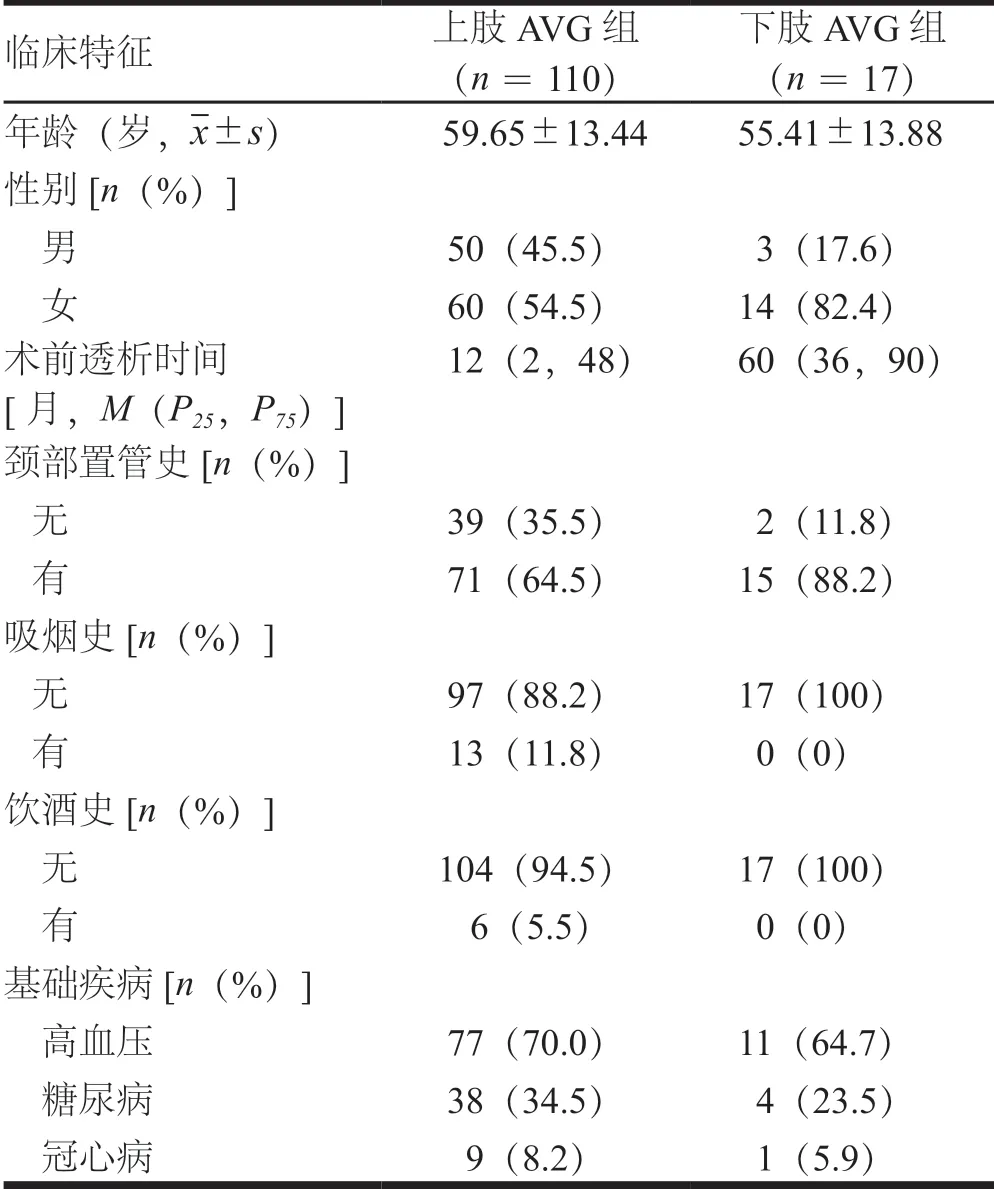
表1 上肢AVG与下肢AVG患者的临床特征
1.2 手术方式
两组患者手术采用局部麻醉或神经阻滞麻醉。根据术前超声评估及术中探查结果,分离显露相应动静脉,根据术前标记用隧道器做皮下隧道,置入人工血管,将人工血管末端适当裁剪后与动、静脉行端侧吻合,并置入皮下引流管。人工血管材料为Gore公司的锥形内支撑环人工血管。
1.3 观察指标
初级通畅率:自AVG成功建立至观察时间点未经任何干预(包括腔内治疗及开放性手术)仍维持AVG通畅患者的比例。次级通畅率:自AVG成功建立至观察时间点维持AVG通畅患者的比例。失功:因各种原因导致内瘘无法使用或移除内瘘。随访截止时间为2020年2月,随访时超声检查提示血管管径小于周围正常血管管径的50%,且伴有内瘘自然血流量<500 ml/min、透析静脉压升高、透析充分性下降时,即为通路通畅欠佳,需进行手术干预。
1.4 统计学方法
应用SPSS 25.0统计学软件进行数据分析,正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验,非正态分布的计量资料以[M(P25,P75)]表示,组间比较采用秩和检验;计数资料以n(%)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 术后并发症及术后干预情况
两组患者共发生血栓事件55次,其中上肢AVG组49次,下肢AVG组6次,首次发生时间分别为术后15.7个月和11.0个月。其中48次血栓事件考虑由狭窄继发,46次(95.83%)采用全腔内介入手段开通,成功率为100%;2次采用切开取栓。余7次血栓事件考虑与各种原因所致的低血压有关,均采用全腔内介入手段开通,成功率为100%。
单纯狭窄事件199次,临床表现均为回流静脉压异常,其中上肢AVG组169次,下肢AVG组30次,首次发生时间分别为术后12.5个月和12.1个月。处理方式均采用球囊扩张,成功率为92.35%,15例采用支架植入作为球囊扩张效果不佳时的补救措施。
在人工血管感染方面,上肢AVG组发生2例,下肢AVG组发生1例,临床表现均为内瘘周围皮肤红肿,皮温升高。上肢AVG组1例发生在术后13.8个月,除上述表现外,穿刺部位皮肤破损,创面可见渗液,考虑为人工血管全程感染,予以人工血管取出,并于对侧肢体建立新AVG;1例发生在术后42.3个月,考虑为局部感染,予以人工血管感染段部分切除及人工血管桥接,后续一直使用该通路透析。下肢AVG组1例发生在术后12.7个月,伴人工血管内血栓形成,穿刺部位可见肿块形成,脓液渗出,予以人工血管取出,并换为带涤纶套导管继续透析。
两组患者均各发生2例假性动脉瘤,上肢AVG组发生在术后5.7个月和10.8个月,下肢AVG组发生在术后14.0个月和26.7个月。其中2例位于动脉穿刺段,1例位于动脉吻合口,1例位于静脉穿刺段,处理方式均为假性动脉瘤切除术。两组患者该并发症发生率比较,差异有统计学意义(P<0.05),但考虑其中3例均与穿刺不当相关,而非上肢与下肢AVG本身差异所致。
两组患者均未发生需要治疗的血液透析通路相关肢体远端缺血、高流量心力衰竭、血肿等其他并发症。围手术期病死率为0%,上肢AVG组中1例患者于术后2.5个月死亡,下肢AVG组随访过程中未出现死亡病例。上肢AVG组腔内介入治疗人均年次数为0.79次,下肢AVG组为0.91次。
2.2 术后通畅率的比较
术后随访时间13.2~46.6个月,平均(24.1±10.4)个月。两组患者术后6、12、18、24个月的初级通畅率及次级通畅率比较,差异均无统计学意义(P>0.05)。(表2、表3)
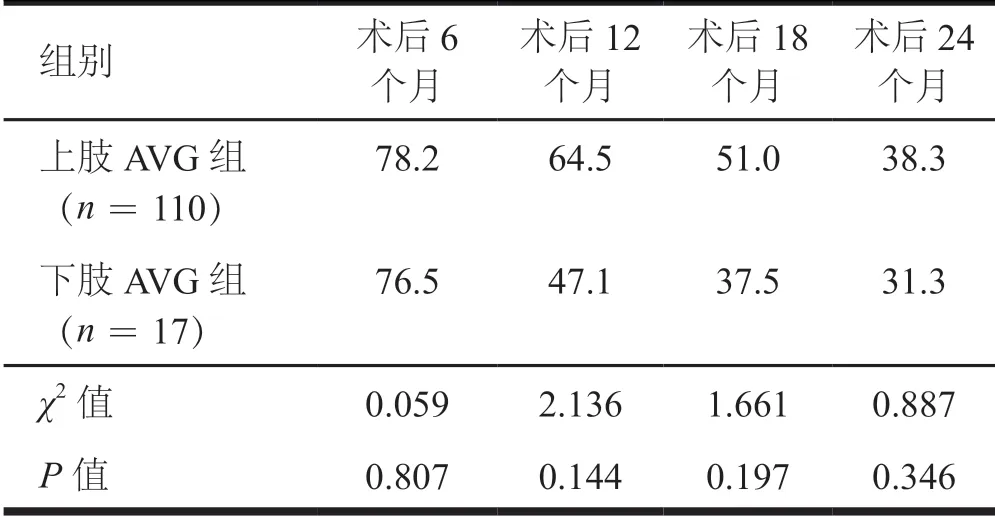
表2 上肢AVG与下肢AVG组患者初级通畅率的比较(%)
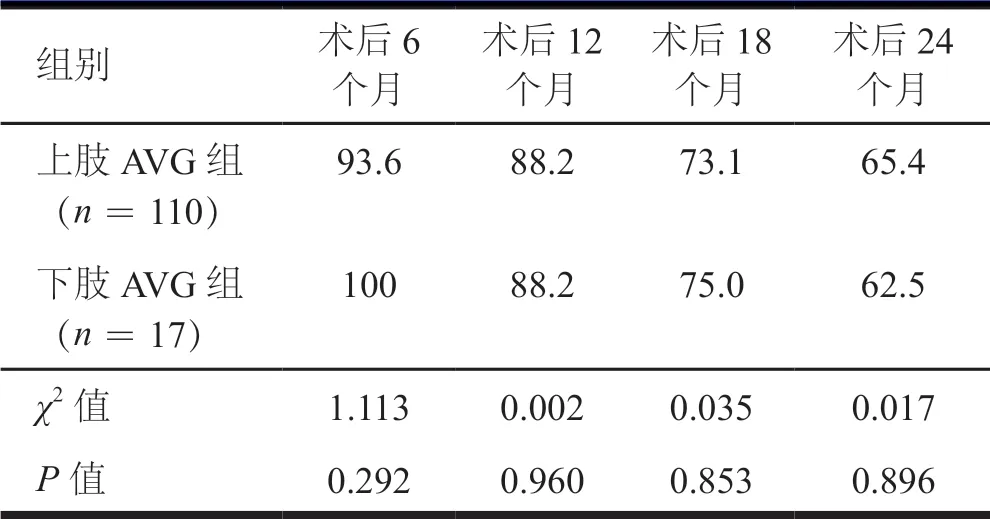
表3 上肢AVG与下肢AVG组患者次级通畅率的比较(%)
3 讨论
血管通路是透析患者的生命线。通常动静脉通路部位选择的基本原则是在血管条件优先的前提下,从非优势侧到优势侧,从上肢到下肢,从远端到近端。但随着透析患者年龄的增长,合并糖尿病及冠心病等基础疾病患者数增加,越来越多上肢血管条件较差或上肢血管资源耗竭的患者需要将AVG建立在下肢。
在近年的研究中,上肢AVG的1年初级通畅率为31.0%~57.9%,1年次级通畅率为37.9%~83.4%[3-6],下肢AVG的1年初级通畅率为38.0%~76.0%,1年次级通畅率为61.0%~95.0%[2,7-9]。在本研究中,上肢AVG与下肢AVG的1年初级通畅率分别为64.5%和47.1%,与既往国外学者报道相似;1年次级通畅率均为88.2%,高于既往研究。两组患者术后6、12、18、24个月的初级通畅率及次级通畅率比较,差异均无统计学意义,这也支持既往观察性研究结果,下肢AVG与上肢AVG的次级通畅性相似[10-11]。
感染是AVG最严重的并发症,可能导致危及生命的脓毒症和血管通路的丧失[12]。在既往的一些研究中,下肢AVG的感染率更高,因感染而失去人工血管透析通路的比例往往高于上肢AVG,此外,与上肢人工血管感染相比,下肢人工血管感染后患者对透析导管的依赖时间更长[10-11,13]。人工血管靠近腹股沟是下肢AVG感染率较高的原因[14]。在一项系列研究中,共920例下肢AVG患者的感染率为22.9%[15]。在Parekh等[16]的一项研究报告指出,下肢AVG的感染率达46%。在本研究中,上肢AVG与下肢AVG感染的发生率均明显低于国外研究,且两组无明显差异,这可能由于本中心术中严格无菌操作、术后放置引流管及术后预防性使用抗生素等避免了AVG感染的发生。
在其他并发症方面,Ram等[11]指出,下肢AVG血栓的发生率低于上肢AVG,这可能与下肢血管直径更大,血流速度更快有关。但下肢AVG仍然存在下肢缺血、总死亡率高的风险[17-18]。下肢AVG对未来肾脏移植的潜力和功能存在影响,有时会因盗血现象或静脉高压而引起同种异体移植肾脏的功能障碍[19-20]。Özdemir-van等[19]报道了1例因大腿AVG引起移植肾功能障碍的病例,并采取人工血管结扎解决这一问题。在术后干预方面,Miller等[10]的一项前瞻性研究中表明,大腿和上肢AVG的血管成形术频率(0.28次/年vs0.57次/年)、血栓切除频率(1.58次/年vs0.94次/年)、手术重建频率(0.28次/年vs0.18次/年)和总干预频率(2.15次/年vs1.70次/年)相似。在本研究中,上肢AVG与下肢AVG患者内瘘狭窄、血栓形成以及后期腔内介入治疗干预次数比较,差异均无统计学意义,这可能与本研究中下肢AVG样本量较少有关,且对患者的长期、按时随访,及时干预也可预防上述并发症的发生。
本研究中,建立下肢AVG的患者术前透析时间明显长于建立上肢AVG的患者。由于中国肾脏病患者普遍缺乏建立动静脉通路的意识,部分患者在开始透析时选择使用中心静脉导管进行透析,长期使用中心静脉导管会引起中心静脉狭窄,从而影响上肢AVG的建立。因此,透析时间较长的患者更常将AVG建立在下肢。
本研究的不足在于下肢AVG样本量较少,研究数据相对不足。且本研究作为单中心、回顾性研究,对手术技术、干预方式的选择可能存在主观偏倚,还需大样本、前瞻性、多中心研究对本文观点进行论证。
综上所述,上肢AVG与下肢AVG具有相似的通畅率及并发症发生率。当上肢无适宜血管或上肢血管资源耗尽时,可选择建立下肢AVG。

