水液相下两性α-丙氨酸Ca(Ⅱ)配合物旋光异构的理论研究
刘 芳,张雪娇,刘 军,闫红彦,姜春旭**,王佐成**
(1. 白城师范学院 物理学院,吉林 白城 137000;2. 白城师范学院 传媒学院,吉林 白城 137000;3. 白城师范学院 计算机学院,吉林 白城 137000)
α-丙氨酸(α-Alanine,α-Ala)是结构最简单的手性氨基酸,是生物体内的重要配体,其手性特征使其金属离子配合物也具有手性. 根据光学活性的不同分为左旋α-丙氨酸(L-α-Ala)和右旋α-丙氨酸(Dα-Ala);根据构型的不同分为S型α-丙氨酸(S-α-Ala)和R型α-丙氨酸(R-α-Ala).L-α-Ala在生命体内具有活性,是蛋白质的重要成分;D-α-Ala可以使氨基酸氧化酶在肿瘤细胞质中异位表达,具有清除细胞毒性和阻止体内脂质氧化损伤的功能,还可促进细菌孢子代谢,但过量的D-α-Ala在生命体内存在则会导致某些疾病的发生和机体衰老[1-4]. 主族金属元素Ca是生命体所必需的宏量元素,在生命体内以正二价态存在. 其在骨骼的形成、协调酸碱平衡、维持心脏规律的跳动等方面具有重要作用,缺乏钙会导致多种生理功能障碍[5-8].
人体吸收食物中的钙的过程是:首先,食物经过胃酸分解生成钙离子,然后在小肠处与小肠分泌出的氨基酸或短肽链发生螯合反应,形成手性氨基酸钙配合物,以配合物的形式被整体吸收[9]. 氨基酸螯合钙作为补钙产品,易吸收且环保,在临床、食品及畜牧业中已经被广泛应用[10]. 不同旋光性的手性分子可能具有截然不同的生物效应,某种旋光性的手性分子对生命体具有生命活性,但其手性对映体则无用甚至有害. 因此,手性氨基酸钙在生命体内消旋的研究对指导人们科学地补钙具有重要意义.
基于手性分子消旋反应的重要性,人们对α-Ala及其金属配合物的旋光异构做了大量的工作.文献[11-12]的理论研究表明,气相环境下α-Ala以中性的形式存在,通常难以消旋. 文献[13-14]的理论研究表明,水溶剂环境下α-Ala主要以两性的形式存在,水分子簇的催化可使其少量地消旋,羟基负离子与质子的存在会进一步加速其消旋反应的进行. 文献[15]的理论研究表明,纳米管的限域对α-Ala旋光异构具有催化作用. 文献[16-23]的理论研究表明,气相环境下两性α-Ala与Cu2+、Ca2+以及Fe2+等金属离子的配合物构象稳定,通常不能消旋,气相下α-丙氨酸盐可以很好地保持它们的手性特征. 文献[24]的理论研究表明,水液相下两性的α-Ala与过渡金属Zn2+和Fe2+的配合物构象稳定,只能痕量地消旋,它们可以安全地用于生命体,实现锌和铁等金属元素与α-丙氨酸同补.
目前,关于水液相下钙与α-丙氨酸配合物的旋光异构研究鲜见报道. 为揭示α-丙氨酸及钙离子在生命体内的代谢过程,说明α-丙氨酸钙长期用于生命体补钙是否安全可靠,基于以往的研究经验[17,24-25],采用密度泛函理论研究了水液相下两性α-丙氨酸与二价钙配合物(S-Ala·Ca2+)的旋光异构.
1 研究与计算方法
采用对处理主族金属及弱相互作用有较高精度的杂化泛函M06-2X[25-26],在6-311+G(d,p)基组下全参数优化单重态(本工作研究的体系在单重态最稳定)势能面上的驻点结构,吉布斯自由能热校正在298.15 K及1.013×105Pa下进行. 红外振动频率分析表明,稳定点无虚频,过渡态有且只有一个虚频. 为了确认过渡态连接期望的极小点,对过渡态[27]进行IRC(内禀反应坐标)计算[28]. 为计算出相对精确的反应过程势能面,兼顾计算成本,在6-311++G(3df, 2pd)基组下计算单点能. 水溶剂效应采用SMD模型[29]方法处理. 总吉布斯自由能是自由能热校正与单点能之和.S-α-Ala与Ca2+的配合物S-α-Ala·Ca2+记作S-A·Ca;S-A·Ca在b通道异构的第2个过渡态配合物记作T2b,第2个中间体配合物记作I2b,a和b通道共用的结构X标记为Xa(b),7个水分子与S-I2c的Ca2+配位同时2聚水与S-I2c氢键作用的体系记作S-I2c←7H2O·(H2O)2,其它体系标记法相似. 计算采用Gaussian16[30]程序.
2 结果与讨论
水液相下α-丙氨酸两性离子最稳定[13],计算表明,水液相下两性α-Ala与Ca2+配合物分子相对于中性α-Ala与Ca2+配合物分子的能量是-27.5 kJ·mol-1,它们之间可以相互异构. 为节省篇幅,只讨论两性α-Ala与Ca2+配合物在水液相环境下的旋光异构.把文献[17]中的气相两性S-α-Ala分子与Ca2+配合物构型作为初始猜测,优化得到水液相下的手性对映体S-A·Ca和R-A·Ca,见图1.
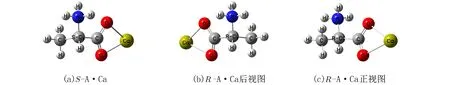
图1 配合物S-A·Ca分子及其手性对映体的几何构型Fig. 1 Geometric configuration of complex S-A·Ca and chiral enantiomer
水溶剂效应有隐性和显性水溶剂效应两种情况. 对于非氢迁移反应,水分子的作用对反应能垒影响不大,只需考虑溶剂的极性作用,即隐性水溶剂效应;对于H迁移反应,既要考虑溶剂极性的作用,还要考虑水分子(簇)做H迁移媒介以及水分子与Ca2+的配位.
研究发现,S-A·Ca可在3个通道a、b和c实现旋光异构. 为了清晰地呈现水液相下S-A·Ca旋光异构机理,并且尽可能地节省篇幅,首先详细讨论隐性水溶剂效应下S-A·Ca的旋光异构,然后再讨论显性水溶剂效应下S-A·Ca旋光异构反应的决速步骤.
2.1 隐性水溶剂效应下S-A·Ca的旋光异构a和b通道共用第1基元,为使讨论层次清晰,将a和b通道放在一起讨论,c通道单独讨论.
2.1.1S-A·Ca在a和b通道上的旋光异构 a、b通道共用的第一基元是α-氢向羰基氧迁移,而后分为质子从质子化氨基向α-碳迁移的a通道和质子从羰基氧向α-碳迁移的b通道,反应历程见图2,反应过程的势能剖面见图3的a线和b线.
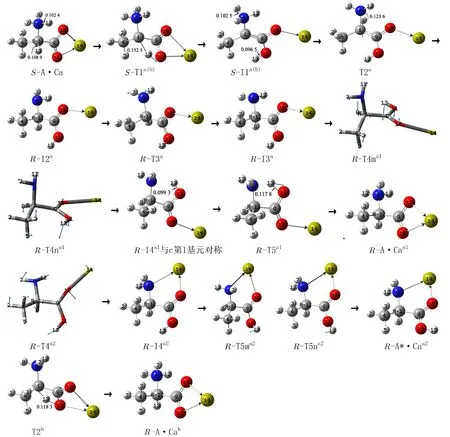
图2 S-A·Ca在a和b通道旋光异构的历程(键长单位:nm).Fig. 2 Reaction process of optical isomerism of S-A·Ca in channel a and b (Bond length unit: nm)
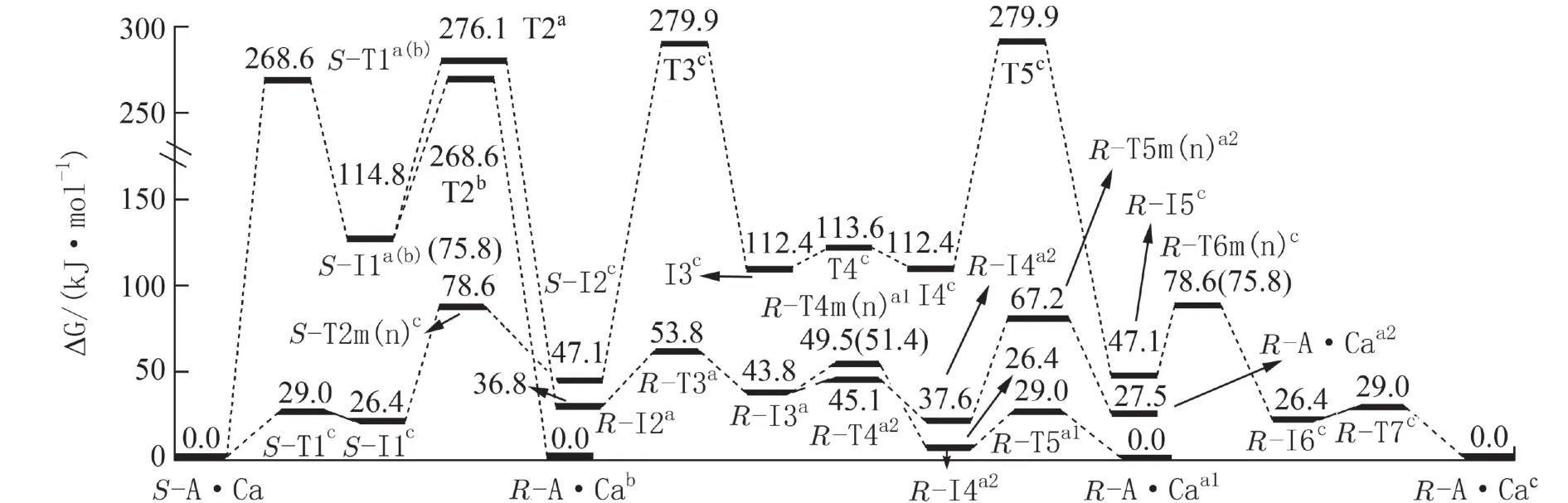
图3 隐性溶剂效应下S-A·Ca旋光异构反应的吉布斯自由能势能面(298.15 K)Fig. 3 Gibbs free energy surfaces of optical isomerism of S-A·Ca under the effect of recessive solvent (298.15 K)
第1基元反应.S-A·Ca经质子在α-碳1C和羰基氧11O间迁移的过渡态T1a(b),α-氢13H沿过渡态虚频振动矢量的正向从1C迁移到11O,异构成中间体I1a(b). 从S-A·Ca到T1a(b)过程,1C―13H键长从0.108 9 nm拉伸至0.152 5 nm断裂;二面角6N―1C―4C―9C从120.1°变为122.2°,骨架微小形变2.1°;二面角11O―9C―1C―6N从171.0°变为144.4°,9C―1C键右视顺时针内旋转26.6°. 这些变化导致T1a(b)产生了268.6 kJ·mol-1的内禀能垒. 该能垒与气相S-A·Ca旋光异构此基元反应的内禀能垒283.3 kJ·mol-1[19]相比较略有降低,说明水溶剂对此基元反应有较弱的催化作用,原因是SA·Ca的偶极矩(10.602 4 D)小于T1a(b)的偶极矩(14.416 9 D),极性水溶剂的作用使T1a(b)变得相对稳定.
接下来分析a和b两个分通道.
(1)a分通道第2基元反应. I1a(b)经质子在6N和1C间迁移的过渡态T2a,8H沿过渡态虚频振动矢量的正向在纸面内侧从6N迁移到1C,异构成中间体R-I2a,S-A·Ca在a通道实现旋光异构. 从I1a(b)到T2a过程,6N―8H键长从0.102 5 nm拉伸至0.123 6 nm断裂,需要较多的能量. 但二面角6N―1C―4C―9C从179.3°变为-150.8°,1C从sp2杂化向sp3杂化(从空配向满配)过渡会释放一些能量,氮氢键又较碳氢键容易断裂,T2a产生了161.3 kJ·mol-1的内禀能垒,远小于T1a(b)产生的内禀能垒.
第3基元反应.R-I2a经7H和12H左右翻转的过渡态R-T3a,7H和12H沿过渡态虚频振动矢量的正向从右侧翻转到左侧偏里的位置,异构成中间体R-I3a. 这为9C―1C键的内旋转以及14Ca从羧基内侧向外侧翻转创造了空间条件(减小了空间位阻).
接下来R-I3a的异构分为a1和a2两个分路径,分别得到两性和中性的R-型丙氨酸与Ca2+配合物.
(i)a1分路径. 第4基元反应.R-I3a经9C―1C内旋转的过渡态R-T4ma1或R-T4na1,9C―1C右视逆时针(R-T4ma1虚频振动矢量的负向)或顺时针旋转(R-T3na1虚频振动矢量的负向),异构成中间体R-I4a1. 从R-I3a到R-T4ma1,二面角10O―9C―1C―6N从11.9°变为80.9°,9C―1C键内旋转70.0°,化学键内旋转所需能量很少,R-T4ma1产生的内禀能垒是5.7 kJ·mol-1. 相似的R-T4na1产生的内禀能垒是7.6 kJ·mol-1.
第5基元反应.R-I4a1经质子在11O和6N之间迁移的过渡态R-T5a1,13H从11O迁移到6N,异构成两性丙氨酸与二价钙的配合物R-A·Caa1.RA·Caa1与S-A·Ca镜像对称,S-A·Ca在a1分通道完成了旋光异构,实现了手性对映体转变. 从R-I4a1到R-T5a1,11O―13H从0.099 3 nm拉伸至0.117 8 nm断裂,拉伸幅度很小,13H逆着体系偶极矩的方向运动,体系的电场力对13H的迁移做正功,所以RT5a1产生的内禀能垒很小,只有2.6 kJ·mol-1.RI4a1经R-T5a1向R-A·Caa1的异构可视为无势垒过程.
(ii)a2分路径. 第4基元反应.R-I3a经14Ca在羧基内外翻转的过渡态R-T4a2,14Ca沿过渡态矢量的正向从羧基内侧翻到羧基外侧,异构成中间体R-I4a2. 从R-I3a到R-T4a2过程,键角9C―10O―14Ca从122.2°变为167.5°,R-T4a2产生的内禀能垒只有1.3 kJ·mol-1,此基元反应可视为无势垒反应.
第5基元反应.R-I4a2经11O―9C内旋转的过渡态R-T5ma2或R-T5na2,11O―9C仰视顺时针或逆时针旋转,13H从羧基外侧转到内侧,异构成中性丙氨酸与二价钙产物配合物R-A*·Caa2. 从R-I4a到R-T5ma2过程,11O―9C内旋转91.7°,R-T5ma2产生的内禀能垒是29.6 kJ·mol-1. 相似的R-T5na2产生的内禀能垒也是29.6 kJ·mol-1.
(2)b分通道I1a(b)经质子在11O和1C间迁移的过渡态T2b,13H在纸面内侧沿过渡态矢量的正向从11O迁移到1C,异构成产物配合物RA·Cab,S-A·Ca实现旋光异构. 结构分析表明,RA·Cab与S-A·Ca镜像对称,S-A·Ca在此通道实现了手性对映体转变. 从I1a(b)到T2b过程,11O―13H键从0.096 5 nm拉伸至0.118 4 nm断裂,T2b产生的内禀能垒是153.8 kJ·mol-1. T2b与T1a(b)镜像对称,但T2b产生的能垒小于T1a(b)产生的能垒,原因之一是氧氢键较碳氢键容易断裂,原因之二是从I1a(b)到T2b过程,α-碳从sp2杂化向sp3杂化(从空配向满配)过渡释放能量,降低了T2b的能垒.
从S-A·Ca在b通道的反应历程及势能面可以看出,体系构象及相对能量均关于I1a(b)对称,展现了S-A·Ca在b通道旋光异构的对称美.
2.1.2S-A·Ca在c通道上的旋光异构 c通道是质子从质子化氨基迁移到羰基氧后,α-氢再以氨基氮为桥迁移,反应历程见图4,反应过程的吉布斯自由能势能面见图3的c线.
第1基元反应.S-A·Ca经质子在6N―10O间迁移的过渡态S-T1c,12H沿过渡态矢量的负向从6N迁移到10O,异构成中性丙氨酸与钙的配合物中间体S-I1c. 从S-A·Ca到S-T1c过程,6N―12H键从0.102 4 nm拉 伸 至0.133 9 nm断 裂,S-T1c产 生 了29.0 kJ·mol-1的内禀能垒. 结构分析表明,该基元反应与a1路径第5基元镜像对称,然而S-T1c产生的内禀能垒远大于R-T5a1产生的内禀能垒. 原因是从S-A·Ca到S-T1c过程,12H是顺着体系偶极矩的方向运动,体系的电场力对12H的迁移做负功,还需要提供额外的能量抵抗电场力做功.

图4 S-A·Ca在c通道旋光异构的历程(键长单位:nm).Fig. 4 Reaction process of optical isomerism of S-A·Ca in channel c (Bond length unit: nm)
第2基元反应.S-I1c经10O-9C内旋转的过渡态S-T2mc或S-T2nc,12H俯视逆时针(或顺时针)旋转,从羧基外侧转到内侧,异构成中间体S-I2c.SI2c的氨基氮正面裸露,电子云密度大,为α-氢从1C向其迁移创造了条件. 从S-I1c到S-T2mc,10O―9C内旋转89.3°,S-T2mc产生的内禀能垒是52.2 kJ·mol-1,相似的S-T2nc产生的内禀能垒是49.4 kJ·mol-1. 化学键内旋转所需能量不多,但ST2mc和S-T2nc产生了较高的能垒,原因是此基元反应的12H是顺着体系偶极矩的方向运动,体系的电场力会阻碍12H从羧基外侧向内侧旋转.
第3基元反应.S-I2c经质子在1C和6N间迁移的过渡态T3c,13H在纸面外侧从1C迁移到6N,异构成中间体I3c. 从S-I2c到T3c过程,1C―13H键从0.109 3 nm拉伸至0.130 0 nm 断裂,骨架二面角6N―1C―4C―9C从125.9°变为154.8°,这些变化使T3c产生了232.8 kJ·mol-1的内禀能垒.
第4基元反应. I3c经过渡态T4c,14Ca从纸面内翻转到纸面外(右侧视图是从右侧翻转到左侧),12H从纸面外翻转到纸面内(右侧视图是从左侧翻转到右侧),异构成与I3c镜像对称的中间体I4c.从I3c到T4c,2个二面角小角度的翻转所需能量很小,T4c产生的内禀能垒仅有1.2 kJ·mol-1(此基元正负反应能垒相同),此基元正负反应均可视为无势垒过程,I3c和I4c可以无阻碍地相互转变.
第5基元反应. I4c经过渡态T5c,7H从6N迁移到1C,异构成中间体R-I5c. 从I4c到T5c,6N―7H键从0.102 6 nm拉伸至0.123 4 nm 断裂,T5c产生了167.5 kJ·mol-1的内禀能垒. 该能垒远小于T3c产生的内禀能垒,原因之一是氮氢键较碳氢键易断裂,原因之二是从I4c到T5c,6N―1C―4C―9C从-179.2°变为-154.8°,α-碳从sp2杂化向sp3杂化过渡要释放一些能量,降低了越过T5c所需的能量.
第6基元反应.R-I5c经10O―9C内旋转的过渡态R-T6mc(或R-T6nc),实现了12H从羧基内侧向外侧旋转,异构成中间体R-I6c. 从R-I5c到R-T6mc(或R-T6nc),10O―9C俯视顺时针转内旋转90.2°(或俯视逆时针转内旋转88.0°),所需能量较少,RT6mc和R-T6nc产生的能垒分别是31.5 kJ·mol-1和28.8 kJ·mol-1. 此基元与第2基元镜像对称,但此基元的能垒低于第2基元反应的能垒,原因是此基元反应的12H是逆着体系偶极矩的方向运动,体系的电场力会助力12H从羧基内侧向外侧旋转.
结构分析表明,R-I6c全同于R-I4a1,其接下来的异构同于R-I4a1的异构,得到的旋光异构产物RAc(a1)与S-A·Ca镜像对称,见2.1.1节a1路径的讨论,不再赘述.
S-A·Ca在c通道的旋光异构历程及势能面显示,体系构象及相对能量均关于T5c对称,展现了SA·Ca在c通道旋光异构的过程与内在的对称美.
从图3可以看出,S-A·Ca在c通道的旋光异构具有优势,反应决速步能垒是232.8 kJ·mol-1(来自于过渡态T3c),低于气相环境下两性S-Ala与Ca2+配合物旋光异构的能垒283.3 kJ·mol-1[17],说明水溶剂效应对S-A·Ca的旋光异构具有一定的催化作用.S-A·Ca在a和b通道的旋光异构反应处于劣势,这2个通道具有共同的决速步骤,内禀能垒是268.6 kJ·mol-1(均来自于过渡态T1a(b)). 232.8 kJ·mol-1已经远高于化学反应的极限能垒160.0 kJ·mol-1[30],说明隐性水溶剂效应作用下S-A·Ca不能消旋.
2.2 水分子(簇)对S-A·Ca旋光异构反应决速步骤的作用为获得可靠的决速步骤的反应能垒,既考虑水分子簇对质子迁移反应的影响,同时考虑水分子簇与钙离子的配位作用. 计算表明,2个水分子簇和3个水分子簇的催化作用差别较小,1个水分子的催化作用远小于2个和3个水分子簇. 因此,为使问题简便并节省篇幅,做氢迁移媒介的水分子簇只考虑2个水分子簇的情况,与钙离子的配位只考虑水分子的情况.
2.2.1 水分子(簇)对a和b通道决速步骤的影响S-A·Ca在a和b通道旋光异构的决速步骤是第一基元. 水分子(簇)与底物S-A·Ca的作用有2种,一是水分子与Ca2+形成配位键,二是2个水分子簇与S-A·Ca的13H及11O形成氢键. 水分子优先与Ca2+形成配位键,配位饱和后,水簇再与SA·Ca氢键作用. Ca2+的配位数是6至8,S-A·Ca的Ca2+与羰基O已经是2配位. 为节省篇幅,并使讨论的结果不失一般性,考虑Ca2+再与4个和6个水分子配位,形成S-A·Ca←4H2O和S-A·Ca←6H2O. 2个水分子簇再与它们的13H和11O氢键作用,同时与S-A·Ca←4H2O和S-A·Ca←6H2O的水分子形成氢键网络,记作S-A·Ca←4H2O·(H2O)2和S-A·Ca←6H2O·(H2O)2. 2个水分子簇传递13H从1C向11O迁移的历程见图5,反应过程势能面见图6的a(b)线. 详细讨论S-A·Ca←6H2O·(H2O)2的异构,对S-A·Ca←4H2O·(H2O)2的异构只给出反应能垒.
S-A·Ca←6H2O·(H2O)2经 过 渡 态S-T1a(b)←6H2O·(H2O)2,水分子之间的氢键网络不同程度地破裂、3个质子13H、35H和37H迁移及骨架形变协同进行,实现了质子从1C向11O的净迁移,异构成中间体I1a(b)←6H2O·(H2O)2. 从S-T1a(b)←6H2O·(H2O)2的IRC可看出,S-T1a(b)←6H2O·(H2O)2靠近产物,是晚期过渡态. 从S-A·Ca←6H2O·(H2O)2到T1a(b)←6H2O·(H2O)2,1C―13H键 长 从0.109 3 nm拉伸至0.135 2 nm断裂;33O―35H键长从0.097 2 nm拉伸断裂,35H迁移到36O;36O―37H键长从0.097 6 nm拉伸断裂,37H迁移到11O;骨架二面角6N―1C―4C―9C从123.2°变为125.3°,骨架形变较小;结构分析表明,水分子37H―36O―38H与水分子25H―24O―26H及17H―15O―16H之间的氢键作用被削弱. 这些变化使T1a(b)←6H2O·(H2O)2产生了141.3 kJ·mol-1的内禀能垒. 相似地从S-A·Ca←4H2O·(H2O)2经T1a(b)←4H2O·(H2O)2到I1a(b)←4H2O·(H2O)2,T1a(b)←4H2O·(H2O)2产生的内禀能垒是145.0 kJ·mol-1.
在误差允许的范围内,可认为T1a(b)←4H2O·(H2O)2和T1a(b)←6H2O·(H2O)2产生的能垒相同,该能垒远远小于T1a(b)产生的内禀能垒268.6 kJ·mol-1,说明水分子(簇)对a和b通道旋光异构反应的决速步起了极好的催化作用. 原因之一是过渡态T1a(b)←4H2O·(H2O)2和T1a(b)←6H2O·(H2O)2的 八元环结构的3条氢键的键角接近平角,氢键较强,导 致T1a(b)←4H2O·(H2O)2和T1a(b)←6H2O·(H2O)2的稳定性较好;原因之二是水分子(簇)的作用显著地减小了反应物复合物到过渡态复合物的骨架形变.
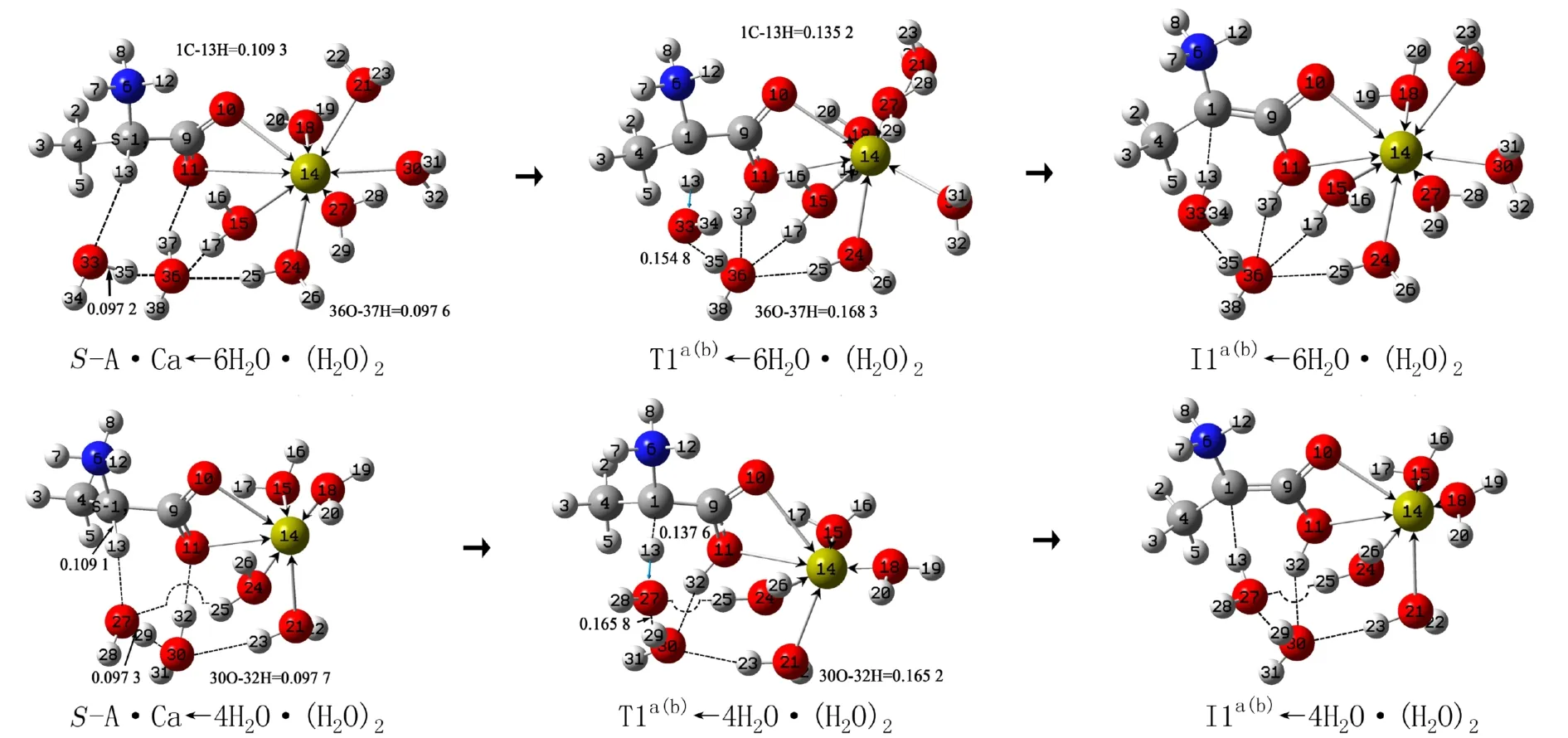
图5 水分子(簇)作用下S-A·Ca在a和b通道旋光异构反应决速步骤的历程(键长单位:nm)Fig. 5 The rate-determining step process of S-A·Ca optical isomerism reaction in channel a and b under the action of water molecules (clusters) (Bond length unit: nm)

图6 水分子(簇)作用下S-A·Ca旋光异构反应决速步骤的吉布斯自由能势能面(298.15 K)Fig. 6 Gibbs free energy surfaces of the rate-determining step of S-A·Ca optical isomerism reaction under the action of water molecules (clusters) (298.15 K)
2.2.2 水分子(簇)对c通道决速步骤的影响SA·Ca在c通道旋光异构决速步骤是第3基元反应.相似于前面的讨论,为节省篇幅,只考虑14Ca八配位和六配位的情况,亦即考虑7个和5个水分子与14Ca配位,2个水分子簇传递质子从1C向6N迁移的情况. 历程见图7,反应过程的势能面见图6的c线. 对前者详细讨论,后者只给出结果.
对于7个水分子与14Ca配位的情形,首先SI2c的14Ca与7个水分子配位(14Ca已与1个O配位),配位饱和,形成S-I3c←7H2O. 然后2个水分子簇再与6N和13H氢键作用,形成中间体反应物配合物S-I2c←7H2O·(H2O)2.S-I2c←7H2O·(H2O)2经过渡态T3c←7H2O·(H2O)2,3个质子13H、32H和34H协同非同步迁移,实现了质子从1C向6N的净迁移,异构成中间体产物配合物I3c←7H2O·(H2O)2. 从T3c←7H2O·(H2O)2的IRC路径可以看出,T3c←7H2O·(H2O)2靠近反应物,是早期过渡态. 从S-I2c←7H2O·(H2O)2到T3c←7H2O·(H2O)2过 程,1C―13H键从0.109 2 nm拉伸至0.162 4 nm断裂,30O―32H键从0.097 6 nm拉伸至0.105 3 nm断裂,33O―34H键长从0.098 8 nm拉伸至0.107 7 nm;骨架二面角6N―1C―2C―10C从125.6°变为162.7°.这些变化使T3c←7H2O·(H2O)2产生了161.0 kJ·mol-1的 内 禀 能 垒. 相 似 的 从S-I2c←5H2O·(H2O)2经T3c←5H2O·(H2O)2到I3c←5H2O·(H2O)2过程,T3c←5H2O·(H2O)2产生了153.1 kJ·mol-1的内禀能垒.
在误差允许的范围内,可认为T3c←7H2O·(H2O)2和T3c←5H2O·(H2O)2产生的能垒相同,该能垒与前面隐性溶剂效应下此基元反应T3c产生的能垒232.8 kJ·mol-1相比较显著降低,说明水分子簇对此基元反应起了极好的催化作用,原因相似于2.2.1的讨论,这里从略. T3c←7H2O·(H2O)2和T3c←5H2O·(H2O)2产生的能垒与水液相下丙氨酸旋光异构过程此基元反应(决速步骤)的内禀能垒(约110.0 kJ·mol-1[14])相比较显著增加,说明Ca2+的配位对此基元反应有负催化作用.

图7 水分子(簇)作用下S-A·Ca在c通道旋光异构决速步骤的反应历程(键长单位:nm)Fig. 7 The reaction process of the rate-determining step of S-A·Ca optical isomerism in channel c under the action of water molecules (clusters) (Bond length unit: nm)
从图6可以得到,水液相下的水分子(簇)作用改变了S-A·Ca旋光异构反应通道的优劣顺序,水分子(簇)作用下,S-A·Ca在a和b通道上的旋光异构具有优势,决速步骤的吉布斯自由能垒在141.3~145.0 kJ·mol-1之间,在c通道上的旋光异构处于劣势,决速步骤的吉布斯自由能垒在153.0~161.0 kJ·mol-1之间. 141.3 kJ·mol-1比 较接近 化 学反应的极限能垒160.0 kJ·mol-1[31],远高于温和反应能垒80.0 kJ·mol-1[31],说明通常水液相下S-A·Ca的旋光异构反应进行得极其缓慢. 因此在生命体内α-丙氨酸的二价钙盐只能微量地或少量地消旋,可安全地用于生命体补充Ca2+和丙氨酸.
3 结论
在SMD/ M06-2X/6-311++G(3df, 2pd)//SMD/M06-2X/6-311+G(d, p)双水平,研究了水液相下两性S-α-Ala(丙氨酸)与Ca2+配合物S-α-Ala·Ca2+的旋光异构,得到如下结论:
(1)S-α-Ala·Ca2+的旋光异构反应可在质子分别以羰基氧和氨基氮为桥迁移、质子只以羰基氧为桥迁移和质子以氨基氮为桥迁移的3个通道a、b、c实现. 产物有2种,分别是两性R-α-Ala和中性Rα-Ala与Ca2+的配合物.
(2)S-α-Ala·Ca2+在c通道的旋光异构具有优势,决速步骤能垒是232.8 kJ·mol-1,来自于质子从α-C向氨基N迁移的过渡态;a和b通道处于劣势,决速步骤能垒是297.1 kJ·mol-1,来自于质子从α-C向羰基O迁移的过渡态;
(3) 水分子(簇)作用改变了S-α-Ala·Ca2+旋光异构反应通道的优劣顺序,a和b变为优势通道,决速步骤能垒在141.3~145.0 kJ·mol-1之间,c变为劣势通道,决速步骤能垒在153.0~161.0 kJ·mol-1之间.
结果表明, 水液相下α-丙氨酸钙的旋光异构反应进行得很缓慢,在生命体内α-丙氨酸的二价钙盐只能微量地消旋,可安全地用于生命体补充Ca2+和丙氨酸.

