产虾青素红法夫酵母的发酵工艺优化
江文涛,彭立影,马加军,张 超,赵春花
(广州金水动物保健品有限公司,广州 510545)
虾青素(Astaxanthin,3, 3’-二羟基-4, 4’-二酮-β,β’-胡萝卜素)是一种具有抗氧化、抗癌、增强免疫力等功能的类胡萝卜素[1],在食品、养殖行业及化妆品、医疗保健领域都有广泛的应用[2]。目前,虾青素主要采用化学合成法、动植物提取法和微生物发酵法生产,生物源虾青素具有利用率高、活性高等优点[3]。
红法夫酵母发酵法生产虾青素具有生长速度快、发酵周期短等优点,但也存在虾青素代谢产量低的缺陷[4-7],国内有较多科研人员致力于提高红法夫酵母菌虾青素产量的研究,一般通过优化培养基的配方、诱变选育高产菌株等方式提高虾青素的产量。本试验以红法夫酵母菌Yea.pr-17为研究对象,以常规的酵母发酵培养基作为对照,优化出更适宜红法夫酵母产虾青素的培养基及培养条件,以期提高虾青素产量,为虾青素规模化生产提供依据。
1 材料
1.1 菌株
红法夫酵母Yea.Pr-17,自主筛选保存。
1.2 培养基
种子活化培养基:采用YM培养基,500 mL三角瓶中装入YM培养基100 mL,115 ℃灭菌30 min,备用。
基础发酵培养基:采用YM培养基,500 mL三角瓶中装入YM培养基100 mL,115 ℃灭菌30 min,备用。
固体划线培养基:采用YM固体培养基,琼脂量为1.6%。
1.3 仪器
紫外可见光光度计(型号为752G),上海奇立科学仪器有限公司产品;微量台式高速离心机(型号为TG16-W),湖南湘仪实验室仪器开发有限公司产品;数显恒温水浴锅(型号为HH-4),常州澳华仪器有限公司产品;pH计(型号为PHS-3C),上海悦丰仪器仪表有限公司产品。
2 方 法
2.1 培养
2.1.1 种子培养
取红法夫酵母菌种划线于固体划线培养基,置于(20±1)℃培养箱恒温培养2 d。挑取活化的单菌落2~3 环接种于装有100 mL 种子活化培养基的500 mL三角瓶中,(20±1)℃、180 r·min-1培养2 d。
2.1.2 发酵培养
将活化好的菌种按照5.0%的接种量接种到发酵培养基中,于(20±1)℃摇床200 r·min-1振荡培养6 d,测定虾青素产量。
2.2 指标测定
菌液浓度测定采用紫外可见光分光光度法;pH值用PHS-3C型pH计测定;虾青素含量按照《饲料添加剂10%虾青素》(GB/T 23745—2009)中的方法进行测定;残糖采用DNS法测定。
2.3 试验内容
2.3.1 培养基的选择
根据酵母菌的营养特性设计14 组培养基,见表1,将活化好的菌种按照5.0%的接种量接种到发酵培养基中,于(20±1)℃摇床180 r·min-1振荡培养6 d,测定虾青素产量。

表1 培养基配方
2.3.2 接种量对红法夫酵母发酵产虾青素的影响
以优选的发酵培养基为基础,按1.0%、2.0%、4.0%、6.0%、8.0%接种量接种红法夫酵母,于(20±1)℃摇床180 r·min-1振荡培养6 d,测定其菌液OD660值和虾青素含量。
2.3.3 发酵时间对红法夫酵母发酵产虾青素的影响
以优选的发酵培养基为基础,于(20±1)℃摇床180 r·min-1振荡培养 7 d,测定其菌液 OD660值和虾青素含量。
2.3.4 补充不同碳源对红法夫酵母发酵产虾青素的影响
以优选的发酵培养基为基础,在48 h 时分别补料10.0 g·L-1的葡萄糖、蔗糖和乳糖,(20±1)℃摇床180 r·min-1振荡培养,测定其菌液OD660值和虾青素含量。
2.3.5 补充不同氮源对红法夫酵母发酵产虾青素的影响
以优选的发酵培养基为基础,在48 h 时分别补料1.0 g·L-1的蛋白胨、酵母浸粉和硫酸铵,于(20±1)℃摇床180 r·min-1振荡培养,测定其菌液OD660值和虾青素含量。
2.3.6 不同促进剂对红法夫酵母发酵产虾青素的影响
以优选的发酵培养基为基础,在48 h 时分别添加5.0 g·L-1的番茄红、淀粉及碳酸钙等促进剂,于(20±1)℃摇床180 r·min-1振荡培养,测定其菌液OD660值和虾青素含量。
2.3.7 补料方式对红法夫酵母发酵产虾青素的影响
以优选的发酵培养基为基础,设定4种葡萄糖补料方式,A 组:培养 24 h、38 h、48 h、62 h 分别流加500 g·L-1葡萄糖3 mL、2 mL、2 mL、2 mL;B组:培养24 h、38 h、48 h、62 h分别流加500 g·L-1葡萄糖2 mL、2 mL、2 mL、2 mL;C组:培养24 h、38 h、48 h、62 h 分别流加500 g·L-1葡萄糖 1 mL、1 mL、2 mL、2 mL;以未添加葡萄糖为空白组。按4%接种量接种红法夫酵母,于(20±1)℃摇床180 r·min-1n振荡培养,于24 h、48 h、60 h、84 h、108 h、132 h、204 h、240 h 测定其菌液OD660值和虾青素含量。
3 结果与分析
3.1 培养基的选择
14 种不同培养基对红法夫酵母产虾青素的影响结果见图1。
由图1可知,培养基2、3和7组虾青素产量均高于42.0 mg·L-1。其中培养基3配方成本低,且虾青素产量最高。因此,选择培养基3为基础培养基进行下一步优化试验。
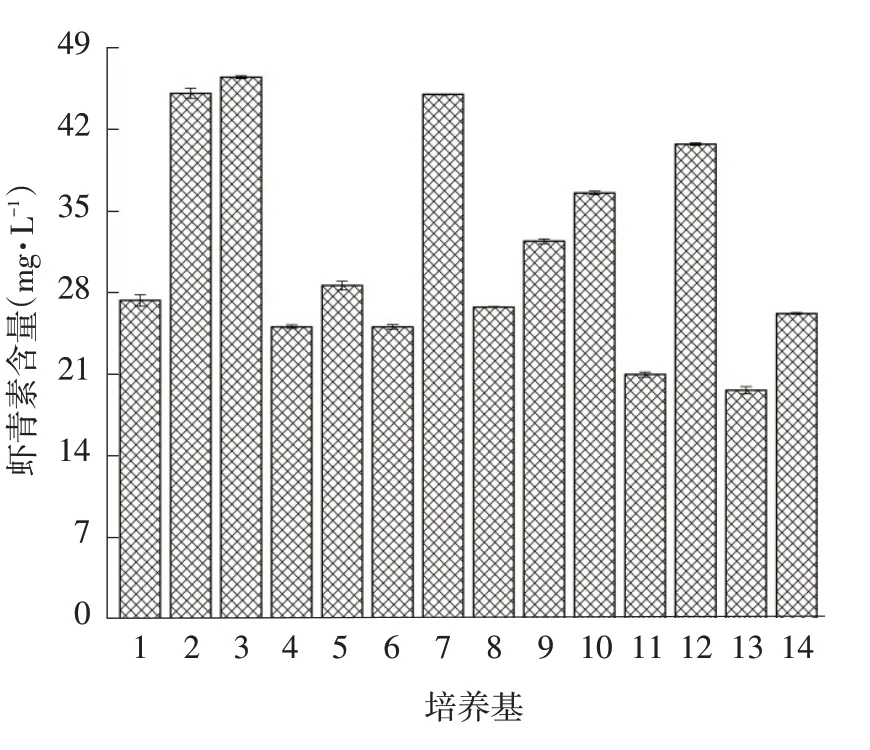
图1 不同培养基对红法夫酵母虾青素产量的影响
3.2 接种量对红法夫酵母发酵的影响
接种量对红法夫酵母生长及虾青素产量的影响结果见图2和图3。

图2 接种量对红法夫酵母生长的影响
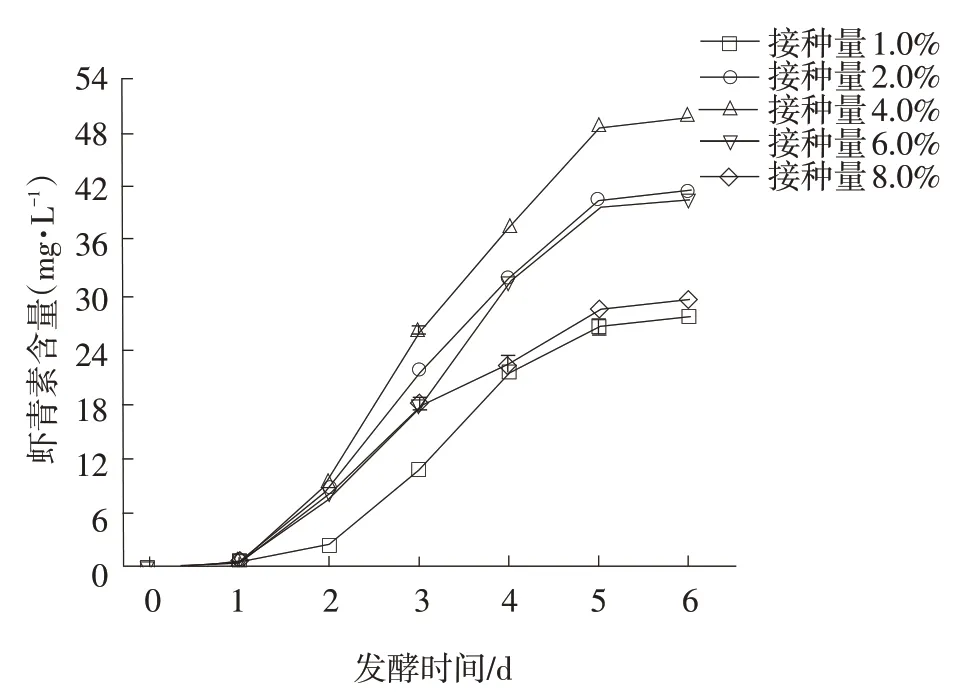
图3 接种量对虾青素产量的影响
由图2 可知,发酵前3 d 红法夫酵母生物量皆显著增加,菌体大量增殖,3~4 d 趋于稳定,菌株繁殖速率减缓。由图3 可知,前2 d 虾青素产量较少,3~5 d虾青素大量累积。最终接种量为4.0%时虾青素产量最大达48.85 mg·L-1。
3.3 发酵时间对红法夫酵母发酵的影响
发酵时间对红法夫酵母生长及虾青素产量的影响结果见图4。
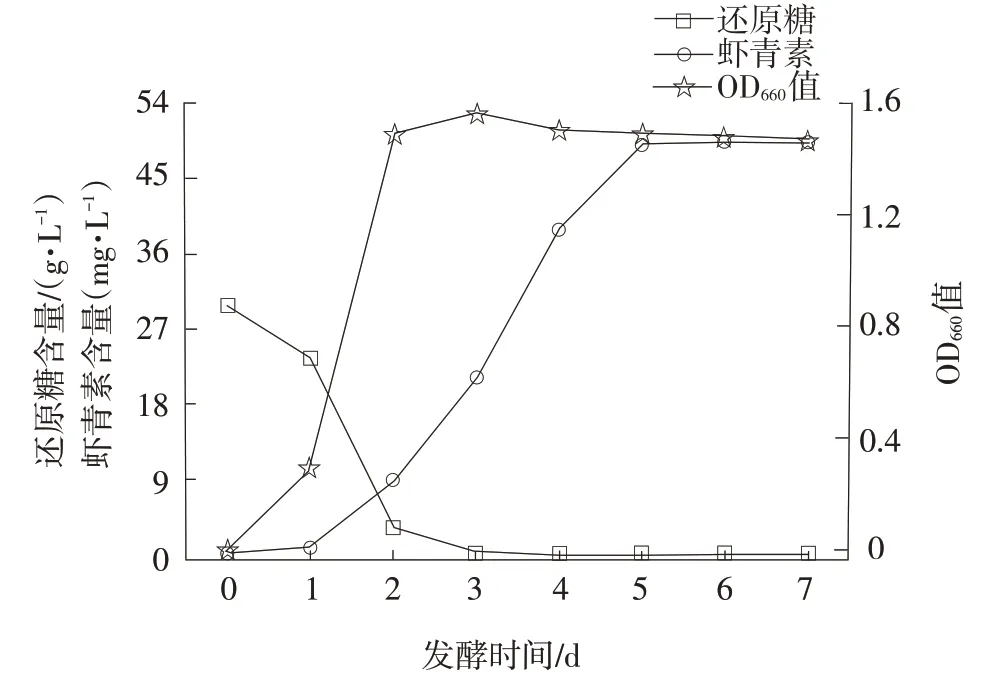
图4 发酵时间对红法夫酵母生长及虾青素产量的影响
由图4 可知,发酵前期0~2 d 时菌体迅速增加,第3 天后菌体不再明显增长;还原糖在第2 天时降低至3.0 g·L-1,在第3 天时基本被利用完。虾青素含量随着发酵的时间延长随之增加。在第2天时虾青素迅速增加,3~6 d 处于累积时间,第6 天时虾青素含量趋于稳定。
3.4 补充不同碳源对红法夫酵母发酵的影响
补充不同碳源对红法夫酵母生长及虾青素产量的影响结果见图5和图6。

图5 补充碳源对红法夫酵母生长的影响
由图5 和图6 可知,在发酵48 h 时,补充10.0 g·L-1的葡萄糖、蔗糖及乳糖,对红法夫酵母生长及产虾青素具有不同的影响。48 h前,三组红法夫酵母的生物量急剧增加;60 h后进入稳定期。葡萄糖组红法夫酵母生物量较高,生长较好;乳糖组较差。132 h 时,葡萄糖组别红法夫酵母虾青素产量高于蔗糖组及乳糖组12%;132 h 后,三组虾青素产量差异不明显。从菌体的生长及虾青素的产量考虑,补料时以葡萄糖为碳源,可促进红法夫酵母的生长及虾青素的合成。
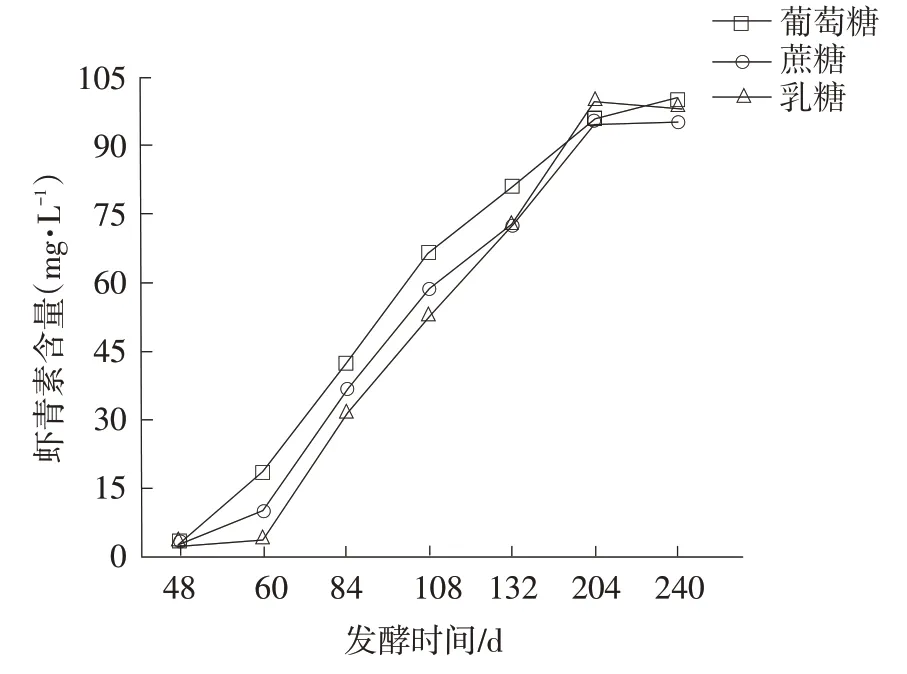
图6 补充碳源对红法夫酵母虾青素产量的影响
3.5 补充不同氮源对红法夫酵母发酵的影响
由补充不同氮源对红法夫酵母生长及虾青素产量的影响结果见图7和图8。

图7 补充氮源对红法夫酵母生长的影响
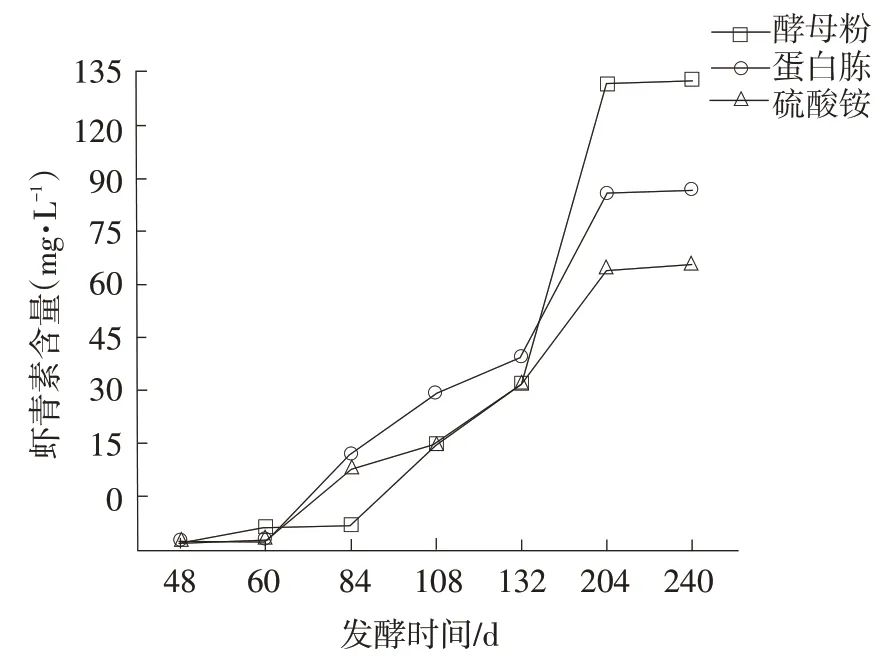
图8 补充氮源对红法夫酵母虾青素产量的影响
由图7和图8可知,在发酵48 h后添加1.0 g·L-1的酵母粉、蛋白胨及硫酸铵,对红法夫酵母生物量及虾青素的合成影响显著。酵母粉及蛋白胨皆为有机氮源,更有利于细胞的生长及虾青素的合成。84~132 h时,蛋白胨组虾青素含量高于酵母粉及硫酸铵组;204 h 时,相比蛋白胨组和硫酸铵组,酵母粉组红法夫酵母的虾青素产量提高39%~65%。
3.6 不同促进剂对红法夫酵母发酵的影响
不同促进剂对红法夫酵母生长及虾青素产量影响结果见图9和图10。

图10 不同促进剂对红法夫酵母虾青素产量的影响
由图9 和图10 可知,淀粉和番茄红的添加对红法夫酵母的生长没有促进作用,碳酸钙的添加对红法夫酵母的生长具有促进作用。发酵132 h前,碳酸钙的添加可显著提高红法夫酵母虾青素产量,发酵204 h 时,其虾青素含量与空白组接近。钙离子能够激活丙酮酸脱氢酶,且钙离子可促使细胞线粒体内ATP 的合成,为微生物的生长提供能量,从而促进代谢产物的积累。可见,碳酸钙的添加可加快虾青素的合成。发酵204 h 时,淀粉及番茄红组虾青素产量显著高于其他组别,与空白组对比分别提高了35%、20%。考虑淀粉在发酵后期可刺激红法夫酵母产虾青素,而番茄红是虾青素合成的前体物质,添加番茄红可在发酵后期促进虾青素的合成。可考虑通过补料加入前体物质,既能满足产物合成的需要,又可避免前体物质大量积累抑制菌体的生长,从而提高虾青素的合成。
3.7 补料方式对红法夫酵母发酵的影响
补料方式对红法夫酵母生长及虾青素产量影响结果见图11和图12。
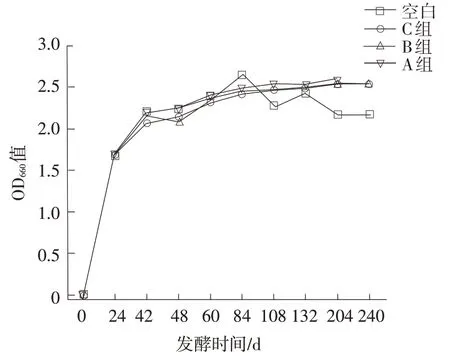
图11 葡萄糖补料方式对红法夫酵母生长的影响
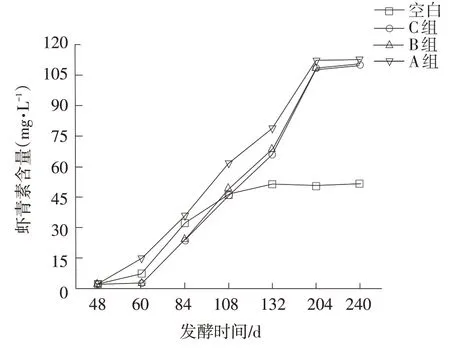
图12 葡萄糖补料方式对红法夫酵母虾青素产量的影响
由图11 和图12 可知,随着葡萄糖补料量的增加,酵母的生物量及虾青素的含量在继续增加;发酵132 h后,空白组虾青素含量趋于稳定,而补充葡萄糖的组别虾青素含量还在显著增加;204 h时A 组虾青素含量可达到112 mg·L-1,比空白组高出120%。可见,葡萄糖的间歇流加对红法夫酵生长及虾青素的合成具有促进作用。
4 结 论
以红法夫酵母Yea.Pr-17为研究对象,通过优选基础发酵培养基,最终确定了葡萄糖30.0 g·L-1,酵母浸粉5.0 g·L-1,磷酸二氢钾3.0 g·L-1,硫酸镁3.0 g·L-1,磷酸氢二钠 1.0 g·L-1为基础发酵培养基。在发酵48 h 时,添加10.0 g·L-1葡萄糖碳源、1.0 g·L-1酵母粉氮源、5.0 g·L-1番茄红及5.0 g·L-1淀粉对红法夫酵母产虾青素具有促进作用。在无外加营养物质的条件下,发酵6 d、接种量为4%可获得较高的虾青素产量。葡萄糖的间歇流加对红法夫酵生长及虾青素的合成具有促进作用,比空白组提高了120%。
5 讨 论
试验过程设计有许多考虑不全面的因素,如在培养基优化方面考虑问题不够全面,后续还可在氮源、生长因子、培养条件等因素上综合考虑,进一步优化出更加适宜红法夫酵母菌Yea.Pr-17生长的培养基以及培养条件,在此基础上,菌株所产的虾青素还有希望得到进一步的增加。其次,在虾青素的提取方法以及新产品开发和应用上仍有较大的研究空间,后续试验研究可以从以上方面进行。

