磺酸基树脂对铜、铅、镉离子的吸附行为
胡耀强,郭 敏,叶秀深,李 权,刘海宁
(1.广东海洋大学 海洋与气象学院,广东 湛江 524088;2.中国科学院 青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海 西宁 810008;3.青海省盐湖资源化学重点实验室,青海 西宁 810008)
0 引言
塑料制品已广泛存在于人们的日常生活中,这类废物的不当处理使其易分散在环境中,常见成分有PE、PS、PA、PVC等[1,2]。大部分塑料降解缓慢,在多种物理化学因素的作用下变为尺寸更小的微塑料[3,4]。ECHA将含有高分子链的、粒径处于1 nm至5 mm,或纤维状长度3 nm至15 mm(长径比大于3)、固体颗粒小于5 mm的塑料颗粒被归为微塑料[5]。微塑料随着降雨和地表径流汇入到湖泊海洋中,随着湖水、海水的流动逐渐发展成为全球性污染[6,7]。当微塑料被动物摄入体内后,通过食物链可随着食物被摄入人体,难以被代谢出体外[8,9]。
微塑料除了本身可以随着食物链进入人体之外,还可吸附疏水性的有机分子和重金属离子[1]。在疏水作用、π-π作用下,苯、多氯联苯、多环芳烃、烷烃等多种有机小分子可以吸附在PE、PS等微塑料的高分子骨架上,也可通过氢键、静电吸引作用吸附亲水性的有机分子[1,10,11]。PVC、PET等材质的微塑料可同时吸附铜、铅、镉等多种重金属离子污染物,被摄入到生物体内,重金属离子会被重新释放,经食物链富集后,危害人的身体健康[10,12]。水处理技术中吸附法、离子交换法的广泛使用,使接枝有胺基、羧基、磺酸基等官能团的高分子材料大量使用,重金属离子的吸附效果会显著增强[13-15]。当这些材料被处置不当时,会在自然界中降解为微塑料,吸附富集水体中的重金属离子,形成复合污染。随着食物链进入人体后,吸附的重金属离子会不同程度的释放出来,危及人体健康[9]。基于上述因素,人们愈发意识到微塑料的危险性。
微塑料收集困难,且本身携带的官能团种类和数量难以控制,使得研究其中磺酸根对重金属离子的作用规律存在障碍。本文为研究其作用规律,选择常见的PS为骨架且人工修饰有磺酸基的树脂作为研究对象,设计吸附体系,探究磺酸根基团对铜、铅、镉离子的吸附行为,以期为微塑料的吸附及处理提供参考。
1 实验材料和方法
1.1 材料
CuCl2·2H2O(>99%)、CdCl2·5/2H2O(>98%)、Pb(NO3)2(>99%)分别购自上海泰坦科技股份有限公司、上海麦克林生化科技有限公司、上海试剂四厂,标准溶液购自国家钢铁材料测试中心钢铁研究总院。D101和S001(Seplite 001X7)树脂均购自西安蓝晓科技有限公司。 D101和S001具有相同的分子骨架,由苯乙烯-二乙烯苯共聚而成。其中D101为弱极性大孔树脂,S001被修饰有磺酸基团。将两种树脂进行研磨筛分,选取60目与100目中间截留部分,使用无水乙醇浸泡出去残留有机小分子,再使用去离子水多次清洗,储存在密闭容器中备用。
从图1吸附前后的照片可以看出,D101在吸附过程前后的外观形貌未发生变化,而S001在吸附铜离子后颜色变为绿色(图1f),吸附铅、镉离子后外观形貌则未发生变化。

注:a:D101;b:D101-Cu;c:D101-Pb;d:D101-Cd;e:S001;f:S001-Cu; g:S001-Pb;h:S001-Cd。图1 D101和S001吸附前后的数码照片
1.2 吸附实验
将0.1 g D101或S001加入到100 mL分别含有铜、铅、镉离子的溶液中,放置于恒温水浴振荡器进行静态吸附实验。改变水浴温度,考察溶液温度对吸附动力学过程的影响;将吸附溶液放置于恒温夹套玻璃杯中,在磁力搅拌条件下考察混合方式的改变对吸附动力学过程的影响;配置不同浓度的铜、铅、镉盐溶液,考察重金属离子初始浓度对平衡吸附量的影响;使用HCl调节吸附液pH,考察酸性和中性环境下溶液初始pH对平衡吸附量的影响;以NaCl为盐度调节剂,考察S001在吸附三种重金属离子过程中的抗干扰能力;考察初始浓度影响时的选取范围为10-200 mg/L。实验过程中离子浓度测定均使用原子吸收光谱仪进行测定,吸附量的计算按照公式
(1)
C0、Ct分别为初始时刻和t时刻吸附质离子浓度(mg/L),V是吸附溶液体积(L),m是吸附剂质量(g),qt为吸附剂t时刻时的吸附量(mg/g)。
1.3 仪器表征
使用JSM-5610LV型(日本JEOL公司)FTIR对D101和S001吸附前后的官能团进行表征;使用Nexus型(美国Thermo Nicollet公司)SEM-EDS对D101和S001吸附前后表面的元素组成进行分析。
2 实验结果与讨论
2.1 吸附时间
Weber&Smith认为吸附质分子从溶液相扩散至吸附剂外表面及在吸附剂孔道内部的扩散过程通常为吸附过程的控速步骤[16]。加速化学反应过程中固液界面传质速率的常见方法有振荡、搅拌、超声、鼓泡等[17,18],吸附过程中一般采用振荡的方式模拟实际水体运动对吸附过程的影响。本文首先采用了振荡的方式,考察D101和S001吸附铜、铅、镉的动力学过程。D101对三种重金属离子未表现出吸附效果,S001则展现出良好的吸附效果,如图2(a),如化学反应方程式(2)所示,铜、铅、镉离子均为正二价离子,与磺酸根之间存在较强的静电吸引作用,易将磺酸根原本结合的钠离子置换下来。
从吸附过程可以看出,达到平衡的时间需要100 h以上。为探究传质过程对吸附过程整体的影响,进一步考察了搅拌条件下的吸附动力学过程,发现在100 rpm转速的搅拌下,5 h即可达到吸附平衡,如图2(b)。可见吸附质的传质阶段对整个吸附过程的影响十分显著。这也在一定程度上意味着运动剧烈的水体中重金属离子可能在几小时内即可达到吸附平衡。
2PS-SO3Na+M2+→(PS-SO3)2M+2Na,
(2)
其中M2+:Cu2+、Pb2+、Cd2+。

图2 振动和磁力搅拌对D101和S001吸附动力学过程的影响

图3 温度对S001吸附铜、铅、镉离子的影响
2.2 温度
一般情况下,升温可以加速分子的运动速率,进而加速分子在吸附过程各阶段的扩散速率,而温度对平衡吸附量的影响主要受吸附反应热效应的影响[19]。结合图2和图3分析,在实验选定的温度范围内,温度变化对S001吸附铜、铅、镉离子的动力学过程和平衡吸附量的影响不显著。
2.3 动力学模型拟合
准一级和准二级动力学模型可以根据吸附平衡前的动力学数据预测初始吸附速率和平衡吸附量[20]。准一级动力学模型是基于吸附质分子扩散过程为控速步骤,而准二级动力学模型则基于吸附反应为化学吸附过程的控速步骤[21]。因此,采用二者对S001吸附铜、铅、镉离子的动力学过程进一步分析,拟合方程分别为方程(3)、(4)。
In(qe-qt)=lnqe-k1t,
(3)
(4)
k1、k2分别为准一级速率常数(h-1)和准二级速率常数(g/(mg-1·h-1))。

图4 准一级和准二级动力学模型拟合
拟合结果图如图4所示,平衡吸附量预测值、吸附速率常数、相关性系数列于表1中。振荡条件下,准一级动力学模型对S001吸附三种重金属离子的动力学过程拟合效果相对较好,表现为平衡吸附量预测值与实测值更接近、相关性系数更接近于1。在100 rpm的搅拌下,准二级动力学模型对吸附动力学过程拟合效果较好,平衡吸附量预测准确、相关性系数高;而准一级动力学模型的预测值则严重偏离实测值,相关性系数较差。上述结果表明振荡条件下铜、铅、镉离子的扩散过程和在S001表面的吸附过程是整个吸附动力学过程的控速步骤;当采用搅拌的方式加速重金属离子的传质过程后,扩散过程不再是S001吸附过程的控速步骤,三种重金属离子在S001表面的吸附阶段成为整个吸附过程的主要控速步骤。

表1 准一级和准二级动力学模型拟合结果
2.4 pH
pH在吸附过程中扮演着极其重要的角色,它可影响吸附剂表面电荷、官能团的质子化程度及金属离子在水溶液中存在形态[22]。为避免溶度积常数对重金属离子吸附过程产生干扰,考察酸性、中性溶液中pH值对S001吸附铜、铅、镉离子的影响(图5)。从结果可以看出,三种重金属离子的平衡吸附量均随着pH的减小而降低,这是由于H+与金属离子竞争S001表面的磺酸根位点所致[23],如化学反应方程式(5)所示,氢离子浓度升高使化学反应向右进行。其中镉离子受到pH的影响最为显著,表明磺酸根与镉离子间的作用最易受H+干扰[23,24]。
PS-SO3Na+H+→SO3H+Na+。
(5)

图5 初始pH对铜、铅、镉离子平衡吸附量的影响
2.5 NaCl
自然水体中会存在多种无机离子,最为常见的阳离子是Na+、Mg2+、Ca2+等。本小节以Na+为考察对象,研究共存离子对S001吸附三种重金属离子行为的影响。根据化学反应方程式(2)可知,当提高Na+浓度时,反应平衡会向左移动,使铜、铅、镉离子的吸附量降低,结果如图6所示,此规律与其它相关研究结果相似[25,26]。
2.6 初始浓度对平衡吸附量的影响
重金属离子初始浓度升高,增大溶液到吸附剂表面的浓度梯度,推动吸附反应(2)平衡向右移动,吸附量增大[27-29]。在考察的初始浓度范围内,铅、镉离子的吸附量随着初始浓度的升高持续增大(图7),可能是因为磺酸根的修饰量较大,尚未被完全占据;而铜离子与磺酸根的结合能力最弱,在200 mg/L初始浓度的条件下,吸附量远低于铅、镉离子的吸附量。
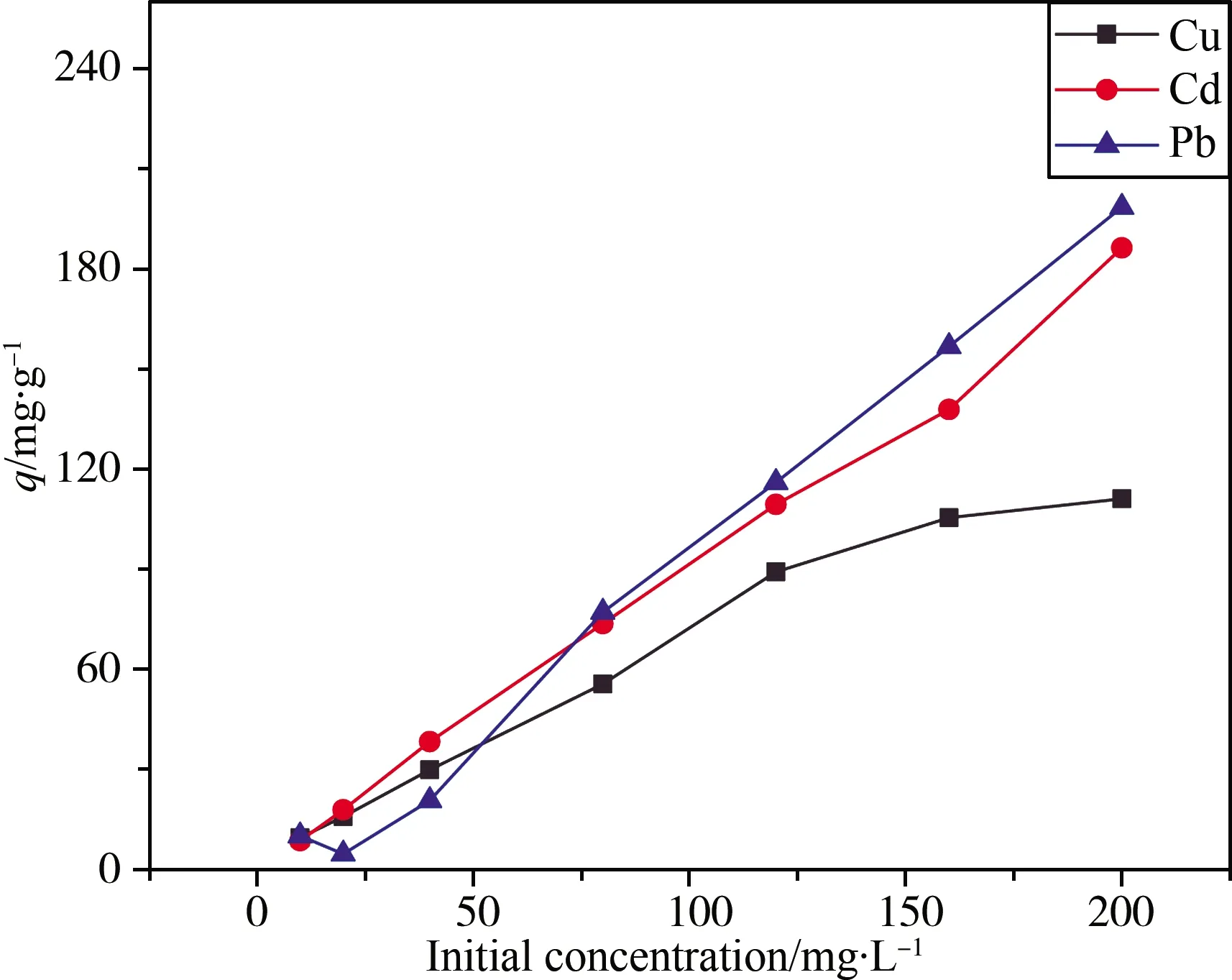
图7 初始浓度对铜、铅、镉离子平衡吸附量的影响
2.7 吸附机理
图8为S001树脂吸附前后的EDS能谱图,EDS能谱中吸附后的S001中钠信号峰强度相比吸附前明显减弱,铜、铅、镉信号峰出现。表1为EDS测试的半定量分析结果,根据元素含量的变化可判断出铜、铅、镉的吸附过程实际为离子交换过程:铜、铅、镉离子与磺酸根之间的静电吸引作用较强,将磺酸根结合的钠离子置换下来。

图8 吸附前后S001的EDS谱图
吸附过程前后,S001的红外吸收光谱中吸收峰无明显增减,表明S001本身结构保持稳定,无明显变化,在一定程度上说明3种重金属离子的吸附过程仅是离子交换过程。
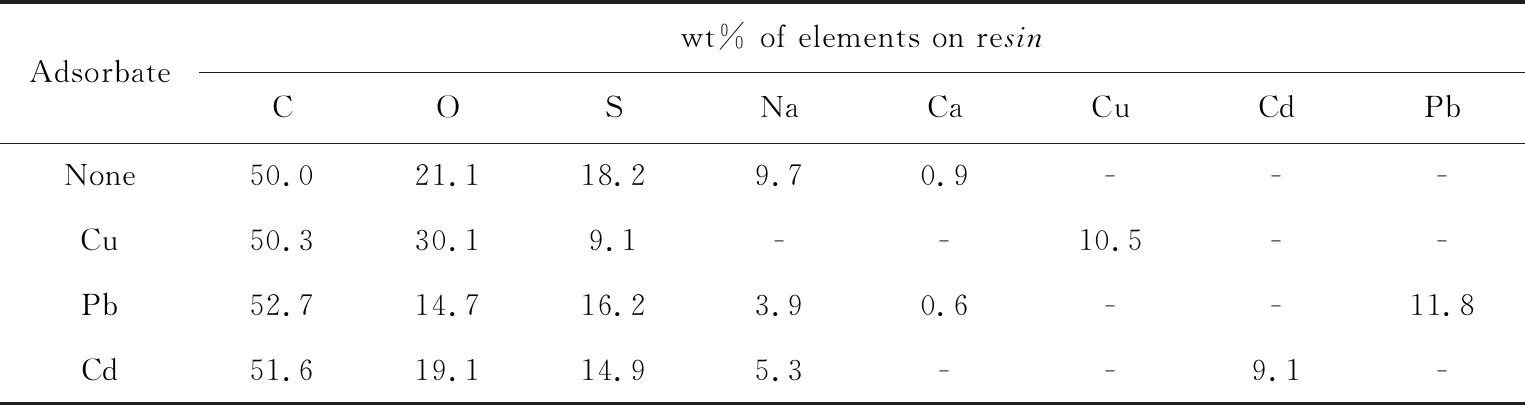
表1 吸附前后S001表层元素组成
3 结论

图9 吸附前后S001的FTIR光谱图
通过对D001和S001吸附铜、铅、镉离子行为的研究,发现(1) 溶液混合效果是影响S001吸附Cu2+、Pb2+、Cd2+速率最为关键的因素,通过准一级和准二级动力学模型分析,振荡条件下金属离子的扩散阶段和在S001表面的吸附阶段共同控制了吸附速率,搅拌时溶液混合效果好,金属离子在S001表面的吸附阶段成为唯一的控速步骤。升温对吸附过程的加速效果和平衡吸附量的影响均不显著。(2) pH增大,H+浓度降低,与Cu2+、Pb2+、Cd2+的竞争程度减弱,使三者吸附量增大。(3) 共存NaCl可大幅削弱S001上磺酸根对Cu2+、Pb2+、Cd2+的吸附,Pb2+的抗Na+干扰效果略优于Cu2+、Cd2+。(4) 结合S001的结构及EDS和FTIR结果分析,离子交换是S001吸附Cu2+、Pb2+、Cd2+的作用机理。

