双峰母驼肌肉中TPM2与TPM3表达模式及对肌纤维细胞凋亡的影响
李海江,王 琪,李宗帅,董伟韬,张 勇,赵兴绪
(甘肃农业大学动物医学院,甘肃兰州 730070)
双峰驼(Bactrian camel)属于骆驼科骆驼属,既是季节性发情又是诱导排卵型动物,本研究用蛋白组学技术对繁殖季节和非繁殖季节双峰驼血清进行分析,发现TPM2和TPM3与双峰驼肌肉生长发育有关。原肌球蛋白家族共有4个基因,分别为TPM1(α基因)、TPM2(β基因)、TPM3(γ基因)和TPM4(δ基因)[5]。在肌肉细胞中,TPM主要参与调节肌肉收缩过程,通过调节ATP酶活性,达到稳定肌细胞骨架结构作用。TPM2和TPM3与体内许多生命活动直接相关,如胞质分裂、胞膜物质转运、细胞运动、诱导细胞凋亡及信号转导等[1]。TPM2与TPM3在动物繁殖育种方面,近年来分别用表达芯片技术、抑制消减杂交技术、ITRAQ、RT-qPCR,TPM2是并行存在细肌丝与肌动蛋白之中,TPM3是介导肌球蛋白-肌动蛋白对Ca2+离子的反应蛋白,二者共同稳定肌细胞骨架微丝,参与骨骼肌、平滑肌、心肌收缩系统的组成[2]。细胞凋亡是哺乳动物细胞生命活动中的关键事件,在机体细胞中,Bax和Bcl-2因子参与细胞的正向和负向调控,且在凋亡信号转导途径中发挥着关键的作用,共同参与细胞凋亡的调控,故而它们用作检测细胞凋亡的主要指标[3]。
近年TPM2和TPM3的研究仅在人类疾病及其他物种的研究,在双峰驼方面的研究甚少。基于GenBank中收录的双峰驼TPM2和TPM3基因全序列,本研究用RT-qPCR、Western blot和免疫组织化学技术检测TPM2和TPM3在不同肌肉组织中的表达谱,用免疫荧光和siRNA技术分别检测TPM2在细胞中的定位以及对双峰驼肌肉肌纤维细胞凋亡的影响,为进一步揭示其功能提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及样品采集 肌肉组织(平滑肌、骨骼肌和心肌)来自双峰母驼(4岁~6岁)分别于2019年1月(繁殖季节)和2018年6月(非繁殖季节)采集,其中平滑肌取自输左卵管中部,骨骼肌取自股骨外侧,心肌取自心肌组织。一部分迅速放置液氮中冷冻,然后-80℃保存,另一部分固定于100 mL/L福尔马林溶液中备用。
1.1.2 主要试剂与仪器 焦碳酸二乙脂(DEPC)、Trans Zol up RNA提取试剂、SYB Premix ExTaqTMⅡ试剂盒、 底物化学发光液(ECL),均为北京全式金生物公司产品;蛋白裂解液(RIPA),索莱宝生物公司产品;基础培养基(Opti-MEM)、脂质体(Lipo-fecmine 2000)、聚偏二氟乙烯膜(PVDF)、十二烷基硫酸钠、聚丙烯酰胺cDNA synthesis kit反转录试剂盒,Thermo公司产品;GAPDH兔多克隆抗体(10494-1-AP),TPM2兔多克隆抗体(11038-1-AP);TPM3兔多克隆抗体(10737-1-AP),武汉三鹰生物公司产品;羊抗兔(Goat Anti-Rabbit IgG/HRP),羊抗鼠(Goat Anti-Mouse IgG/HRP),北京博奥森生物技术有限公司产品。 分光光度计,PCR仪,凝胶成像仪,微型离心机,实时荧光定量PCR仪,三气培养箱,LSM 700型激光共聚焦显微镜,HS-100B恒温摇床等。
1.2 方法
1.2.1 总RNA提取及cDNA合成 肌肉组织经液氮研磨后,根据TransZol UP RNA试剂盒操作说明提取双峰驼各组织总 RNA。每个样品取5 μL总RNA,10 g/L琼脂糖凝胶电泳检测其完整性后,用超微量分光光度计测定浓度。定量之后按cDNA synthesis kit操作说明中的两步法进行第一链cDNA合成,产物于-20℃保存备用。
1.2.2 实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR) 根据NCBI公布的双峰驼原肌球蛋白TPM2(XM-010952840)和原肌球蛋白TPM3(XM-010954014)、Bcl-2(XM-010979993)、Bax(XM-010946937)和内参β-actin(XM-010965866.1)基因序列,应用Primer premier 5.0在线软件设计引物(表1),通过NCBI的Blast检测引物特异性,由北京奥科鼎盛生物科技有限公司合成。
以反转录获得的cDNA为模板,β-actin为内参基因,通过实时荧光定量PCR检测各基因的mRNA表达水平。其反应体系为20 μL:2×Tran start tip green qPCR superMix 10 μL,上、下游引物各0.5 μL,cDNA 1 μL,dd H2O 8μL。扩增程序采用3步法:94℃ 30 s;94℃ 5 s,56℃ 15 s,72℃ 10 s;共45个循环,每个样品重复3次,反应结束后观察扩增曲线和溶解曲线,采集Ct值。采用2-△△ct方法进行数据处理。
1.2.3 免疫印迹 用研钵将肌肉组织样品1.5 g加液氮充分研磨,加入RIPA(1∶300)裂解液和PMSF,置于冰盒裂解30 min,4℃、10 000 r/min离心30 min,提取出的上清液含有组织中的总蛋白,用分光光度仪测定蛋白的浓度,按照标准曲线进行定量。用5×SDS上液缓冲液100℃水浴变性10 min,存于-20℃。应用120 g/L SDS-PAGE将蛋白分离,转至PDVF上,50 g/L的脱脂奶粉室温封闭2 h,以GAPDH为内参(1∶5 000),一抗4℃过夜孵育,PBST洗膜,二抗37℃孵育2 h。PBST洗膜,ECL显色曝光,记录结果,试验重复3次。

表1 引物序列及参数
1.2.4 肌肉组织免疫组织化学 石蜡切片,60℃烤片,常规方法脱蜡,按照免疫组化试剂盒的使用说明书进行处理。滴加DAB显色剂观察切片显色反应,入水终止显色反应。按照苏木精再次染色、分化、脱水、透明、封片的顺序进行处理,最后镜检照相。
1.2.5 肌纤维细胞免疫荧光染色 将转染24 h细胞接种于玻璃培养皿,40 mL/L多聚甲醛室温固定30 min,用5 ml/L Triton×-100室温孵育10 min,30 mL/L H2O2孵育10 min,山羊血清4封闭15 min,加一抗,4℃过夜。PBS洗3次,避光滴加荧光标记的二抗,孵育60 min,PBS 洗3次。避光加(DAPI)染核,室温静置3 min~5 min,PBS洗3次,用抗荧光淬灭封片。
1.2.6 细胞转染 根据TPM2的基因序列,由广州锐博生物公司合成双链小分子siRNA(表2),(阴性对照siRNA-序列不公开,广东锐博公司拥有知识产权)。按照siRNA和Lipofectamine2000说明书进行转染。将选择纯化后的F2代细胞传代培养,待细胞汇合度达到30%~40%时加入2 mL完全培养基,之后,将3 μL siRNA溶与120 μL Opti-MEM中静置3 min~5 min后加入9 μL Lipofectamine 2 000混匀,室温静置30 min后,将混合液加入培养皿,37℃、体积分数为5%的 CO2培养箱中培养。
1.2.7 图像采集及数据分析 用SPSS 17.0软件对所有数据进行独立样本t检验分析对不同肌肉组织的基因表达进行显著性检验,用BON法进行多重比较,荧光定量分析采用 2-ΔΔCt法测定目的基因 mRNA的相对表达水平;以GAPDH基因为内参进行标准化,Western blot结果用Image J软件进行图像分析,将扫描出来的目的蛋白TPM2与TPM3分别将内参蛋白GAPDH的灰度值作比值;用OlympusDPx71显微镜观免疫组织化学染色结果,用激光共聚焦系统采集细胞免疫荧光照片。

表2 siRNA序列信息
2 结果
2.1 TPM2在繁殖季节双峰母驼肌肉组织中的表达
RT-qPCR检测不同组织中TPM2 mRNA表达水平,结果显示TPM2 mRNA基因在繁殖季节双峰母驼肌肉肌肉组织中的相对表达量均极显著高于非繁殖季节的肌肉组织(P<0.01)(图1A);不同组织样品中TPM2和GAPDH蛋白的Western blot分析(图 1B)和不同组织中检测到的TPM2蛋白光密度值(图1C),TPM2蛋白在繁殖季节双峰母驼肌肉组织中的相对表达量均极显著高于非繁殖季节的肌肉组织(P<0.01)。
2.2 TPM3在繁殖季节双峰母驼肌肉组织中的表达
RT-qPCR检测不同组织中TPM3 mRNA表达水平(图2A),TPM3基因在繁殖季节骨骼肌和心肌组织中的相对表达量极显著高于非繁殖季节肌肉组织(P<0.01),在平滑肌肌肉组织中表达差异不显著;不同组织样品中TPM3和GAPDH蛋白的Western blot分析(图2B)和不同组织中检测到的TPM3蛋白光密度值(图2C),TPM3蛋白在繁殖季节骨骼肌和心肌组织中的相对表达量均极显著高于非繁殖季节的肌肉组织(P<0.01)。
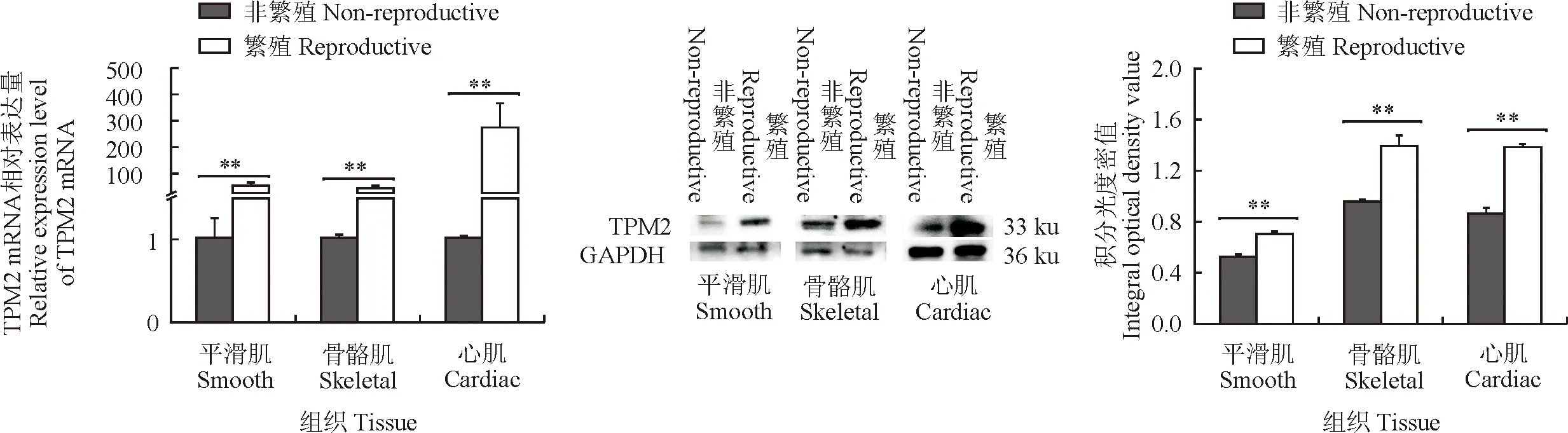
**P<0.01,*P<0.05)

**P<0.01,*P<0.05)
2.3 非繁殖季节肌肉组织中TPM2与TPM3的表达模式
RT-qPCR检测非繁殖季节肌肉组织中TPM2 mRNA表达水平,非繁殖季节骨骼肌组织中TPM2 mRNA的相对表达量极显著高于平滑肌和心肌的表达(P<0.01)(图3A、图3B)。不同组织中TPM2、TPM3和GAPDH蛋白的Western blot分析(图3C)和不同组织中检测到的TPM2蛋白光密度值(图3D和图3E),TPM2蛋白在心肌肌肉组织中表达量高于其他组织;骨骼肌组织中TPM3 mRNA的相对表达量极显著高于平滑肌和心肌的表达(P<0.01),TPM3蛋白在骨骼肌肌肉组织中表达量高于其他组织。

图3 非繁殖季节不同肌肉TPM2/TPM3 mRNA 和蛋白的相对表达(n=3)
2.4 繁殖季节双峰母驼肌肉组织中TPM2与TPM3的表达模式
RT-qPCR检测繁殖季节肌肉组织中TPM2 mRNA表达水平(图4A、图4B),在繁殖季节双峰驼肌肉组织中,骨骼肌组织中TPM2 mRNA 与蛋白相对表达量极显著高于其他组织(P<0.01)。不同组织中TPM2、TPM3和GAPDH蛋白的Western blot分析(图4C),不同组织中检测到的TPM2和TPM3蛋白光密度值(图4D和图4E),骨骼肌组织中中TPM3 mRNA与蛋白的相对表达量均极显著高于其他肌肉组织(P<0.01)。
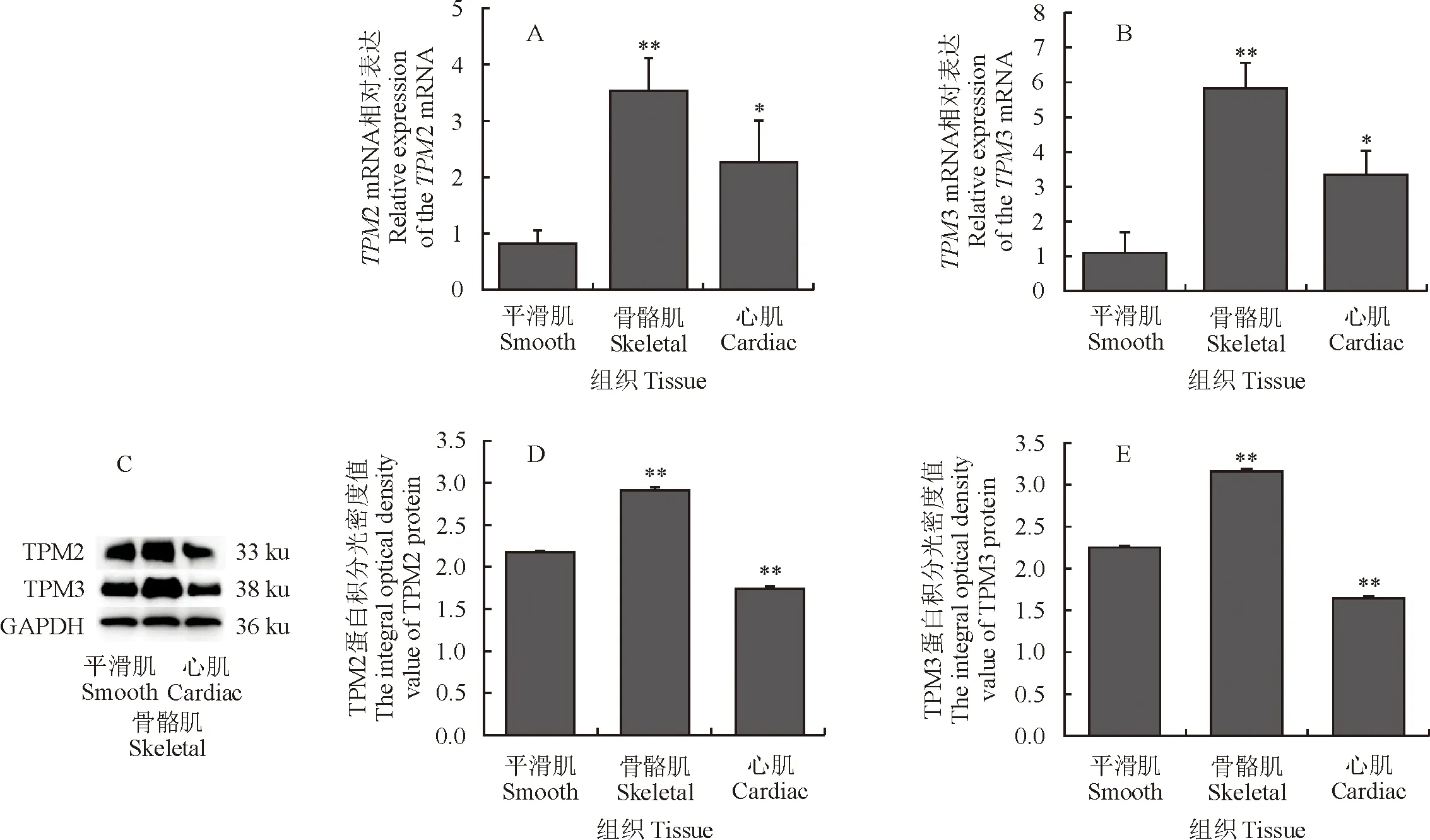
图4 繁殖季节不同肌肉TPM2/TPM3 mRNA 和蛋白的相对表达(n=3)
2.5 基因TPM2细胞免疫荧光
通过细胞免疫荧光技术对TPM2在肌纤维细胞内进行定位分析,结果显示,TPM2蛋白在肌纤维细胞的细胞核和细胞浆均有表达,但根据荧光强度判断,其主要在细胞核内表达(图5)。

图5 免疫荧光检测TPM2在细胞分布
2.6 siRNA-TPM2敲低效率的检测
荧光定量检测敲低效率,siTPM2-1对骆驼肌纤维细胞的敲低效率最佳,沉默效果为40%(图6A)。转染siTPM2-1后,24 h、48 h和 72 h均匀不同程度的沉默效果,但24 h 和48 hTPM2的mRNA表达水平极显著低于对照组(P<0.01),而72 hTPM2的mRNA表达水平与对照相比差异不显著(图6B)。

图6 siRNA-TPM2敲低效率的检测
2.7 敲低TPM2对细胞凋亡的影响
为了解沉默TPM2对肌纤维细胞凋亡的影响,通过RT-qPCR检测促凋亡和抗凋亡因子的mRNA水平。结果显示,与对照组相比,转染24 h后,沉默组Bax的mRNA相对表达水平显著上调(P<0.05),48 hBax的mRNA表达水平极显著上调(P<0.01)与对照组相比转染24 h,沉默组Bcl-2的mRNA表达水平极显著低显著下调,而48 h与对照组无明显差异(P<0.01)。
3 讨论
哺乳动物中原肌球蛋白的20多种异构体被确认[4],其中TPM2和TPM3也成为人类诊断各种癌症新候选标志物[5]。在家畜遗传育种研究中发现猪、兔肌肉生长和肌肉纤维差异组受TPM2和TPM3调节[6]。本试验结果表明,繁殖季节双峰母驼肌肉组织中TPM2与TPM3对应的 mRNA和蛋白的表达量显著高于非繁殖季节,均属于上调蛋白。在繁殖季节双峰母驼雌激素分泌增多,参与生理调控过程,研究发现,家畜的子宫、输卵管、阴道、垂体等组织均为雌激素的靶组织,在雌激素影响下,输卵管、子宫的活动增加,其腺体、基质及肌肉部分都增生[7]。而分泌的17β-雌二醇(E2)能与转录调节因子雌激素核受体ERα和ERβ通过基因组效应结合雌激素,作用于具体的靶组织[8],这也解释本试验中特定基因TPM2与TPM3在双峰母驼繁殖季节通过雌激素调控靶肌肉组织,使其蛋白表达上调。至此可知,繁殖季节母驼分泌的雌激素促进有丝分裂,通过刺激孕激素受体、表皮生长因子及胰岛素样生长因子等促进肌肉生长。
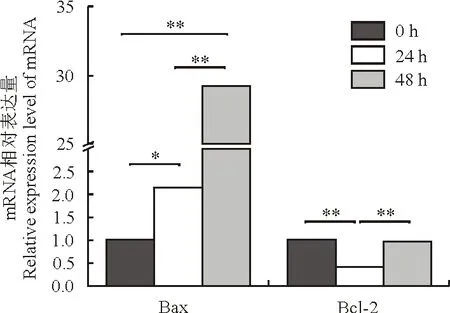
图7 RT-qPCR检测凋亡因子的mRNA水平
骨骼肌占是最丰富的组织,在动物整个生长发育过程中调控各种蛋白表达积累[9]。本研究发现无论是繁殖季节还是非繁殖季节,骨骼肌组织中TPM2与TPM3的基因和蛋白都明显高于其他肌肉组织。这与此二者蛋白在鸭子胸肌,黑山羊骨骼肌以及鸡胚胎骨骼肌中研究结果一致[10];表明TPM2与TPM3共同参与肌肉蛋白质的合成和骨质生长,在骨骼肌组织中特异性表达,在试验过程中TPM2在骨骼肌中mRNA表达水平与蛋白表达水平略为不一致的情况,可能是实验方法的敏感性不同,也可能是TPM2蛋白不稳定所致;由此可见,此二者蛋白在骨骼肌的生长发育调控过程起重要作用,但具体机理尚不明确,还需进一步研究。
肌纤维即肌细胞,免疫荧光结果表明TPM2基因在肌纤维细胞中均有表达,说明此蛋白参与横纹肌、平滑肌、心肌收缩系统的组成。Bcl-2通常发挥抵抗细胞凋亡的作用,与凋亡Bax蛋白相互作用破坏线粒体膜的完整性,最终导致细胞凋亡[11-12]。在肌纤维细胞的转染敲低序列试验中发现TPM2在转染后的各时间点都有沉默效应,转染24 h、48 h后Bax mRNA表达显著上调,Bcl-2 mRNA表达明显下调。在此过程中,转染敲低的原肌球蛋白基因序列,使正常的翻译和转录受到影响,蛋白失去了稳定肌细胞骨架微丝作用,影响细胞的正常有丝分裂和跨膜等活动;在大鼠的研究中发现,雌激素可抑制雌性大鼠成纤维细胞的增殖和Ⅰ型Ⅱ型胶原蛋白的基因表达[13],而双峰驼同样可能通过雌激素抑制原肌球蛋白2的基因表达的同时促进了双峰驼肌纤维细胞的凋亡。
——野双峰驼

