miR-155-5p通过靶向抑制Sirt1影响子痫前期发生的机制
曹丹 汤小芳 李敏慧
南京医科大学附属常州市第二人民医院产科(江苏常州213000)
子痫前期是一种妊娠中晚期潜在的多系统性疾病,它是引起围产期孕妇早产、死产、死胎的重要病因,严重的威胁了5% ~14%孕妇的健康[1]。子痫前期特征是妊娠20 周后出现高血压并伴有蛋白尿和其他系统性疾病,如肾衰竭,肝功能异常,子宫内生长受限,子宫胎盘功能不全等[2-3]。临床治疗过程中常伴有不良的妊娠结局,并且该病造成的严重并发症对母婴具有深远的影响[4]。目前,子痫前期的发病机制尚未明确,研究[5]表明绒毛外滋养层细胞侵袭失调与子痫前期的发生密切相关。因此,深入探究子痫前期的发病机制,从而寻求新的治疗手段具有重要意义。
MicroRNA(miRNA)是一类长度为22~25 个核苷酸的内源性非编码单链小RNA,在生长发育、增殖、凋亡和炎症、肿瘤及多种系统性疾病等生理病理过程起到调节作用。多种miRNAs 在子痫前期患者的妊娠胎盘组织中差异表达,其可能通过调控多种基因表达介导滋养细胞功能发生变化,从而在子痫前期的发生发展过程中发挥作用[6]。有研究者通过miRNA 表达谱分析发现miR-155-5p 在子痫前期患者胎盘组织中显著失调,表明miR-155-5p可能在子痫前期中发挥至关重要的作用,有望成为子痫前期诊断和治疗的标志物[7]。LEE 等[8]研究证实Sirt1 可能通过调节Akt/p38MAPK 信号通路参与绒毛外滋养层细胞侵袭和螺旋动脉重构,从而与胎盘发育有关。然而,目前关于miR-155-5p 与Sirt1 对子痫前期发病的影响和致病机制尚未明确。
因此,本研究通过检测子痫前期患者胎盘组织中miR-155-5p 和Sirt1 的表达水平,首次探究miR-155-5p 和Sirt1 在子痫前期发病过程中的调控机制,旨在为子痫前期的发病机制研究和临床治疗提供新的思路和理论依据。
1 材料与方法
1.1 样本来源2018年1-12月期间,选择本院妇产科收治的子痫前期患者和正常孕妇样本各25 例。排除了患有双胎妊娠、慢性高血压、肾脏疾病、糖尿病、胎儿畸形和急性或慢性肝炎的患者。子痫前期诊断标准参考第九版《妇产科学》[9],正常妊娠者和子痫前期患者的临床资料为:对照组妊娠者年龄(27.2 ± 3.6)岁,BMI(25.9 ± 1.3)kg/m2,终止妊娠孕周(38.9±0.7)周,收缩压(112.8±3.5)mmHg,舒张压(73.8 ± 2.8)mmHg;子痫前期妊娠者年龄(28.9 ± 3.9)岁,BMI(26.2 ± 1.5)kg/m2,终止妊娠孕周(36.2 ± 0.4)周,收缩压(158 ± 4.1)mmHg,舒张压(105 ± 3.2)mmHg。两组年龄、BMI 和妊娠孕周方面比较差异无统计学意义(P>0.05)。两组收缩压和舒张压比较差异有统计学意义(P<0.05)。所有的患者都采用剖腹产的方式。子痫前期胎盘组织取自25 例患者,正常妊娠者的胎盘组织取自25 例孕周正常的妊娠者。本研究经本院伦理委员会批准同意,所有纳入研究的个体均签署书面知情同意书,本研究遵循《赫尔辛基宣言》。
1.2 主要试剂和仪器滋养层细胞系HTR-8/SVeno细胞(中国科学院细胞库);RPMI 1640 培养基和胎牛血清(美国Hyclone 公司);总RNA 抽提Trizol 试剂(美国Life 科技公司);LipofectamineTM2000(美国Invitrogen 公司);miRNA-155-5p mimics 和miRNA-155-5p negative control(吉玛生物技术有限公司);SYBR qRT-PCR Super Mix(上海翌圣生物科技有限公司);BCA 试剂盒(上海碧云天生物技术有限公司);Sirt1、GAPDH 和山羊抗兔二抗(中国赛默飞世尔科技有限公司);细胞培养箱(苏州净化设备制造厂);实时荧光定量PCR 仪(瑞士Roche公司)。
1.3 细胞培养与转染滋养层细胞系HTR-8/SVeno培养在含有10%胎牛血清、100 μg/mL 链霉素和100 U/mL 青霉素的RPMI-1640 培养基中。置于37 ℃、5%CO2的细胞培养箱中进行培养。miR-155-5p mimics、Sirt1 siRNA 以及它们各自的阴性对照购自Gene Pharma(中国上海)。按照说明书,使用Lipofectamine 2000 试剂进行滋养层细胞转染。转染后不同分组细胞在37 ℃5% CO2条件下培养48 h,用于后续RNA 和蛋白相关检测实验。
1.4 RT-qPCR 分析用TRIzol 试剂提取胎盘组织和HTR-8/SVeno 细胞的总RNA。用Q5000(Quawell Technology,美国)测量提取的RNA 的浓度和纯度。然后通过逆转录酶试剂获得cDNA。 使用Light Cycler 96 仪器(Roche,巴塞尔,瑞士)进行实时荧光定量聚合酶链反应(RT-qPCR)检测miR-155-5p 和Sirt1 mRNA水平。取PCR上、下游引物(10 μmol/L)各1 μL,模板cDNA 1 μL,2×Taq Master Mix 10 μL,RNase free water 7 μL 配置成总体积为20 μL 的反应体系。使用实时荧光定量PCR 仪进行PCR 扩增,两步法程序为:94 ℃2 min(预变性),94 ℃10 s(变性)、60 ℃30 s(退火)、72 ℃30 s(延伸),共35个循环。qPCR 中使用的引物见表1。 通过2-ΔΔCt比较方法检测的miR-155-5p 和Sirt1 mRNA 相对表达水平。

表1 RT-qPCR 中使用的引物序列Tab.1 Primer sequences used in RT-qPCR
1.5 伤口愈合实验将转染后的HTR-8/SVeno 细胞用胰蛋白酶消化后重悬,稀释至细胞浓度为5×105个/mL,吸取1 mL接种于6孔板中,放置在37 ℃培养箱中继续培养。待细胞长满后,用无菌的10 μL枪头在6 孔板中央轻轻划过,接着用灭菌的PBS 清洗细胞,加入2 mL 无血清培养基,放入培养箱中继续培养。在0、24 h 时分别用光学显微镜下进行观察并拍照。
1.6 Transwell检测细胞侵袭将转染后的HTR-8/SVeno 细胞用胰酶消化,加入无血清的RPMI 1640培养基制备成浓度为3×105个/mL 的细胞悬液,吸取200 μL 细胞悬液加入Transwell 上室,下室每孔加入600 μL 含10% FBS 的RPMI 1640 培养基,放入37 ℃5% CO2细胞培养箱中继续培养24 h。取出Transwell 小室,用棉签擦去上层未迁移的细胞,灭菌的PBS 清洗三次,4%多聚甲醛固定20 min,结晶紫染色15 min。显微镜下观察,每孔随机选取5 个视野拍照并计数,这些视野中细胞的平均值为Transwell 小室细胞迁徙的细胞数目。
1.7 Western blot 检测用RIPA 裂解液提取胎盘组织和HTR-8/SVeno 细胞的总蛋白,BCA 试剂盒测定蛋白浓度。将蛋白样品与6×SDS 蛋白上样缓冲液混匀后煮沸10 min。取变性蛋白40 μg/每孔上样至10%SDS-PAGE 凝胶中进行电泳分离蛋白,将分离的蛋白样品200 mA 恒流电转至PVDF 膜上。转膜后,将PVDF 膜放入含5%脱脂奶粉的封闭液中封闭2 h,接着加入稀释好的Sirt1、MMP-2、MMP-9、GAPDH(1∶1 000)一抗,4 ℃孵育过夜。用TBST 洗膜3 次,每次10 min。随后,加入稀释的山羊抗兔二抗(1∶2 000)室温下孵育1 h。再次用TBST 洗膜3次,按照ECL试剂盒说明书配制发光液,加ECL 发光液将PVDF 膜均匀覆盖,用Bio-Rad 成像仪显影,Image J 软件分析条带的灰度值,以GADPH 为内参进行定量的分析。
1.8 统计学方法采用SPSS 22.0 软件进行统计分析,所有实验均重复3 次,所有数据均以均值±标准差表示,组间差异采用单因素方差分析并进行t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 子痫前期患者胎盘组织中miR-155-5p及Sirt1的表达通过RT-qPCR 检测胎盘组织中miR-155-5p 和Sirt1 mRNA 水平,结果表明与正常患者相比,子痫前期患者的胎盘中miR-155-5p 的表达水平显著增加(图1A),而Sirt1 mRNA 水平明显降低(图1B),见表2 。子痫前期患者中miR-155-5p 和Sirt1 mRNA呈负相关(r=-0.636 6,P=0.016 9),见图1C。进一步进行蛋白质免疫印迹实验,结果显示,与正常组相比,子痫前期组中Sirt1 蛋白水平降低(P<0.01),见图1D。
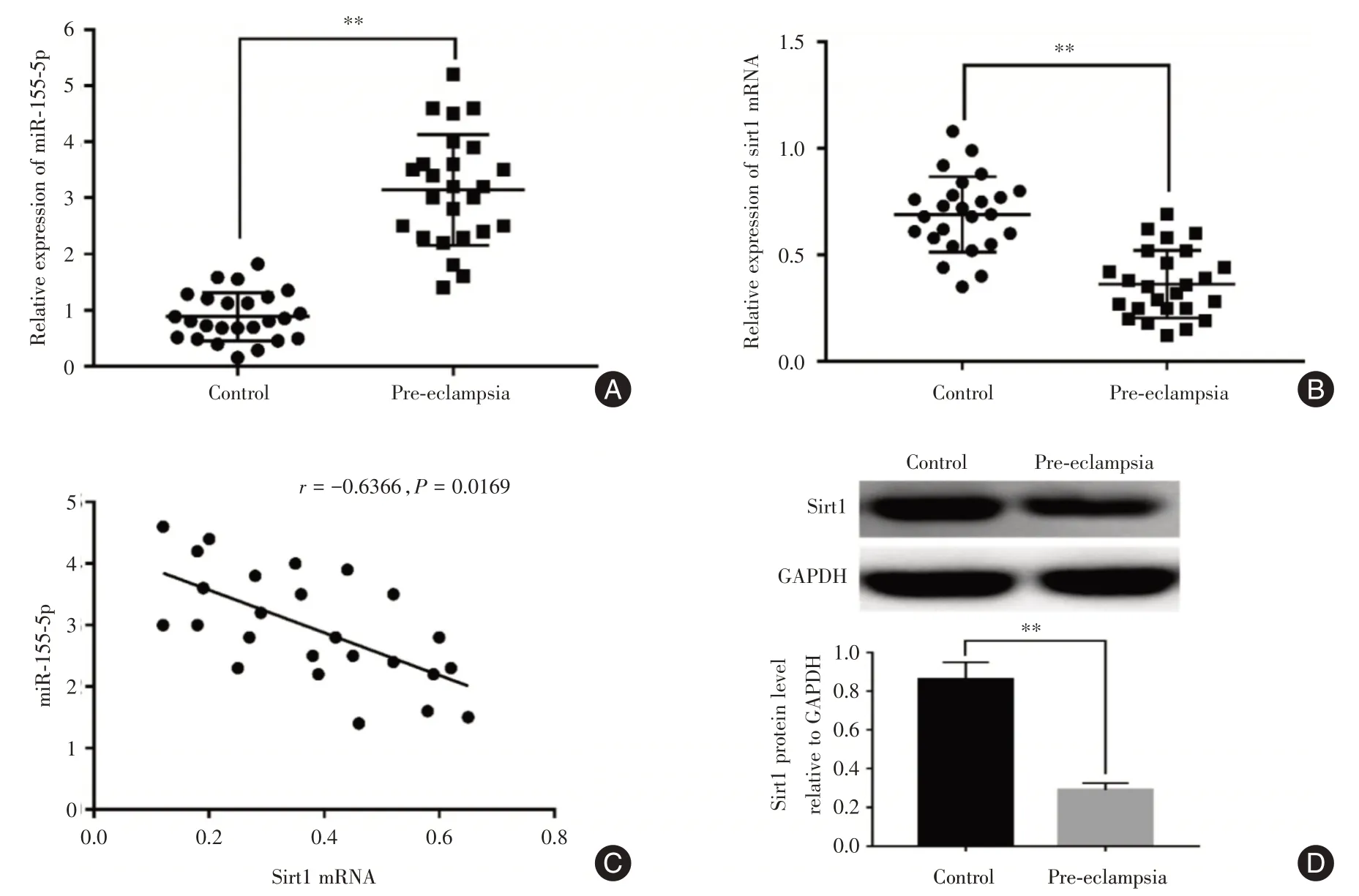
图1 miR-155-5p 和Sirt1 在子痫前期患者胎盘组织中的变化Fig.1 Changes of miR-155-5p and Sirt1 in placenta tissue of patients with pre-eclampsia
表2 样本miR-155-5p 和Sirt1 mRNA 表达比较Tab.2 Comparison of miR-155-5p and Sirt1 mRNA expression in samples ±s

表2 样本miR-155-5p 和Sirt1 mRNA 表达比较Tab.2 Comparison of miR-155-5p and Sirt1 mRNA expression in samples ±s
组别对照子痫前期t 值P 值miR-155-5p 0.88±0.09 3.14±0.19 10.49<0.000 1 Sirt1mRNA 0.69±0.04 0.36±0.03 6.89<0.000 1
2.2 miR-155-5p 抑制Sirt1 的表达通过miR-155-5p 转染HTR-8/SVneo 细胞,然后采用RT-qPCR 检测miR-155-5p 的表达水平。miR-155-5p mimics 组中miR-155-5p表达水平比miR-155-5p mimics NC组中显著升高(图2A)。见表3。另外,通过RT-qPCR和Western blot 检测Sirt1 的mRNA 和蛋白在miR-155-5p 过表达模型中的表达情况。结果显示,Sirt1 mRNA 水平在miR-155-5p mimics 组中明显低于mimics NC 组(图2B),见表3,并且Sirt1 的Western blot 结果与它的mRNA 变化趋势一致。另外,相对于mimics NC 组,MMP-2 和MMP-9 的表达 在miR-155-5p mimics 组中显著增加(图2C、D)。见表4。

图2 在HTR-8/SVneo 细胞中过表达miR-155-5p 对Sirt1 的影响Fig.2 Effects of over-expression of miR-155-5p on Sirt1 in HTR-8/SVneo cells
表3 miR-155-5p mimics 转染效率检测Tab.3 Detection of miR-155-5p mimics transfection efficiency±s

表3 miR-155-5p mimics 转染效率检测Tab.3 Detection of miR-155-5p mimics transfection efficiency±s
组别miR-155-5pSirt1 mRNA mimics NC1.06±0.091.02±0.05 mimics t 值P 值3.25±0.14 12.83<0.001 0.51±0.05 7.16 0.002
表4 蛋白免疫印迹分析Sirt、MMP-2和MMP-9蛋白的表达Tab.4 Western blot analysis of Sirt,MMP-2 and MMP-9 protein expression ±s

表4 蛋白免疫印迹分析Sirt、MMP-2和MMP-9蛋白的表达Tab.4 Western blot analysis of Sirt,MMP-2 and MMP-9 protein expression ±s
组别Sirt1MMP-2MMP-9 mimics NC0.62±0.090.28±0.020.22±0.03 mimics t 值P 值0.42±0.0.05 3.57 0.020 0.38±0.02 2.83 0.047 0.31±0.05 2.82 0.048
2.3 miR-155-5p 抑制滋养层细胞侵袭和迁移为了进一步阐明miR-155-5p 在滋养细胞中的功能,通过Transwell 侵袭试验确定miR-155-5p 对滋养层细胞侵袭的影响,mimics NC 组单位面积滋养细胞的侵袭数量(41.85 ± 5.41)个,而miR-155-5p mimics 组的侵袭细胞数目为(18.84 ± 1.54)个,显著高于mimics NC 组(P<0.01),见图3A。通过伤口愈合试验测定miR-155-5p 对滋养层细胞迁移的影响,24 h 后mimics NC 组细胞划痕闭合率为0 h 的(80.64 ± 6.68)%,mimics 组为(20.08 ± 1.25)%,显著低于mimics NC 组(P<0.01),见图3B。以上结果说明miR-155-5p 的过表达显著抑制滋养层细胞的侵袭和迁移能力。

图3 miR-155-5p 抑制滋养层细胞侵袭和迁移Fig.3 miR-155-5p inhibits trophoblast cell invasion and migration
2.4 敲除Sirt1抑制滋养层细胞侵袭和迁移为了进一步验证Sirt1对滋养层细胞侵袭和迁移的影响,使用Sirt1 siRNA 敲除Sirt1 的表达。通过RT-qPCR和Western blot 检测Sirt1 敲除效率表明siRNA NC组中Sirt1 mRNA 的相对水平为(1.12 ± 0.14),siRNA Sirt1 组为(0.32 ± 0.08),远低于siRNA NC 组(P<0.01,图4A);siRNA Sirt1 同样地抑制Sirt1 蛋白的表达(图4B)。通过Transwell 侵袭实验和伤口愈合实验发现,siRNA NC 组单位面积内侵袭细胞数目为(52.82 ± 4.16)个,siRNA Sirt1 组为(24.65±2.24)个,显著低于siRNA NC 组(P<0.01,图4C);siRNA NC组伤口闭合率为(78.82±6.16)%,siRNA sirt1 组伤口闭合率为(30.92±2.56)%,远低于siRNA NC 组(P<0.01,图4D)。上述结果表明敲除Sirt1 显著降低滋养细胞的侵袭和迁移能力。
3 讨论
子痫前期属于妊娠期高血压疾病的一种,是妊娠期特有的疾病,严重影响母婴安全[10],其发病机制尚未明确,但近几十年来其发病机制研究已经取得了很大进展。目前,多数研究结果表明子痫前期的发生与滋养细胞侵袭异常、内皮细胞功能障碍、血管生成失衡等过程密切相关[11]。其中,绒毛外滋养层细胞侵袭失调会导致子痫前期的发生[8]。正常情况下,子宫胎盘动脉被血管内滋养细胞侵袭,并重塑成扩张的,无弹性的管,而不受母体的血管舒缩控制。但是滋养细胞侵袭失调时会出现重构障碍与维持高子宫胎盘血管阻力和宫内生长受限,这些与子痫前期有关[12-13]。本研究站在滋养细胞异常侵袭的角度,阐述失调的miR-155-5p 调控滋养细胞侵袭、迁移的潜在机制。
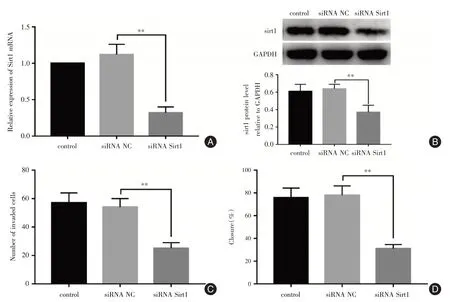
图4 敲除Sirt1 抑制滋养层细胞侵袭和迁移Fig.4 Knockdown Sirt1 inhibits trophoblast cell invasion and migration
有研究对子痫前期患者的胎盘和血清的miRNA 进行高通量测序分析,鉴定出多种差异化表达的miRNA(miR-155、miR-210、miR-1233、miR-520),推测这些异常表达的miRNA 可能通过调控多种靶基因的表达,破坏胎盘的正常发育及其功能,参与子痫前期的发病[7,14-15]。miR-155 在子痫前期患者的胎盘和血清中均表达下降[7],其有望作为子痫前期的预后和诊断的潜在标志物。本研究通过RT-qPCR 检测子痫前期患者胎盘组织,发现子痫前期患者中miR-155-5p 表达显著升高。有研究[16-17]证实,在B 细胞发育过程中,miR-155 靶向Sirt1 参与B 细胞恶性肿瘤的发生。而且,miR-155 参与调控多种癌症的上皮-间充质转化、侵袭和转移[18-19]。然而,在子痫前期中miR-155-5p 与Sirt1 的联系少有报道。本研究通过RT-qPCR 证实,子痫前期患者胎盘中miR-155-5p 表达显著升高而Sirt1 降低,表明miR-155-5p 与Sirt1 可能参与子痫前期的发病过程。而且本研究结果显示miR-155-5p 的表达与Sirt1 表达呈负相关,提示子痫前期患者体内较高水平的miR-155-5p 可能调控Sirt1 的表达参与子痫前期的发生。
滋养层细胞侵袭受到多样途径和多种因子调节,其中沉默信息调节因子1(Sirt1)参与调控过程。Sirt1 是NAD+依赖的蛋白质脱乙酰酶家族和营养传感器的成员。 Sirt1 最初在萌芽的酿酒酵母中发现,是一种能够调节寿命的基因,首先被鉴定为组蛋白脱乙酰基酶,促进染色质紧实并因此在营养缺乏时沉默基因组[20]。到目前为止,已经研究证实了该组蛋白脱乙酰基酶的许多非组蛋白靶标,包括p53、FOXO1 和PPARγ[21]。值得注意的是,Sirt1 被报道参与调节细胞增殖、凋亡、自噬和炎症等生理活动[22-23]。有研究[24]发现Sirt1 缺乏都会导致Epcam +滋养层祖细胞的积累。本研究发现过表达miR-155-5p 可以降低Sirt1、MMP2 和MMP9 蛋白表达,抑制滋养层细胞迁移和侵袭。当敲除Sirt1 时,滋养层细胞迁移和侵袭的能力同样地被抑制。这表明Sirt1 与滋养层细胞侵袭密切相关。
本研究仅初步探讨了miR-155-5p 对滋养层细胞迁移和侵袭的作用机制,不足之处在于研究局限于细胞水平,而未进行体内实验。本课题组在下一步的研究中会探究miR-155-5p 在小鼠子痫前期模型上的调控作用,为miR-155-5p 参与调控子痫前期的发病机制提供更有力的证据。综上所述,在子痫前期患者胎盘组织中miR-155-5p 表达升高和Sirt1 表达降低可能与子痫前期发病相关,miR-155-5p 可能通过抑制Sirt1 表达调节滋养层细胞的迁移和侵袭从而影响子痫前期的发病进程。另外,子痫前期患者胎盘组织中高表达的miR-155-5p 可作为子痫前期的预后和诊断的潜在标志物,而Sirt1 可能成为子痫前期的治疗靶点。

