L-T4 替代治疗妊娠合并SCH 患者的临床效果及有效剂量
刘铭兰 肖黎明 施尉红
1.江苏省如皋市人民医院妇产科,江苏如皋 226541;2.江苏省南通市妇幼保健院妇产科,江苏南通 226006
甲状腺功能疾病是妊娠期常见合并疾病,可由于内分泌功能紊乱造成不良妊娠结局,受到了产科的关注,相关研究[1-2]提示,妊娠合并亚临床甲状腺功能减退(subclinical hypothyroidism,SCH)对妊娠结局具有不良影响。尽管妊娠合并SCH 常无显著临床症状,但仍可增加胎盘早剥、早产及流产等严重并发症的发病率,此外还可在一定程度上影响子代的智力和神经发育[3]。
甲状腺激素缺乏是SCH 发病的主要因素,而左旋甲状腺素作为重要的临床替代治疗药物,对机体相关细胞的生长及发育产生影响,能够提高蛋白酶的活性,并调节机体的新陈代谢[4]。此外,左旋甲状腺素作为内分泌抑制剂能够结合T3受体进而抑制促甲状腺激素(TSH)的分泌,调控TSH 水平。但临床研究[5]提示,长时间不同剂量左旋甲状腺素治疗可能影响治疗效果,还可能造成生理毒性,但研究资料较少。故而,本研究探讨妊娠合并SCH 患者采用L-T4 替代治疗的初始剂量选择及其效果,现报道如下:
1 资料与方法
1.1 一般资料
选取2016 年1 月—2018 年2 月江苏省如皋市人民医院(以下简称“我院”)产科建立产前检查登记并确诊的妊娠合并SCH 患者100 例,根据患者用药剂量,分为高剂量组和低剂量组,每组50 例。纳入标准:①SCH 的诊断标准依据美国甲状腺协会(ATA)相关标准[6]:TSH≥3.00 mU/L,游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)未见异常。②临床表现为皮肤粗糙、水肿、怕冷。③起病孕龄22~34 周。④在我院建立产前检查登记,并在我院接受治疗直至分娩完成。⑤单胎妊娠、头位。⑥研究方案经医院医学伦理委员会批准,与患者本人及其家属签署知情同意书。排除标准:①伴有妊娠期糖尿病、妊娠期肝内胆汁淤积症、妊娠期高血压等其他类型的合并症;②伴有肝炎、结核等传染性疾病;③伴有染色体相关疾病;④严重的心肺功能、凝血系统疾病;⑤对治疗药物具有严重的过敏反应。
高剂量组年龄22~37 岁,平均(27.8±2.2)岁;起病孕龄22~34 周,平均(27.4±2.0)周;孕前平均体重指数(BMI)(22.8±2.0)kg/m2;平均孕次(2.11±0.65)次;平均产次(1.04±0.56)次。低剂量组年龄22~37 岁,平均(27.5±2.0)岁;起病孕龄22~34 周,平均(27.2±2.1)周;孕 前 平 均BMI(22.6±1.9)kg/m2;平 均 孕 次(2.05±0.58)次;平均产次(0.95±0.52)次。两组一般资料比较,差异无统计学意义(P >0.05),具有可比性。
1.2 方法
高剂量组左旋甲状腺素(50 μg/片,齐鲁制药有限公司生产,批号:151203)起始剂量为50 μg,1 次/d;低剂量组起始剂量为25 μg,1 次/d;每2 周复查甲状腺功能并调整药物剂量,待TSH 降低至0.3~3.0 mU/L时停药。
1.3 观察指标及检测方法
全自动生化分析仪检测并比较两组患者治疗前、治疗4 周后(治疗后)的FT3、FT4、TSH、叶酸(FA)、一氧化氮(NO)、内皮素-1(ET-1)水平;超声心动图检测动脉血流介导的内皮依赖性舒张功能(FMD);比较两组妊娠结局、围生儿结局。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差()表示,两组间比较采用t 检验;计数资料用例数或百分率表示,组间比较采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后甲状腺功能指标及FA 水平比较
治疗前两组甲状腺功能指标及FA 水平比较,差异无统计学意义(P >0.05)。治疗后,两组TSH 水平低于治疗前,FA 水平高于治疗前;且高剂量组TSH水平低于低剂量组,FA 水平高于低剂量组,差异均有统计学意义(均P <0.05);治疗后,两组FT3、FT4比较,差异无统计学意义(P >0.05)。见表1。
2.2 两组治疗前后NO、ET-1、FMD 水平比较
治疗前两组NO、ET-1、FMD 水平比较,差异无统计学意义(P >0.05)。治疗后,两组ET-1 水平低于治疗前,NO、FMD 水平高于治疗前;且高剂量组ET-1 水平低于低剂量组,NO、FMD 水平高于低剂量组,差异均有统计学意义(均P <0.05)。见表2。
2.3 两组产科相关并发症的发生情况比较
高剂量组产科相关并发症发生率低于低剂量组,差异有统计学意义(P <0.05)。见表3。
表1 两组治疗前后甲状腺功能指标及FA 水平比较()
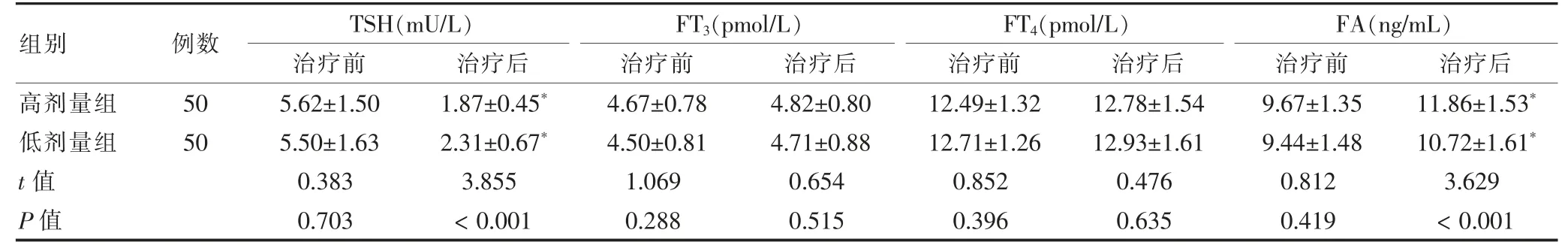
表1 两组治疗前后甲状腺功能指标及FA 水平比较()
注:与本组治疗前比较,*P <0.05。TSH:促甲状腺素;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;FA:叶酸
表2 两组治疗前后NO、ET-1、FMD 水平比较()
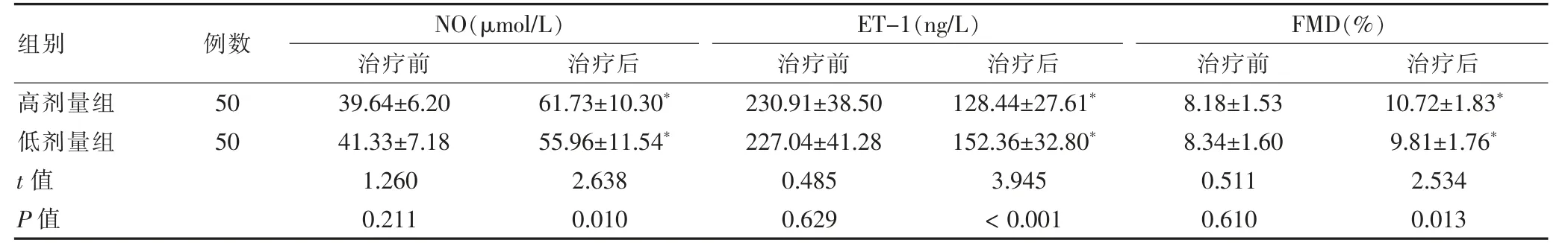
表2 两组治疗前后NO、ET-1、FMD 水平比较()
注:与本组治疗前比较,*P <0.05。NO:一氧化氮;ET-1:内皮素-1;FMD:内皮依赖性舒张功能
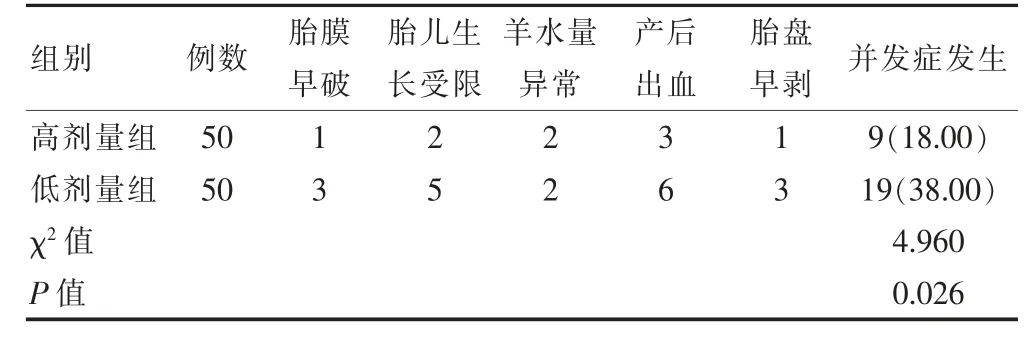
表3 两组产科相关并发症的发生情况比较
2.4 两组胎儿及围生儿不良结局发生情况比较
高剂量组胎儿及围生儿不良结局总发生率低于低剂量组,差异有统计学意义(P <0.05)。见表4。
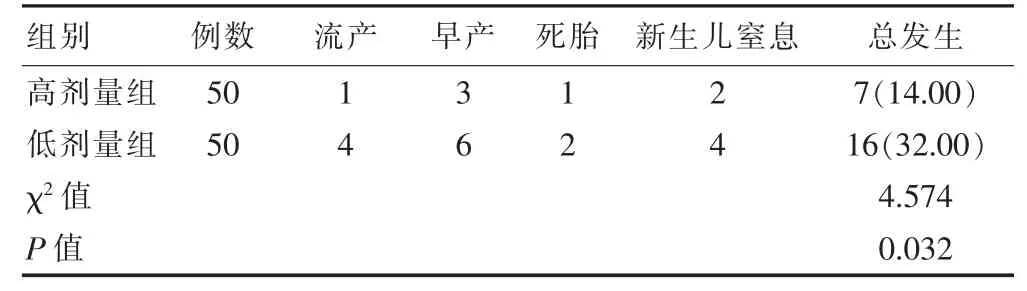
表4 两组胎儿及围生儿不良结局发生情况比较
3 讨论
我国妊娠合并SCH 具有较高发病率,可达3%左右,存在孕期TSH 及血清人绒毛膜促性腺激素升高及血清甲状腺素结合球蛋白水平升高的表现,导致血清甲状腺素(TH)水平增加及造成甲状腺及相关内分泌系统发生多种代谢紊乱,诱发不良的妊娠结局[7-10]。相关研究[11-14]发现,SCH 孕妇早产儿发生率为正常孕妇的2 倍,胎盘早剥的概率是正常孕妇的3 倍。
L-T4 替代治疗是妊娠期甲状腺功能减退患者的重要方法且剂量应较非妊娠患者增加,现临床诊断甲状腺功能减退症患者L-T4 通常以25~50 μg/d 为初始剂量[9]。但相关研究[15-18]提示,由于胎儿的自身甲状腺尚未发育成熟,而大脑神经正处于快速发育的状态,大脑发育所需的TH 主要依赖于母体供给;故而临床上L-T4 对妊娠期SCH 患者的治疗建议需要使用略大于正常成人剂量,进而保证胎儿脑神经正常生长的激素量,改善妊娠结局。
本研究结果显示,治疗前两组FT4、FT3、TSH、FA水平比较,差异无统计学意义(P >0.05);但治疗后,高剂量组TSH 水平低于低剂量组,FA 水平高于低剂量组,差异均有统计学意义(均P <0.05)。提示妊娠合并SCH 患者采用50 μg 的L-T4 替代治疗较25 μg能更有效地调节甲状腺素水平。L-T4 含有合成内源甲状腺激素和左甲状腺素的功效,较高剂量的剂量应用能够满足患者的需求,更有助于改善甲状腺功能[19-22]。
本研究结果显示,治疗前两组NO、ET-1、FMD 水平比较,差异无统计学意义(P >0.05);治疗后,高剂量组ET-1 水平低于低剂量组,NO、FMD 水平高于低剂量组,差异均有统计学意义(均P <0.05)。提示妊娠合并SCH 患者采用50 μg 的L-T4 替代治疗较25 μg能更有效的改善内皮功能。甲状腺激素是动脉粥样硬化的重要危险因素,能够促进脂肪的降解和合成,可能通过造成脂类代谢紊乱而影响脂肪组织相关因子的分泌,进而诱发慢性炎性,而炎症状态下由于血管内皮损伤可使ET-1 表达升高,NO 和FMD 下降[23-28]。L-T4 替代治疗能够有效弥补甲状腺功能的失调和调节脂质因子代谢,进而改善血管内皮功能。
本研究结果显示,高剂量组产科相关并发症发生率低于低剂量组,差异有统计学意义(P <0.05)。提示妊娠合并SCH 患者采用50 μg 的L-T4 替代治疗较25 μg 能更有效地降低产科并发症。L-T4 替代治疗能够更有效地弥补孕早期过程中甲状腺激素减少对孕妇的影响,进而降低甲状腺激素分泌下降造成的神经、精神发育障碍,改善大脑分化不良情况,进而降低产科并发症发生率。
本研究结果显示,高剂量组胎儿及围生儿不良结局总发生率低于低剂量组,差异有统计学意义(P <0.05)。提示L-T4 替代治疗能够更有效地参与机体发育,妊娠早期胎儿甲状腺组织由于发育不全需要从母体获得更多的甲状腺激素以满足脑部发育,而较高剂量的L-T4 替代治疗能够有效弥补妊娠合并SCH 患者甲状腺激素不足的情况,进而改善妊娠结局。
综上所述,妊娠合并SCH 患者采用50 μg 的L-T4 替代治疗较25 μg 能更有效地调节甲状腺素水平、内皮功能,对于降低产科并发症、胎儿及围生儿不良结局发生率具有积极作用。

