岩藻糖基转移酶Ⅱ、Ⅲ基因多态性的研究进展
赵毛毛,庞灏
(中国医科大学法医学院法医物证教研室,沈阳 110122)
岩藻糖基转移酶(fucosyltransferase,FucT)是一类催化岩藻糖基向寡糖、糖蛋白、糖脂上的糖链转移的生物合成酶,属于糖基转移酶超家族,在真核细胞和原核细胞均有表达[1-2]。岩藻糖基化聚糖参与信号转导、宿主与微生物相互作用、受精、炎症反应、癌症进展以及转移等生理学和病理学过程[3]。目前共发现13种FucT,分别由13个基因编码[3]。根据酶反应形成的糖苷键类型可将FucT分为α(1,2)岩藻糖基转移酶(FucT-Ⅰ和 FucT-Ⅱ)、α(1,3/1,4)岩藻糖基转移酶(FucT-Ⅲ和FucT-Ⅴ)、α(1,3)岩藻糖基转移酶(FucT-Ⅲ~Ⅶ和FucT-Ⅸ)、α(1,6)岩藻糖基转移酶(FucT-Ⅷ)、蛋白-O-岩藻糖基转移酶(FucT-Ⅻ和FucT-)[4],其中FucT-Ⅱ和FucT-Ⅲ与人类血型密切相关,具有重要的生物学意义。此外,编码FucT-Ⅱ和FucT-Ⅲ的基因FUT2、FUT3不仅具有高度多态性,还有明显的种族和地理区域差异性,因此FUT2和FUT3基因多态性成为遗传学和法医学领域关注的热点。FUT2和FUT3基因变异与多种疾病显著相关,由其介导产生的血型抗原参与多种微生物感染,并且两者联合影响体内肿瘤标志物的水平。现就FUT2和FUT3基因多态性在基因水平、酶蛋白水平、酶相关产物水平的研究进展进行综述。
1 α(1,2)岩藻糖基转移酶
1.1FucT-Ⅰ和FucT-Ⅱ参与的生物合成过程 人类H血型系统和Lewis血型系统的抗原并不是相应基因的直接产物,而是来源于前体物质,这个前体物质的实质是一系列单糖有顺序连接形成的寡糖链,而形成寡糖的单糖一共有7种:葡萄糖、半乳糖(galactose,Gal)、甘露糖、N-乙酰葡萄糖胺(acetylglucosamine,GlcNAc)、N-乙酰半乳糖胺、岩藻糖和N-乙酰神经氨酸[5]。根据糖的种类和二糖之间糖苷键的连接方式可分为6种类型[6]。FucT会以碳-碳单键键合的方式将岩藻糖连接在前体物质糖链末端的单糖上,从而形成对应的特异抗原。α(1,2)岩藻糖基转移酶主要对应Ⅰ型(Galβ1-3GlcNAc-)和Ⅱ型(Galβ1-4GlcNAc-)前体物质。
α(1,2)岩藻糖基转移酶分为FucT-Ⅰ(H酶)和FucT-Ⅱ(Se酶),其通过在岩藻糖的1号碳原子与Gal的2号碳原子之间形成糖苷键,将岩藻糖基转移到Ⅰ型和Ⅱ型糖链末端的Gal上,由于基因在组织中选择性表达,FUT1主要在红细胞中表达,并作用于Ⅱ型糖链形成红细胞膜表面的H抗原,而FUT2主要在呼吸道黏膜、消化道黏膜以及分泌腺中表达,作用于Ⅰ型糖链形成分泌液中的H抗原[7-10]。无论是红细胞膜还是分泌液中的H抗原,其形成的前提条件是H酶和Se酶均有活性,当H酶和Se酶均失活时,则形成经典的孟买型表型,红细胞膜和分泌液中均无H抗原,个体的基因型是(h/h;se/se);只有H酶失活,红细胞膜上不表达H抗原,而分泌液中的H抗原正常分泌,这样的个体被称为para-孟买型,个体的基因型是(h/h;Se/Se)或(h/h;Se/se);相反,当只有Se酶失活,红细胞膜上有H抗原,而分泌液中无H抗原,这样的个体被称为非分泌型,基因型是非分泌型基因的纯合子(se/se)[11]。
1.2FucT-Ⅱ活性缺失的分子机制 非分泌型个体的FUT2的单核苷酸多态性(single nucleotide polymorphism,SNP)、假基因融合、编码区完全缺失3种类型的突变会导致FucT-Ⅱ失活。FUT2基因编码区所有的SNP以及突变所造成的氨基酸替换对编码蛋白影响的预测结果,见网络版的附件1。FUT2基因结构具有以下两种特性:首先,FUT2及其假基因序列相似程度高,定位于19q13.3约30 kb范围内。研究人员发现了一个融合基因sefus,其是由FUT2假基因5′端与FUT2的3′端融合而成,目前sefus为日本人群所特有[12]。另外,FUT2的基因组区富含穿插的Alu及长末端重复等重复元件。目前,共发现3种缺失变异sedel、sedel2、sedel3,这3种缺失变异是由Alu介导的编码区的完全缺失,而另一个sedel4则是由长末端重复介导[13-16]。上述4种缺失变异均具有明显的人群特异性,是法医学族源推断良好的遗传标记。
1.3FUT2点突变的人类遗传学分析 FUT2多态性分析表明,无论功能性还是非功能性等位基因都具有种族特异性。FUT2位点4个主要等位基因的人群频率分布比较,见图1[12,15,17-28],非功能性等位基因se428主要分布在非洲和欧洲人种中,而se357,385在东亚、东南亚人群中占主导地位;人群分布中具有明显差异性的等位基因(se428、se357,385)在南亚的孟加拉国人和中国维吾尔族人中均占有一定比例,由此推测孟加拉国人和中国维吾尔族人混合了欧洲人和东亚人两种血统;与野生型等位基因Se相比,功能性等位基因Se357在人群中分布频率更高,且分布范围更广;se357,385等位基因在欧洲和非洲人种中是缺失的,提示385位点的突变可能是在人类进化过程中较晚出现在亚洲人群的。通过以上分析说明,FUT2基因多态性能为人类遗传学研究提供更多有价值的信息。
1.4FUT2变异与人类疾病的关系 近年来有研究证明了FUT2 的多个SNP与克罗恩病[29-30]、溃疡性结肠炎[31-32]、乳糜泻[33]、1型糖尿病[34]、银屑病[35-36]、白塞病[37]、肝细胞癌[38]及原发性硬化性胆管炎[39]关系密切,其中3个导致酶失活的SNP[428G>A(rs601338)、385A>T(rs1047781)、739G>A(rs602662)]与疾病的关联性最强。一方面,非功能性等位基因纯合突变个体(se428/se428)不仅对白色念珠菌[40]、链球菌[41]、脑膜炎奈瑟菌[40]的易感性增强,且患克罗恩病[30]、慢性胰腺炎[42]、乳糜泻[33]和1型糖尿病(日本人se385/se385)[43]的风险增加。另一方面,非分泌型个体也有多方面优势。一项关于中国西北部地区汉族和维吾尔族人群的研究显示,非分泌型个体(se428/se428或se357,385/se357,385)不易患溃疡性结肠炎[32],且具有抵抗诺如病毒感染的能力,但对GⅡ型诺如病毒具有完全的保护作用[44]。Kindberg等[45]报道,428位点非分泌型等位基因A与人类免疫缺陷病毒感染者的疾病发展进程减慢相关。由此可见,非分泌型个体利弊兼具,在人群中广泛存在并在人类进化过程中保持一定的比例。因此未来对非分泌型个体与疾病的关联研究将有助于针对性地预防和治疗疾病。
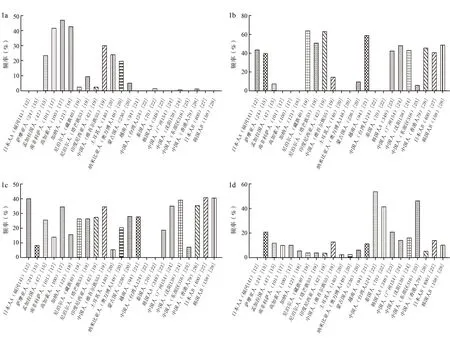
图1 FUT2位点se428(1a)、se357,385(1b)、Se357(1c)、Se(1d)等位基因的人群频率分布比较
2 α(1,3/1,4)岩藻糖基转移酶
2.1FucT-Ⅲ所参与的生物合成过程 FucT-Ⅲ~Ⅶ、 FucT-Ⅸ均可以α(1,3)碳碳单键键合的方式将岩藻糖基转移到前体物质糖链末端N-乙酰葡萄糖胺的3号碳原子上,其中FucT-Ⅲ和FucT-Ⅴ既可以将岩藻糖基转移到3号碳原子上,也可将其转移到4号碳原子上,因此将其命名为α(1,3/1,4)岩藻糖基转移酶[46]。当FucT-Ⅲ发挥α(1,4)糖苷键键合作用时,其作用底物是Ⅰ型前体物质。FucT-Ⅱ也是以Ⅰ型前体物质作为作用底物。当FucT-Ⅲ催化GDP-岩藻糖中的L-岩藻糖转移到Ⅰ型前体物质时即形成路易斯a抗原(Lewis a,Lea),个体表型为Le(a+b-);而当FucT-Ⅱ 先作用于 Ⅰ 型前体物质,在形成H抗原后,再由FucT-Ⅲ 作用于H抗原则形成路易斯b抗原(Lewis b,Leb),个体表现为Le(a-b+)。但当同一个体的FucT-Ⅱ和FucT-Ⅲ均有活性时,FucT-Ⅱ的酶活性更大,会优先将Ⅰ型前体物质转变为H抗原,进而形成Leb抗原,其将Ⅰ型前体物质耗尽,导致无法形成Lea抗原,因而分泌型个体的表型是Le(a-b+),如果是弱分泌型个体,其FucT-Ⅱ活性很弱,此个体同时形成Lea和Leb抗原,表型为Le(a+b+)。当FucT-Ⅲ无活性时,无论FucT-Ⅱ是否有活性,其表型为Le(a-b-),由此可见FucT-Ⅲ才是决定Le表型的关键酶,FUT3基因也被称为Lewis基因。
2.2FucT-Ⅲ活性缺失的分子机制 Le表型在不同人群中的分子学基础一直是研究的重点。Koda等[47]调查了2个Le阳性和2个Le阴性个体胃黏膜的Lewis转移酶发现,决定两种表型产生的Lewis转移酶信使RNA的水平相同,证明Lewis转移酶基因结构上的缺陷导致了Le的阴性表型,而不是其表达水平。后续对Lewis基因进行深入研究发现,具有Le(a-b-)红细胞表型的分子学基础不是纯一的[25]。根据目前数据库和文献记载,造成Lewis酶活性丢失的分子机制分别为SNP、插入、缺失。
Lewis基因编码区所有的SNP以及氨基酸替换对酶活性影响的预测结果,见网络版的附件2。Lewis酶呈Ⅱ型膜蛋白拓扑学结构,由胞质区(1~24 bp)、跨膜区(25~75 bp)、干区(76~276 bp)和C端酶催化区(277~1 086 bp)组成[48]。发生在以上区域的SNP会不同程度的影响酶活性,从表中可以发现:与N端相比,造成酶活性丢失的变异点更多分布在C端。一项蛋白截断研究显示,去除N端一部分氨基酸序列(50~70个氨基酸)不会影响酶活性,而去除C端仅几个氨基酸就会造成酶活性的完全丧失[49]。研究人员调查人群中Lewis阴性表型的分子学基础过程中对一些SNP的功能意义进行了探索,其中有两种SNP(S124A、L149M)和预测结果(3种软件:PROVEAN、PolyPhen2、SIFT)不一致[50],提示单核苷酸变异软件预测结果仅能预测整体趋势,而具体导致酶活性丧失的氨基酸序列或氨基酸替换还需依赖酶蛋白空间晶体结构进行判断。目前按照Lewis酶蛋白膜定位定义的催化区(62~361)不够精确,因为发生在此区域的变异可能不影响酶活性,而发生在N端胞质区、跨膜区和干区的SNP会影响酶活性。如跨膜区的突变59T>G未损害酶的催化活性,但可影响酶在高尔基体膜上的定位,降低酶的利用率[47]。酶蛋白正常发挥功能需要以下几个功能区,包括供体底物的结合区、受体底物的特异性识别区、催化区以及酶蛋白自身的翻译后修饰点等,发生在以上几个功能区的SNP可影响酶活性。因此,获得酶蛋白的空间结构是未来研究的关键。
2.3FUT3基因点突变的人类遗传学分析 Lewis基因具有明显的种族差异性和地理区域特异性,le202,314、le59,508、Le59、le59,10674个等位基因人群频率分布比较情况见图2[24-25,27,50-55]。首先,le202,314等位基因在代表白色人种的高加索人中频率最高;而在代表东方人种的中国人中频率较低,韩国人和日本人甚至缺失le202,314;非洲科萨人、加纳人频率分布趋于两者之间。值得注意的是,le202,314在巴基斯坦人群中的频率分布与高加索人基本持平。综合le59,1067的频率分布特征,Zhao等[50]得出结论,巴基斯坦人群的Lewis基因频率分布特征最接近于高加索人。le59,508等位基因最显著的特点是高加索人频率较低,几乎缺失该等位基因,其主要分布在亚洲和非洲人种中。联合le202,314、le59,508两种等位基因频率分布即可区分高加索人和非洲科萨人。Le59在亚马孙人群中频率分布显著高于其他人群,提示该等位基因可能起源于亚马孙地区。根据le59,1067等位基因的分布特征,可以看到同种人群的频率分布差异较大,其分布特点有待进一步加大样本量以及扩展人群后确定。综上所述,Lewis等位基因频率分布特征提示了很多种族进化信息,是遗传学研究的重要基因。
2.4FUT3基因变异与人类疾病的关系 同FUT2一样,多项研究表明FUT3基因变异与结肠癌[28]、消化性溃疡、萎缩性胃炎[56-57]、溃疡性结肠炎[31]、克罗恩病[58]以及冠心病[59]等疾病有关。Hu等[31]的研究发现,与正常对照组相比,FUT3基因508G>A位点的突变基因A和基因型AA在溃疡性结肠炎患者中的频率明显升高。59T>G和508G>A两个SNP还与溃疡性结肠炎和克罗恩病的病变位置有关[58]。Djoussé等[60]报道,59T>G位点GG基因型受试者患动脉粥样硬化血栓性疾病的风险是TT基因型受试者的6.7倍。此研究结果佐证了Lewis(a-b-)表型患冠心病风险增加的结论[59]。以上研究表明,FUT2、FUT3基因变异可能与消化系统疾病的关联性更强,但与FUT2相比,FUT3与疾病的关联研究尚未广泛开展,需要进一步研究与探讨。
3 FUT2和FUT3基因联合分型的意义
3.1组织血型抗原与体内微生物群感染的相关性 FUT2和FUT3基因影响机体肠道菌群的组成,因为FUT2和FUT3基因控制胃肠道黏膜和体液中组织血型抗原(包括H抗原和Le抗原)的表达,上述抗原不仅是胃肠道菌群(幽门螺杆菌、空肠弯曲杆菌、诺如病毒、轮状病毒)的结合点,还是一些菌群的碳源[31,61]。幽门螺杆菌表达一种血型抗原结合黏附素,该物质与健康人胃黏膜上皮细胞表面的I-H抗原和Leb抗原结合,从而介导幽门螺杆菌感染人体的过程[56]。轮状病毒和诺如病毒是世界范围内造成儿童急性胃肠炎的最主要病因,这两种病毒属均与个体的分泌状态和Lewis表型相关。据报道,I-H抗原和Leb抗原是P8轮状病毒株的受体[62]。在布基纳法索,P8轮状病毒株和GⅠ型诺如病毒仅感染Le和Se抗原双阳性儿童,不感染Le抗原阴性儿童,P6轮状病毒株主要感染Le抗原阳性儿童,与个体分泌状态无关,而GⅡ型诺如病毒易感染分泌型个体,却不依赖于Lewis分泌状态[63-64]。因此,FUT2和FUT3基因联合分型有助于识别对微生物感染相关疾病具有高风险的个体,从而设计出具有针对性的根治感染的治疗策略。
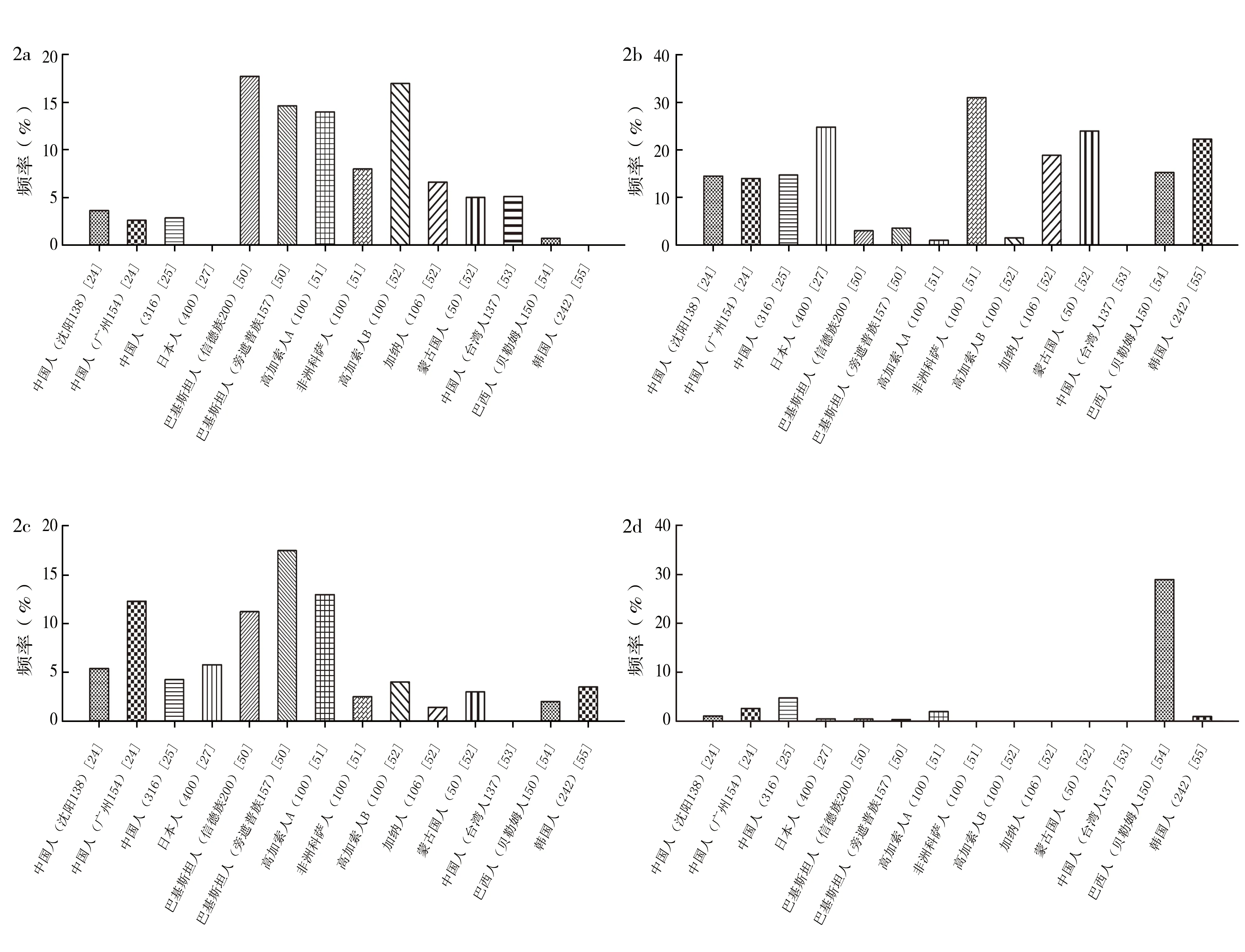
图2 FUT3位点le202,314(2a)、le59,508(2b)、le59,1067(2c)、Le59(2d)等位基因的人群频率分布比较
3.2FUT2和FUT3基因型联合影响体内肿瘤标志物的水平 FUT2和FUT3基因协同调控血清中糖类抗原(carbohydrate antigen,CA)19-9和癌胚抗原(carcinoembryonic antigen,CEA)两种肿瘤标志物的水平[25,65-67]。研究发现,Lewis功能性等位基因纯合子(Le/Le)体内CA19-9的水平明显高于杂合子个体(Le/le);Le抗原阴性个体中未检测到CA19-9;Le抗原阳性的非分泌型个体(Le/se)血清CA19-9水平最高[25]。而另一项研究显示,Le抗原阳性的FUT2基因428位点突变纯合子个体(se428/se428)血清CEA水平最高,野生型纯合子个体(Se/Se)最低,杂合子个体(Se/se428)介于两者之间,说明CEA水平与非分泌型等位基因se428的剂量密切相关,Le抗原阴性个体血清CEA的上述变化趋势更加明显[65]。以上研究说明,FUT2和FUT3基因变异联合影响体内肿瘤标志物的水平,而近年的一项研究进一步佐证了这一结论,该研究根据FUT2和FUT3基因分型设定CA19-9界值,结果发现CA19-9检测提高了诊断胰管腺癌的灵敏度,特别是在Le抗原阳性组中,诊断灵敏度从52.7%提高到66.4%[66]。因此在未来针对不同人群,选择FUT2和FUT3基因上特异性SNP,在联合分型的基础之上选择不同的肿瘤志物以及定义肿瘤标志物的界值可能会大大提高肿瘤标志物的诊断效能。
4 结 语
近年来,随着DNA测序技术的发展,研究人员在FUT2和FUT3基因编码区识别出大量新的SNP,并发现FUT2和FUT3基因多态性研究不仅在遗传学领域和法医学领域具有重要意义,在临床疾病的研究和实践中同样具有重要价值,尤其是FUT2和FUT3基因联合分型对疾病的诊断和治疗均至关重要。非分泌型及Le抗原阴性表型在经历长期的自然选择后,能够在多种人群中稳定保持一定的比例,相信必然有其存在的意义,但需要进一步研究和探索。未来将对FUT2和FUT3基因多态性与消化系统疾病的关联机制进行深入研究,以期为消化系统疾病的治疗提供指导。
(文中附件1和附件2图形内容复杂,详见中国知网网络版)

