比较在肉汤及人工痰液培养基中多黏菌素E对鲍曼不动杆菌的杀菌效果
曲星伊,刘笑芬,卞星晨,陈渊成,张 菁
鲍曼不动杆菌(Acinetobacter baumannii)是医院感染的重要致病菌之一[1-2],2018年CHINET数据显示其对常见碳青霉烯类抗生素耐药率已超过70%[3]。鲍曼不动杆菌几乎存在于所有环境中[4],由于具有对干燥和潮湿环境的抵抗力、对消毒剂和抗生素的耐受性以及在医疗器械表面定植并形成生物膜的特性[5-9],因而能在医疗机构中稳定存在并传播。Rodman等[10]发现胸腔液诱导鲍曼不动杆菌丙酮酸和苯丙氨酸代谢增强,会影响上皮细胞生存并增强鲍曼不动杆菌对巨噬细胞的毒性,产生细胞毒性和免疫逃逸现象。Di Venanzio等[11]采用体外尿液培养鲍曼不动杆菌时,低毒力菌株生长量和生长速率均低于高毒力菌株,但是在营养丰富的LB培养基和脑心浸液肉汤培养基(brain heart infusion,BHI)中,不同毒力菌株的生长曲线差异不大。因此,模拟真实的人体环境有利于更好地认识细菌对人体的作用,使临床前体外实验更接近于临床实际,但目前相关研究较少。
药动学/药效学(PK/PD)数学模型是利用计算机模拟技术描述药物对细菌杀菌作用的方法。通过建立数学模型描述细菌的生长情况、药物浓度变化获得拟合参数,可用于评价药物杀菌作用[12],为临床抗菌药物给药方案设计提供依据[13]。
由于现有抗菌药物难以满足细菌不断进化出的新型耐药机制[14],多黏菌素类抗生素不得不被重新使用并成为了治疗鲍曼不动杆菌感染的最后一道防线[15-16]。本研究以模拟人体痰液的培养基代替常用的阳离子调节MH肉汤(CAMHB),探索不同培养基中多黏菌素E对碳青霉烯类抗生素耐药的鲍曼不动杆菌(carbapenem-resistantAcinetobacter baumannii,CRAB)的杀菌效果,并基于时间杀菌曲线建模和模拟,以定量方法进一步评价多黏菌素E的杀菌作用,为今后实验研究和临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 细菌菌株 共选用3株细菌:2株CRAB菌株分别分离自华山医院感染患者(菌株编号AB170428)和多中心临床研究受试者(菌株编号AB070311),1株质控菌株为大肠埃希菌ATCC 25922。
1.1.2 抗菌药物 抗菌药物选用多黏菌素E硫酸盐(批号SLBD8306V,效价78.6%,Sigma-Aldrich公司)、美罗培南(批号130506-201403,效价87%,中国食品药品检定研究院标准品)和多立培南(批号0379,效价99.8%,盐野义制药株式会社)。
1.1.3 培养基 本实验使用CAMHB(Becton Dickinson公司)和人工痰液培养基(ASM,自行配制,配制方法详见1.2.2)。
1.2 实验方法
1.2.1 药敏试验 采用肉汤微量稀释法测定多黏菌素E、美罗培南、多立培南对CRAB的最低抑菌浓度(MIC),大肠埃希菌ATCC 25922为质控菌株。多黏菌素E的浓度范围为0.125~16 mg/L,美罗培南和多立培南的浓度范围为0.25~256 mg/L。药敏试验判断标准参照美国临床与实验室标准化协会(CLSI)2019年版标准:多黏菌素E,MIC≤2 mg/L判定为敏感,MIC≥4 mg/L判定为耐药;美罗培南和多立培南,MIC≤2 mg/L判定为敏感,MIC 4 mg/L判定为中介,MIC≥8 mg/L判定为耐药。
1.2.2 ASM的配制 使用无菌蒸馏水做溶剂,配制每升体积中包含鱼精DNA(4 g)、猪胃Ⅱ型黏蛋白(5 g)、蛋黄乳液(5 mL)、20种L型必需和非必需氨基酸(每种0.25 g)、KOH(0.7014 g)、DTPA(5.9 mg)、NaCl(5 g)、KCl(2.2 g)的培养基,调节pH至6.9,0.22 μm除菌过滤器(Merck公司)负压过滤除菌[17]。现配即用。
1.2.3 静态杀菌曲线 将鲍曼不动杆菌分别在10 mL新鲜配制的CAMHB和ASM中培养。在INNOVA 4200 摇床中37℃ 150 r/min条件下预培养1 h后进行菌落计数并记为时间0点,加入不同浓度的多黏菌素E后继续在摇床中培养。在0、1、2、4、6、8、24 h分别进行菌落计数。在CAMHB和ASM中培养的鲍曼不动杆菌分别在20~24 h和40~48 h后记录细菌菌落数。检测下限为2 lgCFU/mL。每组实验重复3次。以每毫升菌落形成单位的对数值随时间变化作杀菌曲线,计算24 h与0 h菌落数的对数差,若对数差≥3 lgCFU/mL则认为有完全杀菌作用[18]。
1.2.4 建立PK/PD模型并预测杀菌效果
1.2.4.1 CAMHB中的数学模型 ①生长模型 在CAMHB中的细菌增长用微分方程描述:

其中Bt代表细菌密度,是时间t的函数;Bmax代表最大细菌密度。knet是细菌的净生长速率常数。
②多黏菌素E的PD模型Emax模型是一种常用的非线性剂量反应模型。在经典的SigmoidEmax模型基础上引入适应性耐药因子α。经若干次寻优后确定的模型方程为:

其中
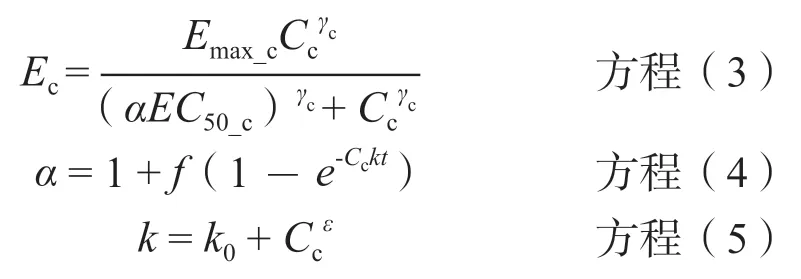
Ec代表多黏菌素E的杀菌速率,Emax_c为多黏菌素E的最大杀菌速率常数,EC50_c为达到1/2Emax_c时多黏菌素E的浓度。Cc为多黏菌素E的浓度,在24 h范围内恒定。γc为多黏菌素E的希尔系数。α为适应性耐药因子,随药物作用时间t的延长和浓度Cc的增加而逐渐增加最终接近饱和值。f为最大适应因子,k为适应性耐药率,与基线耐药率k0和药物浓度Cc有关,常数ε为药物浓度Cc的指数。
1.2.4.2 ASM中的数学模型
①生长模型 实验中观察到与CAMHB相比,ASM中细菌数目增长存在延迟。因此模型中引入延迟作用因子:
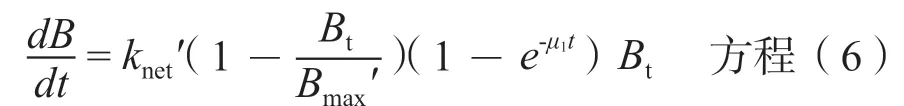
knet'和Bmax'分别代表细菌在ASM中的净生长速率常数和最大细菌密度,μ1为生长滞后效应因子,由于营养物质的限制等因素导致的生长延迟用(1-e-μ1t)进行校正。

②多黏菌素E的PD模型Ec_lag代表ASM中多黏菌素E的延迟杀菌速率,Ec是多黏菌素E在CAMHB中的杀菌速率,(1-e-μ2t)为药物效应延迟校正函数,μ2代表药物滞后效应因子。
1.2.4.3 模型建立与预测 使用MATLAB (R2019a)拟合杀菌曲线、预测药物效应以及绘制图像。用函数ODE45积分,interp1线性差值做近似,利用lsqnonlin函数使残差平方和最小的原理做非线性最小二乘法求得参数。通过目测检查、比较残差平方和大小以及相关参数是否符合实际情况,综合确定最优参数值。通过绘制实测值与拟合值组合图,判断拟合效果。
利用模型预测鲍曼不动杆菌菌株在恒定抗生素浓度时的菌落数随时间变化的曲线。多黏菌素E的最高暴露量为平均稳态血药浓度2 mg/L,更高的浓度将增加急性肾损伤的风险[19],因此模拟多黏菌素E最高浓度选择2 mg/L。
2 结果
2.1 药敏试验
AB170428和AB070311菌株对多黏菌素E均敏感,MIC分别为0.5 mg/L和1 mg/L;对美罗培南均耐药,MIC分别为16 mg/L和64 mg/L;对多立培南均耐药,MIC分别为32 mg/L和64 mg/L。
2.2 静态杀菌曲线
在CAMHB和ASM中,不同浓度多黏菌素E的杀菌曲线见图1。在CAMHB中,随着多黏菌素E浓度的递增,杀菌效果增强。0.25 mg/L(即0.5×MIC)的多黏菌素E作用于AB170428后,0~8 h抑菌效果较好,24 h菌落数与0 h持 平;0.5 mg/L(即1×MIC)的多黏菌素E对AB170428具有24 h持续抑菌作用。0.25~1 mg/L(即0.25~1×MIC)的多黏菌素E对菌株AB070311的杀菌效果差别较小,0~8 h时多黏菌素E具有较好的抑菌效果,24 h鲍曼不动杆菌菌落数相较于0 h增加了约3 lgCFU/mL。在ASM中,即使经过了1 h的预培养,没有抗生素作用的细菌仍然增长十分缓慢,在8~10 h到达稳态;1×MIC的多黏菌素E对鲍曼不动杆菌的杀菌效果与CAMHB相当;AB170428的24 h菌落数与0 h接近,AB070311的24 h菌落数相较于0 h下降1 lgCFU/mL。
2.3 PD数学模型拟合及预测
以AB170428菌株为例,在CAMHB中,生长曲线实验数据点分布在拟合曲线上或平均分布在两侧(图2)。多黏菌素E组的菌落数实验数据不够稳定,导致拟合值与实测值稍有偏差,可能与多黏菌素E的异质性耐药性有关。在ASM中,生长滞后效应因子的引入使曲线拟合更贴切。AB070311拟合结果与AB170428类似。

图1 在CAMHB和ASM中不同浓度多黏菌素E对鲍曼不动杆菌的杀菌曲线Figure 1 Time-kill curves of different concentrations of colistin against Acinetobacter baumannii in CAMHB and ASM

图2 不同多黏菌素E浓度下AB170428在CAMHB和ASM中菌落数随时间变化的拟合结果Figure 2 Fitting results from time-kill curves of Acinetobacter baumannii AB170428 in CAMHB and ASM
对比不同培养基中拟合的参数值,鲍曼不动杆菌在ASM中的净生长速率常数(knet')明显高于CAMHB中的knet,由于净生长速率常数knet和knet'是通过细菌生长曲线拟合的,排除了抗生素和培养基相互作用的影响因素,因此,拟合结果(表1)提示不同培养环境对细菌增殖有影响。模型拟合值与实测值组合图中数据点基本分布在趋势线的两侧 (图3),R2分别为0.9653 (CAMHB)和0.9677(ASM)。

图3 模型拟合值与实测值组合图Figure 3 Diagnostic maps of model fitting value versus measured values
在CAMHB中,多黏菌素E对AB170428和AB070311都起到了一定的杀菌效果,但是1×MIC的多黏菌素E不足以完全抑制AB070311在24 h内的生长,模拟结果显示2×MIC多黏菌素E可以持续抑制细菌生长。体外杀菌曲线实验显示多黏菌素E在ASM和CAMHB中对鲍曼不动杆菌的杀菌效果相当,但图4模拟结果中多黏菌素E在ASM中的杀菌作用稍弱于CAMHB。
3 讨论
本实验首次使用ASM培养鲍曼不动杆菌进行PK/PD研究,评价不同培养基条件下多黏菌素E对鲍曼不动杆菌的杀菌效果,并建立PK/PD模型模拟不同浓度多黏菌素E的杀菌效果,为临床前体外实验提供了新的思路。
不同培养基对细菌增殖的影响不同,体外杀菌曲线实验发现,鲍曼不动杆菌在ASM中培养后,在LB琼脂平板上时而出现生长缓慢情况,35℃温室培养24 h后平板上形成的菌落小,往往需要更长时间的培养(如40~48 h)才能进行菌落计数,此现象与金黄色葡萄球菌突变株长出小菌落、生长受限的现象一致[20],推断鲍曼不动杆菌可能通过调节基因的表达改变自身生长情况来适应环境,在ASM营养物质缺乏的环境中采取下调代谢和生长速率的策略。在ASM中培养鲍曼不动杆菌24 h出现菌落密度下降,可能由于细菌通过自主调节密度来减少营养物质消耗、节约养分,提高种群生存率[21]。

图4 在CAMHB和ASM中不同多黏菌素E浓度作用下的菌落数随时间变化预测结果Figure 4 Predicted time-kill curves under different colistin concentrations in CAMHB and ASM
对比CAMHB和ASM中的杀菌曲线可以看出,0~2 h内鲍曼不动杆菌在ASM中生长缓慢,且相同浓度的多黏菌素E在ASM中0~2 h的杀菌作用更弱。此现象与Greulich等[22]及Haugan等[23]的观点一致,即更快的生长速率与抗生素的作用效果呈正相关。基于此,ASM中引入生长滞后效应因子和药物作用滞后效应因子建立模型,更好地模拟了鲍曼不动杆菌生长及多黏菌素E杀菌的迟滞作用。
在ASM中,尽管早期鲍曼不动杆菌生长速率较低,但迟滞期后,鲍曼不动杆菌生长速率上升,ASM中生长速率常数高于CAMHB。模拟结果显示,2 mg/L的多黏菌素E在ASM中杀菌效果较弱,与静态杀菌曲线展示的两种培养基中多黏菌素E作用效果相当的现象不同。结合实验菌株在ASM中的净生长速率值更大,猜测鲍曼不动杆菌更适应痰液环境,尽管初始存在生长延迟,但在适应环境后可能具有更大的增殖潜力。
尽管多黏菌素E在体外实验中具有良好的稳定性[24],且对CRAB具有较高的抗菌活性,但在杀菌曲线实验中经常观察到细菌再生的现象。本实验也提示临床上单独使用多黏菌素E治疗鲍曼不动杆菌感染时需要谨慎,要防止治疗过程中细菌生长出现反跳,更推荐多黏菌素E联合用药治疗鲍曼不动杆菌感染。
本实验采用了静态杀菌曲线的方法,即抗菌药物的浓度保持恒定,没有考虑到药物在人体中的吸收、分布、代谢、排泄过程,可以进一步利用体外动态PK/PD模型,模拟不同人体环境和给药方案下抗菌药物对细菌的作用效果。

