追求化学学科本质理解的教学设计*
——以“氯气的制备”为例
◎ 项佳敏 陈 凯
《普通高中化学课程标准(2017 年版)》(以下简称《2017 版课标》)将化学学科的本质特征概括为“认识物质和创造物质”,并进一步展开为“从微观层次认识物质,以符号形式描述物质,在不同层面创造物质”[1]。但是在现行高中化学教学体系尤其是必修模块中的安排,部分具体物质的性质比重远远超过了物质的制备,因此有些学生对化学本质的认识仅停留在“认识物质”层面。著名化学家霍夫曼曾说过:“科学家在描述他们从事的工作时,会把它形容成‘发现’,艺术家则以‘创造’来描述。……但是我认为用‘发现’这个词,只能有效描述科学家从事的部分活动,而且也只是化学家一小部分的工作而已。”[2]如果问化学学科的“以实验为基础”与物理学和生物学的“以实验为基础”有什么不同,创造物质正是化学学科的独有特征[3]。
《2017 版课标》对“创造物质”这一特征进行了强化。笔者应用NLPIR 多功能文本数据挖掘工具,对《2017 版课标》进行词频分析,发现有4 次提及“制取”,3 次提及“制造”,10 次提及“创造”,而“制备”出现的频次高达36 次。本文以“氯气的制备”内容为例,以“创造物质”的多样化途径为线索,进行追求化学学科本质的教学设计。
一、教学设计思路
氯气的实验室制法得到了重视,表现在:必修课程主题1“化学科学与实验探究”明确将“常见气体的实验室制取(如氨气、氯气)”作为学习活动建议,“氯气的发现”成为本主题下的情境素材建议;而“氯气的制备及性质”又在主题2“常见的无机物及其应用”中作为学习活动建议。《2017 版课标》对于气体的制备重新加以强化,正是响应“化学学科的本质特征”的重要举措。
图1 是“氯气的制备”的教学设计思路。针对图1 需要说明的是,我们试图体现知识体系的整体性,设计的主题容量较大,安排两课时完成;适当拓展内容,甚至提供课外学科背景的阅读材料,也意在强化中学生在必修阶段对气体制备方法的系统认知,在追求学科本质的过程中建构学科核心素养。
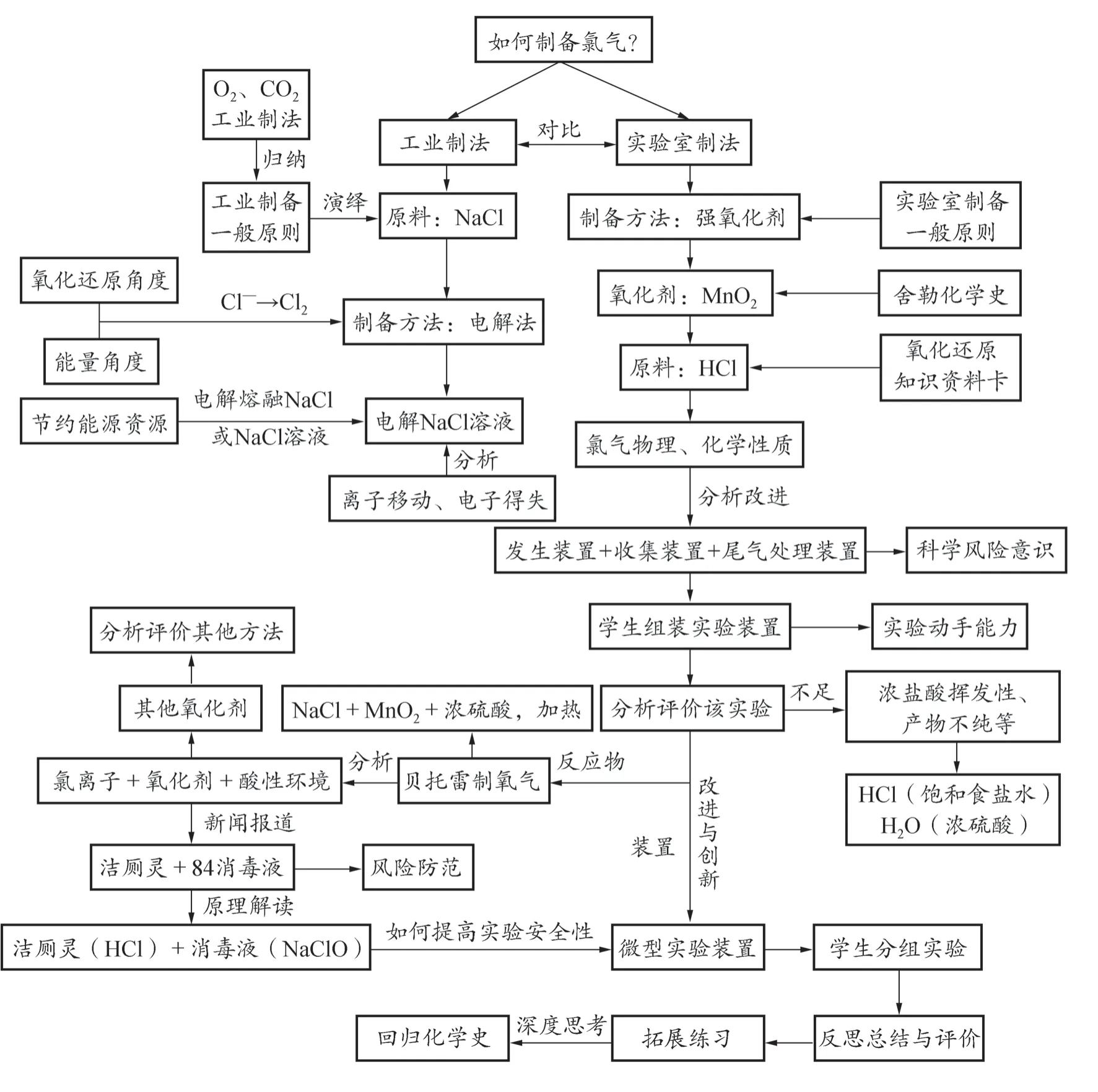
图1 “氯气的制备”的教学设计思路
二、教学过程分析
(一)发现“创造物质”的个性规律
学生通过比较最熟悉的氧气和二氧化碳的工业制法,思考并归纳出工业制备气体的一般规律,总结出工业制备一般规律:①原料中富含“目标元素”;②制备工艺简便;③原料廉价易得、资源丰富。然后再根据规律找出氯气工业制备的最佳原料——NaCl,体现出了“归纳演绎”的学科思维,从学生已有认知出发,归纳出工业制备的部分原则,再从元素守恒角度演绎出氯气制备工艺的原料选择,强化学生的“元素观”,把握创造物质的核心思想。
在讨论完工业制法以后,教师再提出“实验室如何制氯气?与工业制备在流程工艺上的要求有何不同?”引导学生思考工业和实验室制备的异同之处,得出结论:实验室制法追求快速、便捷、条件简单,一般不考虑原材料的成本问题。电解法并非理想的制备方法,因此考虑制备的第二条路径:直接用氧化剂氧化Cl-制备Cl2。
(二)深化“认识物质”的多维视角
教师带领学生从氧化还原和能量的角度分析原理,从而筛选出可能的制备工艺。由于工业制法与工程技术有关,而且还涉及电解原理,所以更多内容在选修模块深入。
电解本是选修模块的内容,但是立足于对氧化还原反应和电解质溶液的认识,所以在必修模块中,教师引导学生从微观层次认识电解法制氯气过程中的离子移动与电子得失,既是为了以后在化学反应原理中系统学习电解的启蒙,是学习进阶的需要,也为学生“认识物质”打开了新的视野。系列提问有助于学生的深度思考,体现出证据、理由和观点的统一性,对于学生“证据推理与模型认知”和“宏观辨识与微观探析”核心素养的培养都是大有裨益的。
教学片段一
【教师活动】用NaCl 作为原料,因为资源最丰富并含有氯元素。如何将NaCl 变成Cl2?NaCl 储量丰富也说明性质稳定,Cl-最外层为8 个电子的稳定结构如何被破坏?引导学生从氧化还原的角度进行分析。
【教师追问】制备氯气的一种途径就是利用强氧化剂。物质越稳定说明它蕴含的能量越低,因此,从稳定的物质转化成不稳定的物质,就需要提供大量能量。思考:还有什么其他方法?可类比H2O。
【教师讲解】通过分析得出从NaCl 制得Cl2的两条路,寻找强氧化剂;提供大量能量用电解法。考虑到综合因素,工业上采取电解法。
【连续追问】(1)氯化钠溶液中有哪些大量移动的离子?(2)通电后,这些离子往什么方向移动?能否根据已有的化学和物理知识绘制出在反应过程中电解质溶液内部和外电路的微粒移动示意图?如何根据示意图预测不同电极上产生的可能物质?(3)水溶液中钠离子为什么不会得到电子被还原?(4)什么证据能说明产生了氢氧根离子?阴极产生的氢气可能是被什么物质还原得到的?
(三)强化“实验设计”的模型建构
学生学习了常规的实验室制法后进一步开展批判性反思:浓盐酸具有强挥发性,在加热条件下会有大量HCl 气体逸出,存在不足之处(如浓盐酸污染环境、产物不纯、加热耗能等),还需要进一步改进。
一方面,在原实验的基础上提升要求,从“制备氯气”到“制备纯净的氯气”,为解决产物不纯的问题可以对气体进行净化,并让学生分析可能存在的杂质种类以及相应的除杂方法。这是“创造物质”对纯净的要求,也是思考对物质复杂性的认识,有助于构建“宏观辨识”素养。
另一方面,思考该制备实验的原理并为实验改进提供证据,学生对如何改变原料和条件可以进行开放性思考:①选用更强的氧化剂如KMnO4、KClO3代替MnO2,该反应可以在常温下进行;②若氯离子的来源不选用浓盐酸,能否用最常见的NaCl 作为原料制得氯气?此时酸性环境改用别的酸代替,因此选择具有强
氧化性和酸性的浓硫酸作为“帮手”。
教学片段二
【深度思考】还原剂基本限制在氯化钠和氯化氢,那么还可以改用怎样的氧化剂来实现这一制取呢?
【教师提示】实验室制备氯气的关键围绕“氯离子+氧化剂+酸性环境”这三个条件思考。
【资料卡】实验室制备氯气常见的氧化剂有MnO2、K2Cr2O7、KMnO4、KClO3、NaClO,产生氯气相应的反应分别是……
【学生活动】以讨论为主,对氯气制备的各种方法从原料选取、环境风险、条件难易进行比较和评价,并思考传统的氯气实验室制法优缺点。
此外,通过学科知识的深化拓展,启发学生从化学反应条件多样性角度来认识氯气的制备,让学生认识到化学变化是有条件的,而条件是可以变化的,要学会从不同视角认识化学变化的多样性,以此构建“变化观念与平衡思想”的化学核心素养。
教学片段三
【教师讲解】为什么用盐酸而不是氯化钠?实际上Cl-的还原性很差,因此即使用了强氧化剂MnO2也不能使之氧化,而在H+的辅助下,Cl-会更容易被氧化剂氧化;但是稀盐酸也不足以氧化,提升H+浓度和Cl-浓度才有可能。感兴趣的同学可以关注《普通化学原理》的电极电势和能斯特方程。
(四)体验“化学史实”的逻辑思维
化学史情境没有放在引入部分,而分散在教学过程中,更多作为理解化学问题的佐证,启发学生从化学反应条件多样性角度来认识氯气的制备,让学生认识到化学变化是有条件的,而条件是可以变化的,要学会从不同视角认识化学变化的多样性,以此构建“变化观念与平衡思想”的化学核心素养。用化学史让学生讨论评价科学的发展历程,学习其中的科学方法,体现出学科的深度和逻辑。在掌握氯气的实验室制法的装置和反应原理的同时能对“创造物质”进行多种途径的反思和评价,加深对化学物质的深层认识,体验反应条件对化学反应的各种影响因素,感受化学反应复杂性带来的不确定性。
教学片段四
【化学史资料卡】法国化学家贝托雷把氯化钠、软锰矿和浓硫酸的混合物装入铅蒸馏器中,经过加热制得了氯气。
【教师提问】自1774 年舍勒制得氯气到1836 年止,为什么人们会一直沿用贝托雷发明的方法来生产氯气而不是舍勒的?
(五)培养“科学风险”的决策认知
传统的实验室制备氯气存在一定的风险性。本设计中,我们在充分考虑风险的基础上继续开展实验活动。一方面,教学过程中只用多媒体展示传统实验,但是以生活中常见的洁厕灵和84 消毒液为原料,用更为安全和环保的微型实验装置让学生分组探索。另一方面联系氯气的产生关注近年来关于混用消毒液和洁厕灵导致的中毒事件,培养学生的风险认知能力,让他们既有风险意识,知道风险发生的可能根源,又可力所能及地预防风险的发生,不至于因为不按科学规律办事或科学伦理失范使自己成为风险的源头,同时能在感知到可能的风险发生时采取积极的应对措施,将因风险引起的危害降至最小[4]。
三、教学反思
(一)基于评价模型对本节课的系统评价
王磊教授提出了化学学科能力内涵构成及其活动表现模型[5],从学习理解、应用实践和迁移创新三个层面建立化学学科能力活动表现框架,从核心学科知识、核心学科活动经验和化学认识方式三个维度揭示化学学科能力的内涵构成。基于该模型对本节课进行系统评价,具体内容见表1。
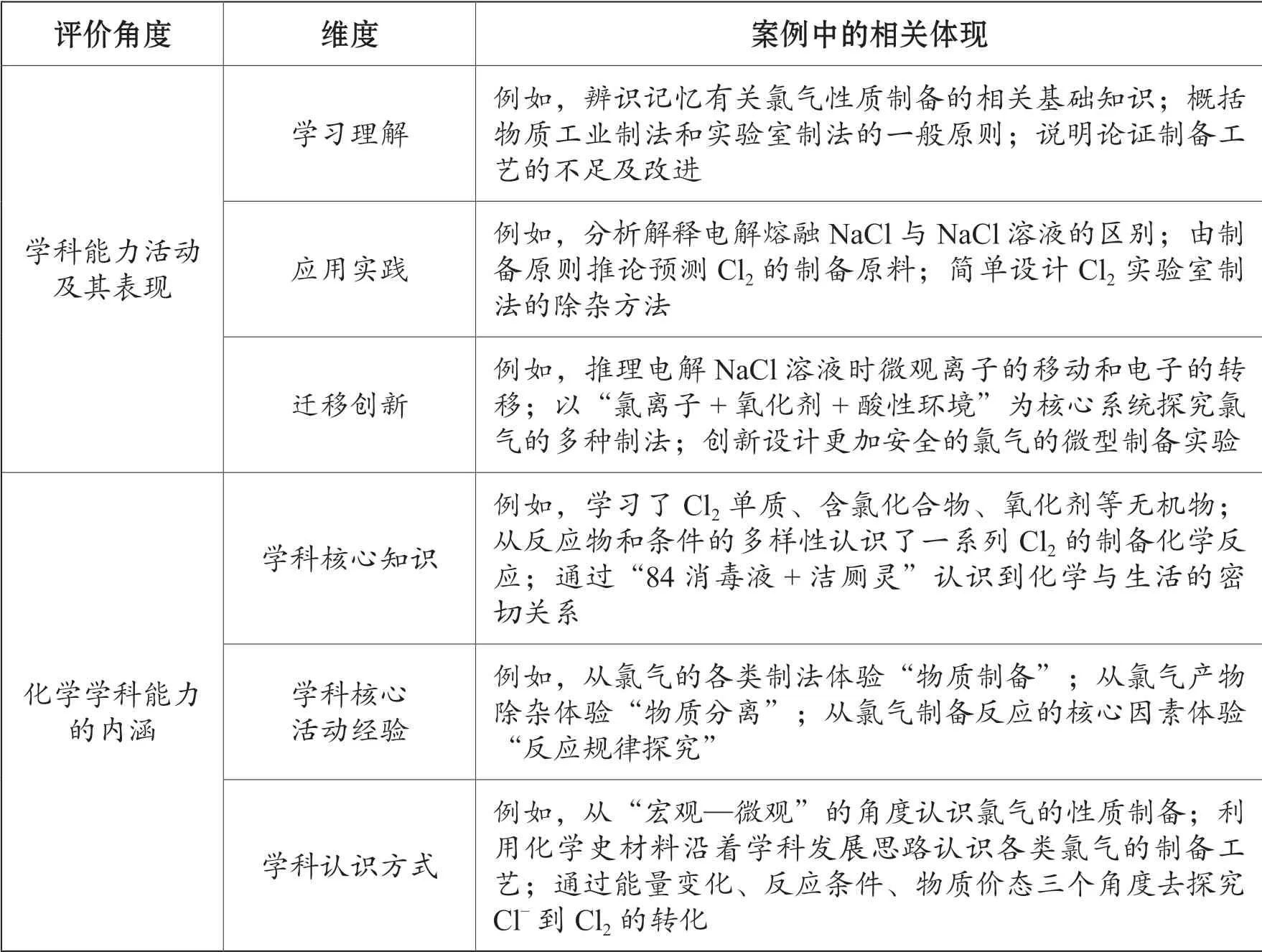
表1 化学学科能力内涵及其活动表现在本案例中的体现
(二)创造物质中的科学风险认知与决策能力培养
氯气的制法一度为高中化学教学所淡化,出发点还是在于其毒性可能引发的风险。但实质上化学教学中的科学风险不止局限于化学物质的“危险”和“危害”,还有来自科学知识本身的复杂性和不确定性[4]。当新课程重提氯气的制备,对待这一类有毒害的物质的探究的确要严谨慎重——创造物质势必要建立在充分认识物质的基础之上,所以在制备实验中,要强化对氯气毒性和吸收原理、氯化钠与盐酸的微粒和性质、强氧化剂性质的差异、影响化学反应的各种因素等问题的认识,让学生知道要尽量避免接触有毒害的物质的同时也要让他们清楚有毒物质从哪里来、如何避免接触或吸入、如何减少有毒物质伤害、如何控制化学反应等。在相对安全的环境下让学生亲身体验氯气的生成有利于提高学生的科学风险认知,让学生知道风险发生的可能根源,又可力所能及地预防风险的发生。
(三)重整知识体系和学科逻辑是为了体现化学学科本质特征
化学学科是在微观层次上认识物质进而创造物质,但同时也在创造物质的同时不断加深对物质的认识,这是在哲学本体论层面对化学学科与其他学科区别的一种本原性认识。[3]在认识和创造物质的过程中,科学在不断进步,除了学科具体性知识外,更有价值的是科学思路和方法,所以纵然是实验室制备气体的教学,也始终贯穿化学史素材,不断地评价、批判和反思,从中建构学科思维。在现实中,新的化学物质不是随意合成、没有任何目的的。化学家创造新物质的目的是使它们在科学上彰显理论标志,或对实际用途有用。制备工艺主要通过进行化学反应来实现,有些化学反应是已知的,有些必须通过化学家们不断摸索出来。实验室研究通常使用的方法只产生小样本的新材料,不适合大规模生产,因此投入工业生产必须考虑多重因素,探索具有廉价的起始材料、易于分离纯产品和无环境问题等要求的高效高产工艺。虽然只是必修模块教学,但是也要让学生知道实验室和工业生产在创造物质方面的差距,了解宏观现象背后可能的微观奥秘和具体原理。在追求学科本质的教学中,知识体系可以重组,学科逻辑也可以梳理。

