过量表达OsRRK1对水稻叶片发育的影响
马银花,莫凯琴,刘璐,李萍芳,金晨钟,杨芳
过量表达对水稻叶片发育的影响
马银花1,莫凯琴1,刘璐1,李萍芳1,金晨钟1,杨芳2
1湖南人文科技学院农业与生物技术学院/湖南省农田杂草防控技术与应用协同创新中心,湖南娄底 417000;2武汉大学生命科学学院/杂交水稻国家重点实验室,武汉 430072
【】(rop-interacting receptor-like kinase 1)属于胞质类受体激酶RLCK Ⅵ家族成员,通过对OE-转基因水稻的叶片形态观察,明确在水稻叶片发育中的作用。依据水稻基因组数据库公布的目标序列设计引物并构建超量表达载体,利用农杆菌介导的遗传转化转入到粳稻品种合江19,通过PCR分析鉴定阳性植株,Southern blot鉴定转基因植株插入外源基因的拷贝数,Northern blot杂交和qRT-PCR鉴定转基因植株在RNA水平的表达情况;选取T2代纯合植株抽穗期的剑叶进行叶片卷曲指数(leaf rolling index,LRI)测定;通过石蜡切片和苯胺蓝染色观察水稻横切后泡状细胞的变化情况,用Image J软件统计泡状细胞的面积;采用叶绿素测定计测量植株叶片叶绿素含量。共获得OE-转基因阳性植株44株,随机选取17株,经Southern blot鉴定8株为单拷贝株系,9株为多拷贝株系;随机选取2份多拷贝株系(OE-1和OE-4)和5份单拷贝株系(OE-5、OE-21、OE-22、OE-24和OE-25)用于后续试验。经分析发现在不同的转基因株系中具有不同程度的过表达情况,其中OE-1、OE-4和OE-25株系超量表达程度高,OE-5株系超量表达程度低,OE-21、OE-22和OE-24株系超量表达程度居中。从中选取OE-5、OE-22和OE-25共3份单拷贝转基因株系和WT对照经Northern blot鉴定后与qRT-PCR结果一致。统计选取的7个株系和WT对照的叶片卷曲指数发现:卷曲程度与表达量呈正相关,表达量越高卷曲程度越高。水稻叶片经切片和染色后发现OE-转基因植株叶片中泡状细胞发生了明显变化,转基因株系中泡状细胞数目都小于对照中泡状细胞均值4.6个。叶片卷曲得越明显,泡状细胞退化得越严重,数目更少,面积更小。经叶绿素含量测定发现,OE-22、OE-24和OE-25转基因的水稻叶片的叶绿素含量比野生型水稻叶片叶绿素含量高。过量表达会影响泡状细胞的数目和面积,从而使水稻叶片发生卷曲,且卷曲程度与表达量呈正相关;在水稻中的过量表达导致叶绿素含量增高。
水稻;;胞质类受体激酶;叶片卷曲;叶绿素含量
0 引言
【研究意义】在水稻中,叶片是植物形态建成的一个重要指标,与植物株型的形成密切相关[1]。叶片形态的改良,直接或间接的影响到作物光合作用,合适的叶片卷曲导致叶片直立,可提高光合效率,加速干物质积累和增加谷物产量,是当前水稻高产育种关注的重点[2-3]。而在水稻生产中,开展叶形基因如何调节叶片发育的研究,对水稻叶形的改良和理想株型的育种具有十分重要的意义。【前人研究进展】水稻叶片是植株进行光合作用的主要场所,叶片卷曲是叶片性状中的一个重要组成部分[4]。水稻卷叶形成的主要因素是叶片中泡状细胞的膨胀程度及其渗透压,生理性逆境(缺水和盐胁迫等)都会使叶片发生卷曲,但这种条件下的卷叶性状是可逆的且不能遗传,而由基因控制的卷叶性状一般能够遗传且表型稳定[2]。在水稻中的卷叶类型可简单分为3种:正卷、反卷和扭曲,目前已报道了超过35个叶卷曲突变体,且大部分研究表明都与泡状细胞生长的状况与叶片卷曲密切相关。在已克隆的水稻卷叶基因中,Hu等[5]研究(the narrow and rolled leaf 1)突变以后由于泡状细胞数目变少,叶片发生正卷,并且叶片也出现变窄现象。Li等[6]研究过表达(abaxially curled leaf 1)增加泡状细胞的数目导致反卷。Fang等[7]研究发现(rolling-leaf 14)通过影响叶片次生细胞壁的形成影响叶片卷曲,突变后引起正卷。Zou等[8]研究发现(outermost cell-specific gene 5)突变后由于增加泡状细胞的数目和面积导致反卷。Xu等[9]研究发现过表达可以增加泡状细胞的数目和影响排列导致反卷。Hibara等[10]研究发现(adaxialized leaf 1)突变以后由于表皮细胞在近轴面和远轴面都变大,并且远轴面与泡状细胞无法分开而导致叶片反卷。李聪等[11]发现了一个新LBD家族基因可以通过调节泡状细胞,影响水稻叶片卷曲。Fujino等[12]研究突变以后由于泡状细胞变小引起叶片卷曲,同时叶片还出现变窄现象。编码的是一个SHAQKYF家族的转录因子,属于KANADI家族,突变以后由于远轴面厚壁细胞的缺失从而导致叶片卷曲,且卷曲程度很高[13]。突变以后也是通过影响泡状细胞的形成进而调控叶片卷曲[14]。受体类激酶(receptor-like kinases,RLKs)在植物生长发育以及生物和非生物的胁迫过程中发挥着重要作用[15],有一类RLKs缺乏细胞外受体结构域,被称为胞质类受体激酶(receptor-like cytoplasmic kinases,RLCKs),RLCKs是一类无胞外结构域和跨膜结构域的蛋白激酶,只含有胞内激酶结构域,是RLK蛋白激酶超家族中一类特殊的蛋白家族。研究发现这类蛋白在拟南芥中有200个成员,而在水稻中有379个成员[16],在水稻中,关于RLCKs基因的研究很少,仅有、、、、、、等基因被报道,且它们都属于RLCKⅦ亚家族[17-20]。目前,对RLCKⅥ亚家族的成员的研究还不够深入,在拟南芥中只有研究了、、和的功能。AtRBK1和AtRBK2可以与Rop GTPase直接互相作用。和参与致病疫霉菌和葡萄孢菌的防御反应[21]。和调节拟南芥的生长发育以及防御反应[22]。是个多效性基因,并且是水稻类蛋白受体激酶RLCKⅥ家族成员首个被报道的蛋白[23],进一步明确对水稻叶片发育的影响,可为水稻育种和基因功能的研究提供借鉴。【本研究切入点】RLCKⅥ家族基因的功能在其他物种中有过报道,但是对水稻中RLCKⅥ家族成员的功能研究鲜有报道。前期研究发现,作为RLCKⅥ家族成员之一的参与水稻的生长发育和对褐飞虱的抗性反应。【拟解决的关键问题】本研究通过构建超量表达载体,利用农杆菌介导的遗传转化方法,转化生育期较短易于转化的粳稻品种合江19,得到转基因植株。通过对转基因植株的分子鉴定、叶片形态观察、叶绿素含量测定,明确对水稻叶片生长发育的影响。
1 材料与方法
试验于2014年9月到2019年10月在武汉大学杂交水稻国家重点实验室/湖南人文科技学院湖南省农田杂草防控技术与应用协同创新中心完成。
1.1 供试材料
大肠杆菌()菌株TOP10和农杆菌()菌株EHA105由武汉大学杂交水稻国家重点实验室何光存教授课题组提供;水稻材料粳稻品种合江19(L. subsp.cv. ‘Hejiang 19’)购自国家种质资源库;合江19为一早熟水稻品种,因其生育期短,在本研究中用作水稻转基因研究的受体材料;扩增序列用的模板来源于籼稻品种Kasalath(L. subsp.cv. Kasalath)。载体pCXUN由美国Ohio State University王国梁教授提供。
1.2 OsRRK1超量表达载体的构建
依据水稻基因组数据库公布的目标基因序列,通过Primer5软件设计用于基因扩增的上下游引物,即OE-OsRRK1-F和OE-OsRRK1-R,提取水稻品种Kasalath的基因组DNA作为模板,通过PCR扩增获得目的片段,将扩增的DNA片段与用相同的Ⅰ酶消化的pCXUN载体(含有玉米泛素ubiquitin启动子以及nos终止子)相连接,然后转化到大肠杆菌()菌株TOP10中,通过测序将连接正确的菌株提取质粒,即为构建成功的过量表达载体,命名为OE-。
1.3 农杆菌介导的对粳稻品种合江19的遗传转化
将构建成功的载体提取质粒,然后电转化进入农杆菌EHA105的感受态细胞备用。水稻遗传转化按照TOKI等[24]方法进行,水稻种子经过诱导-继代-前培养→农杆菌培养和悬浮→感染和共培养→农杆菌去除,之后将转化后的愈伤组织接种于含50 mg·L-1潮霉素和400 mg·L-1羧苄青霉素的N6培养基上[25],筛选抗性愈伤组织。在32℃持续光照培养2周后,将生长旺盛的胚性愈伤组织转移到含50 mg·L-1潮霉素B和250 mg·L-1羧苄青霉素的再生培养基上持续光照诱导芽的分化。2周后将幼苗转移至含50 mg·L-1潮霉素B和200 mg·L-1羧苄青霉素的生根培养基上诱导生根[26]。获得完整植株后,炼苗7—10 d,移至温室培养。
1.4 PCR检测阳性植株
以转基因植株叶片提取的DNA为模板,运用潮霉素基因引物(hyg-L和hyg-R)进行检测,或用载体序列设计的引物UBIS(F)/UBIA(R)进行扩增检测,所用的引物序列如表1所示。

表1 用于构建载体的引物
1.5 转基因植株的Southern blot分析
利用CTAB法抽提水稻大量基因组DNA,其步骤参考Chen等[27]方法进行:DNA限制性内切酶消化→凝胶电泳与Southern blot转膜→膜的预杂交→杂交→探针标记→洗膜→压片→放射自显影。
1.6 转基因植株的Northern blot分析
采用Trizol法提取转基因水稻叶片的总RNA,参考Chen等[27]方法进行:制备MOPS/甲醛变性凝胶进行RNA电泳→转膜→膜的预杂交→杂交→探针标记→洗膜→压片→放射自显影。
1.7 转基因植株的荧光定量PCR(qRT-PCR)分析
将转基因植株T2代的纯合阳性株系进行播种、待长至抽穗期,取水稻剑叶,每个转基因株系取3株。
采用Trizol法提取转基因水稻叶片的总RNA。RNA的反转录按RevertAidTM First Strand cDNA Synthesis Kit(Fermentas)的操作步骤进行。PCR反应体系为DNase/RNase-Free ddH2O (TIANGEN)2.9 µL、2×Super mix 4 µL、Primers (5 mmol·L-1) 0.6 µL和cDNA template 0.5 µL。
采用Bio-Rad CFX Manager分析荧光定量PCR分析结果,首先对其溶解曲线,QC(质控)等进行分析,去除不达标数据,之后用软件自带Gene Study功能按(1+E)—tudy算法分析目的基因的表达。
1.8 叶片卷曲指数的测定
选取T2代纯合植株抽穗期的剑叶进行测量,展开叶片,测量其最宽处距离,即为叶片最大宽度(maximum leaf width,Lw);测量同位置叶片两边缘间自然状态下距离,即为叶片自然状态的宽度(natural leaf width,Ln)。计算出叶片卷曲指数(leaf rolling index,LRI),LRI(%)=(Lw-Ln)/Lw×100%;每个转基因的独立株系随机选取20株进行测量,重复3次,取平均值。差异显著性用检验进行分析。
1.9 石蜡切片和苯胺蓝染色
在水稻抽穗期时,选取同样条件下生长于大田中的OE-植株和WT植株的剑叶。取样位置为正中间最宽处,进行材料固定→脱水→透明→渗蜡→包埋→修块和切片→脱蜡和复水→染色→镜检等基本试验操作。
1.10 叶绿素含量测定
取新鲜、干净的野生水稻叶片和过量表达水稻植株叶片,首先对叶绿素测定计进行校准,之后将叶片置于测定计夹片处,接着2个LED灯源同时发出红光和红外线,2种光穿透叶片打到接收器上,被转换为电信号。通过这两种波长范围内的透光系数来确定叶片当前叶绿素的相对含量(SPAD值)。随机选取20株的剑叶进行测量,结果用20次的数据平均值±标准差表示(n=20)。差异显著性用检验进行分析。
2 结果
2.1 OE-OsRRK1载体的构建
以基因组DNA为模板扩增含有的ORF序列(图1-A)。获得长度为1 179 bp的片段。将其连接至转化载体PCXUN。通过酶切验证,表明OE-载体构建成功(图1)。

A:OsRRK1全长ORF的扩增;B:重组载体的酶切鉴定;C:构建成功的OE-OsRRK1载体
2.2 转基因植株的获得
采用农杆菌介导法,成功将OE-载体导入水稻合江19的基因组中。从农杆菌侵染的水稻愈伤组织块中,获得了抗性愈伤组织块。将生长旺盛的胚性愈伤组织诱导发芽生根,获得T0代转基因再生植株47株,用于进一步的转基因分子验证。
2.3 OE-OsRRK1转基因植株的分子鉴定
将获得的OE-植株作为材料,用外源潮霉素设计引物,通过PCR扩增进行初步鉴定(图2-A),获得OE-阳性转化植株44株。
从第1代OE-的阳性株系随机选出17个进行Southern blot分析。利用超霉素引物扩增的产物为探针,通过限制性内切酶的消化、凝胶电泳、转膜、杂交、洗膜和自显影等过程,确定每个转基因株系中外源基因转入的拷贝数(图2-B),其中OE-5、OE-7、OE-16、OE-19、OE-21、OE-22、OE-24和OE-25为单拷贝株系,其他为多拷贝。为了研究OE-转基因植株中在RNA水平的表达情况,选取抽穗期的剑叶进行取样提RNA进行qRT-PCR分析(图2-C)。在不同的转基因株系中都出现过量表达的情况,但过表达的程度不同,OE-1、OE-4和OE-25株系超量表达程度高,OE-5株系超量表达程度很低,OE-21、OE-24和OE-22株系超量表达程度居中,的表达程度高低跟拷贝数没有直接关系,多拷贝的株系也不一定就比单拷贝的株系表达程度高,而几份单拷贝的株系表达程度也高低不等。
为进一步鉴定OE-转基因植株中的RNA水平表达情况,选择抽穗期的剑叶提取RNA,进行Northern blot分析,选取OE-5、OE-22和OE-253个单拷贝转基因株系和WT对照。由图2-D可知,在WT和OE-5中几乎检测不到,在OE-22中信号较弱,而在OE-25中信号很强(图2-D),这与qRT-PCR分析结果一致。
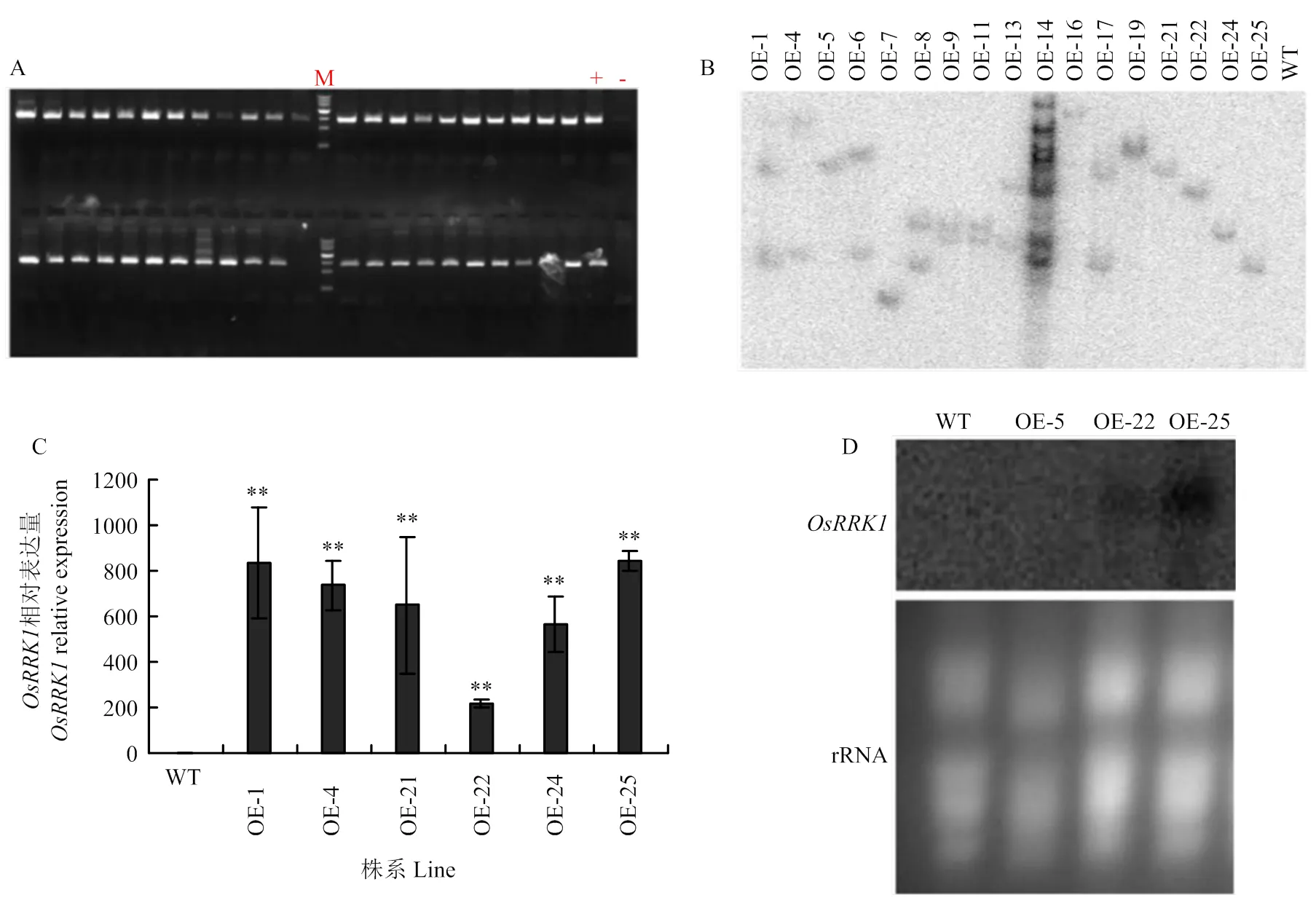
A:OE-OsRRK1转基因植株中目的基因的PCR检测;M:MarkerIII;+:阳性质粒对照;-:未转基因水稻阴性对照;其余为部分OE-OsRRK1转基因水稻植株。B:OE-OsRRK1转基因植株的Southern blot分析。C:OE-OsRRK1转基因植株的实时荧光定量PCR分析,**在0.01水平的差异显著性。下同。D:OE-OsRRK1转基因植株的Northern blot分析。WT:野生型合江19;OE-1—OE-25:部分OE-OsRRK1转基因水稻植株,其中OE-5、OE-7、OE-16、OE-19、OE-21、OE-22、OE-24和OE-25为单拷贝株系,OE-5:单拷贝表达量程度低的株系;OE-22:单拷贝表达量程度中等的株系;OE-25:单拷贝表达量程度高的株系
2.4 OE-OsRRK1转基因植株叶片卷曲分析
过表达的水稻叶片会出现卷曲,选取单拷贝并且表达程度最高的OE-25作为取样材料,可见OE-25相对于WT明显的叶片卷曲(图3-A)。通过计算叶片的卷曲指数(图3-B),可知WT对照的卷曲为0,表达量程度很低的OE-5也是0,表达量程度居中的OE-21、OE-24和OE-22株系,叶片卷曲指数也是居中,表达量程度高的OE-1、OE-4和OE-25株系叶片卷曲指数也高,卷曲的程度与的表达量有关,表达量越高卷曲程度越高,与基因的拷贝数无关。

A:WT和OE-25植株在抽穗期的剑叶,Bars=5 cm;B:WT和OE-OsRRK1转基因植株的叶片卷曲指数
为了分析OE-转基因植株叶片卷曲的原因,选取转基因水稻和对照合江19抽穗期的剑叶进行石蜡切片,观察水稻横切后各细胞的变化(图4-A),结果发现,OE-转基因植株叶片横切中不管是中轴、大维管束还是小维管束两边的泡状细胞数量减少,面积变小,并且表达量最高的OE-25的泡状细胞退化更明显,面积最小。为了对泡状细胞的数量进行量化,将一片水稻叶片横切后所有的泡状细胞统计,对照中泡状细胞数目均值约为4.6个,而转基因株系中泡状细胞数目都小于4.6,跟对照相比具有极显著差异,并且表达程度最高的OE-25株系泡状细胞数量均值只有约3.4个(图4-B)。同时用Image J软件对泡状细胞的面积进行统计,转基因株系与对照相比明显变小,并且具有极显著差异(图4-C)。
2.5 OE-OsRRK1转基因植株叶片叶绿素含量分析
通过分析OE-转基因植株叶片和WT叶绿素含量的变化(图5),发现OE-植株的叶绿素含量要比WT植株的高,具有极显著性差异。推测过量表达会导致叶绿素含量增高。
3 讨论
转基因植物中外源基因拷贝数是影响目的基因表达水平和遗传稳定性的重要因素[28]。本研究构建了过量表达的载体、通过农杆菌介导法转到粳稻品种合江19基因组中,获得OE-转基因植株。通过Southern blot分析转基因株系外源基因插入的拷贝数;qRT-PCR和Northern blot分析在转基因株系中的表达水平,发现的表达程度高低跟拷贝数没有直接关系,多拷贝的株系也不一定就比单拷贝的株系表达程度高,而几份单拷贝的株系表达程度也高低不等。在对高产水稻的理想株型研究中,卷叶性状的研究被广泛关注,因为叶片适度卷曲导致叶片直立不披垂,可提高光合效率,加速干物质积累和增加谷物产量[3],所以适度卷叶是实现水稻育种潜在产量突破的理想性状。目前,关于卷叶基因研究中最多的就是通过影响泡状细胞的发育来调控叶卷的这类基因。本研究中OE-转基因植株与对照相比叶片卷曲明显,泡状细胞数目更少、面积更小,退化明显,其他各细胞无明显变化,说明过表达可以通过减少泡状细胞的数目和影响泡状细胞面积大小导致水稻叶片正卷,目前这种调控的具体机制以及参与的信号转导途径还有待进一步探究。

A:WT和OE-OsRRK1植株中的剑叶的横切图(Bars=100 μm);红色箭头指示泡状细胞;B:WT和OE-OsRRK1植株叶片的泡状细胞的数目的统计;C:WT和OE-OsRRK1植株中的剑叶细胞的面积。WT:野生型合江19;OE-1、OE-4、OE-21、OE-22、OE-24和OE-25:OE-OsRRK1转基因植株
此外,有研究表明水稻的高产与其生长周期的光合作用密不可分,光合作用是产量形成的基础,作物的干物质生产直接来源于光合作用[29-30]。叶绿素是水稻叶片进行光合作用的重要物质之一,其含量是决定作物光合效率和生物量或产量的重要因素,而叶片叶绿素含量的高低表征水稻光合效率与生长状况等重要生长指标,其与作物产量呈正相关,因此适量增高叶绿素含量有利于提高产量[31-35]。在OE-转基因植株与野生水稻植株的叶绿素含量分析中发现3个OE-代表性株系的叶绿素含量均高于野生水稻植株,具有极显著差异。这表明由于水稻中表达量增多,使得表达量升高后可能促进了叶片中叶绿素的合成,导致叶绿素含量的增加。
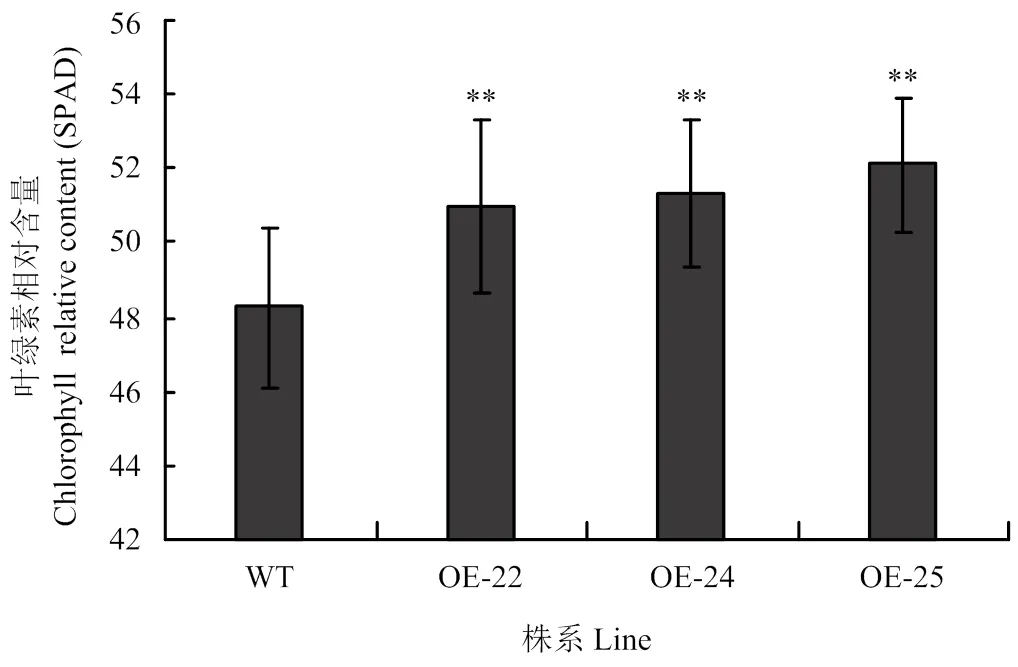
WT:野生型合江19;OE-22、OE-24和OE-25:OE-OsRRK1转基因植株
4 结论
能够通过调控泡状细胞的发育影响OE-转基因植株叶片的卷曲,并且卷曲的程度与的呈正相关,可通过调控的表达量来调控转基因水稻叶片卷曲程度。
[1] 沈年伟, 钱前, 张光恒. 水稻卷叶性状的研究进展及在育种中的应用. 分子植物育种, 2009, 7(5): 852-860.
SHEN N W, QIAN Q, ZHANG G H. Research progress on rice rolled leaf and it’s application in breeding program. Molecular Plant Breeding, 2009, 7(5): 852-860. (in Chinese)
[2] 徐静, 王莉, 钱前, 张光恒. 水稻叶片形态建成分子调控机制研究进展. 作物学报, 2013, 39(5): 767-774.
XU J, WANG L, QIAN Q, ZHANG G H. Research advance in molecule regulation mechanism of leaf morphogenesis in rice (L.). Acta Agronomica Sinica, 2013, 39(5): 767-774. (in Chinese)
[3] 郎有忠, 张祖建, 顾兴友, 杨建昌, 朱庆森. 水稻卷叶性状生理生态效应的研究: Ⅱ. 光合特性、物质生产与产量形成. 作物学报, 2004, 30(9): 883-887.
LANG Y Z, ZHANG Z J, GU X Y, YANG J C, ZHU Q S. Physiological and ecological effects of crimpy leaf character in rice (L.): Ⅱ. Photosynthetic character, dry mass production and yield forming. Acta Agronomica Sinica, 2004, 30(9): 883-887. (in Chinese)
[4] 周亭亭, 饶玉春, 任德勇. 水稻卷叶细胞学与分子机制研究进展. 植物学报, 2018, 53(6): 848-855.
ZHOU T T, RAO Y C, REN D Y. Research advances in the cytological and molecular mechanisms of leaf rolling in rice.Chinese Bulletin of Botany, 2018, 53(6): 848-855. (in Chinese)
[5] HU J, ZHU L, ZENG D, GAO Z, GUO L, FANG Y, ZHANG G, DONG G, YAN M, LIU J, QIAN Q. Identification and characterization of NARROW AND ROLLED LEAF 1, a novel gene regulating leaf morphology and plant architecture in rice. Plant Molecular Biology, 2010, 73(3): 283-292.
[6] LI L, SHI Z, LI L, SHEN G, WANG X, AN L, ZHANG J. Overexpression of ACL1 (abaxially curled leaf 1) increased bulliform cells and induced abaxial curling of leaf blades in rice. Molecular Plant, 2010, 3(5): 807-817.
[7] FANG L, ZHAO F, CONG Y, SANG X, DU Q, WANG D, LI Y, LING Y, YANG Z, HE G. Rolling‐leaf14 is a 2OG‐Fe (II) oxygenase family protein that modulates rice leaf rolling by affecting secondary cell wall formation in leaves. Plant Biotechnology Journal, 2012, 10(5): 524-532.
[8] ZOU L, SUN X, ZHANG Z, LIU P, WU J, TIAN C, QIU J, LU T. Leaf rolling controlled by the homeodomain leucine zipper class IV Gene Roc5 in rice1. Plant Physiology, 2011, 156(3): 1589-1602.
[9] XU Y, WANG Y H, LONG Q Z, HUANG J X, WANG Y L, ZHOU K N, ZHENG M, SUN J, CHEN H, CHEN A H, JIANG L, WANG C M, WAN J M. Overexpression of OsZHD1, a zinc finger homeodomain class homeobox transcription factor, induces abaxially curled and drooping leaf in rice. Planta, 2014, 239(4): 803-816.
[10] HIBARA K, OBARA M, HAYASHIDA E, ABE M, ISHIMARU T, SATOH H, ITOH J, NAGATO Y. The ADAXIALIZED LEAF1 gene functions in leaf and embryonic pattern formation in rice. Developmental Biology, 2009, 334(2): 345-354.
[11] 李聪. OsLBD3-7基因过表达导致水稻叶片近轴卷曲[D]. 北京: 中国农业科学院, 2016.
LI C. OsLBD3-7 overexpression induced adaxually rolled leaves in rice[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[12] FUJINO K, MATSUDA Y, OZAWA K, NISHIMURA T, KOSHIBA T, FRAAIJE M W, SEKIGUCHI H. NARROW LEAF 7 controls leaf shape mediated by auxin in rice. Molecular Genetics and Genomics, 2008, 279(5): 499-507.
[13] ZHANG G, XU Q, ZHU X, QIAN Q, XUE H. SHALLOT-LIKE1 is a KANADI transcription factor that modulates rice leaf rolling by regulating leaf abaxial cell development. The Plant Cell, 2009, 21(3): 719-735.
[14] XIANG J, ZHANG G, QIAN Q, XUE H. SEMI-ROLLED LEAF1 encodes a putative glycosylphosphatidylinositol-anchored protein and modulates rice leaf rolling by regulating the formation of bulliform cells1. Plant Physiology, 2012, 159(4): 1488-1500.
[15] GAO L L, XUE H W. Global analysis of expression profiles of rice receptor-like kinase genes. Molecular Plant, 2012, 5(1): 143-153.
[16] VIJ S, GIRI J, DANSANA P K, KAPOOR S, TYAGI A K. The Receptor-like cytoplasmic kinase (OsRLCK) gene family in rice: organization, phylogenetic relationship, and expression during development and stress. Molecular Plant, 2008, 1(5): 732-750.
[17] YAMAGUCHI K, YAMADA K, ISHIKAWA K, YOSHIMURA S, HAYASHI N, UCHIHA-SHI K, ISHIHAMA N, KISHI-KABOSHI M, TAKAHASHI A, TSUGE S, OCHIAI H, TADA Y, SHIMAMOTO K, YOSHIOKA H, KAWASAKI T. A receptor-like cytoplasmic kinase targeted by a plant pathogen effector is directly phosphorylated by the chitin receptor and mediates rice immunity. Cell Host Microbe, 2013, 13(3): 347-357.
[18] WANG J, WU G, PENG C, ZHOU X, LI W, HE M, WANG J, YIN J, MA W, MA B, WANG Y, CHEN W, QIN P, LI S, CHEN X. The receptor-like cytoplasmic kinase OsRLCK102 regulates XA21-mediated immunity and plant development in rice. Plant Molecular Biology Reporter, 2016, 34(3): 628-637.
[19] ZHOU X, WANG J, PENG C, ZHU X, YIN J, LI W, HE M, WANG J, CHERN M, YUAN C, WU W, MA W, QIN P, MA B, WU X, MA W, LI S, RONALD P, CHEN X. Four receptor-like cytoplasmic kinases regulate development and immunity in rice. Plant Cell Environment, 2016, 39(6): 1381-1392.
[20] 黄晓群, 赵海新, 董春林, 孙业盈, 王平荣, 邓晓建. 水稻叶绿素合成缺陷突变体及其生物学研究进展. 西北植物学报, 2005(8): 1685-1691.
HUANG X Q, ZHAO H X, DONG C L, SUN Y Y, WANG P R, DENG X J. Chlorophyll-deficit rice mutants and their research advances in biology. Acta Botanica Boreali-Occidentalia Sinica, 2005(8): 1685-1691. (in Chinese)
[21] MOLENDIJK A J, RUPERTI B, SINGH M K, DOVZHENKO A, DITENGOU F A, MILIA M, WESTPHAL L, ROSAHL S, SOELLICK T, UHRIG J, WEINGARTEN L, HUBER M, PALME K. A cysteine-rich receptor-like kinase NCRK and a pathogen-induced protein kinase RBK1 are Rop GTPase interactors. The Plant Journal, 2008, 53(6): 909-923.
[22] DORJGOTOV D, JURCA M E, FODOR-DUNAI C, SZUCS A, OTVOS K, KLEMENT E, BIRO J, FEHER A. Plant Rho-type (Rop) GTPase-dependent activation of receptor-like cytoplasmic kinases. FEBS Letters, 2009, 583(7): 1175-1182.
[23] MA Y, ZHAO Y, SHANGGUAN X, SHI S, ZENG Y, WU Y, CHEN R, YOU A, ZHU L, DU B, HE G. Overexpression of OsRRK1 changes leaf morphology and defense to insect in rice. Frontiers in Plant Science, 2017, 8(8): 1783.
[24] TOKI S, HARA N, ONO K, ONODERA H, TAGIRI A, OKA S, TANAKA H. Early infection of scutellum tissue withallows high-speed transformation of rice. The Plant journal, 2006, 47(6): 969-976.
[25] HIEI Y, OHTA S, KOMARI T, KUMASHIRO T. Efficient transformation of rice (L.) mediated byand sequence analysis of the boundaries of the T-DNA. The Plant journal, 1994, 6(2): 271-282.
[26] 杨浩萌, 薛哲勇, 赵乐, 漆小泉, 黄芳. 集胞藻Slr1515基因提高转基因水稻植株剑叶长度及叶绿素含量. 植物学报, 2013, 48(5): 489-497.
YANG H M, XUE Z Y, ZHAO L, QI X Q, HUANG F. Increased chlorophyll content and flag leaf length in transgenic rice expressing Slr1515 ofsp. PCC 6803. Chinese Bulletin of Botany, 2013, 48(5): 489-497. (in Chinese)
[27] CHEN R, ZHAO X, SHAO Z, WEI Z, WANG Y, ZHU L, ZHAO J, SUN M, HE R, HE G. Rice UDP-glucose pyrophosphorylase1 is essential for pollen callose deposition and its cosuppression results in a new type of thermosensitive genic male sterility. The Plant cell, 2007, 19(3): 1-15.
[28] 王育花, 赵森, 陈芬, 肖国樱. 利用实时荧光定量PCR法检测转基因水稻外源基因拷贝数的研究. 生命科学研究, 2007(4): 301-305.
WANG Y H, ZHAO S, CHEN F, XIAO G Y. Estimation of the copy number of exogenous gene in transgenic rice by real-time fluor escence quantitative PCR. Life Science Research, 2007(4): 301-305. (in Chinese)
[29] 刘微, 王树涛, 陈英旭, 吴伟祥. 转Bt(Cry1Ab)基因对水稻光合特性及光合产物积累的影响. 中国农业科学, 2011, 44(3): 627-633.
LIU W, WANG S T, CHEN Y X, WU W X. Effect of Cry1Ab Gene on photosynthetic characteristics and photosynthate accumulation of rice. Scientia Agricultura Sinica, 2011, 44(3): 627-633. (in Chinese)
[30] 童平, 杨世民, 马均, 吴合洲, 傅泰露, 李敏, 王明田. 不同水稻品种在不同光照条件下的光合特性及干物质积累. 应用生态学报, 2008(3): 505-511.
TONG P, YANG S M, MA J, WU H Z, FU T L, LI M, WANG M T. Photosynthetic characteristics and dry matter accumulation of hybrid rice varieties under different light conditions. Chinese Journal of Applied Ecology, 2008(3): 505-511. (in Chinese)
[31] 朱寒, 时元智, 洪大林, 程一帆, 王力. 水肥调控对水稻叶片SPAD值与产量的影响. 中国农村水利水电, 2019(11): 50-53, 65.
ZHU H, SHI Y Z, HONG D L, CHENG Y F, WANG L. Effects of water and fertilizer application on leaf SPAD values and yield of rice. China Rural Water and Hydropower, 2019(11): 50-53, 65. (in Chinese)
[32] 叶子飘, 闫小红, 段世华. 高产水稻剑叶的叶绿素含量、捕光色素分子的内禀特性与饱和光强关系的研究. 井冈山大学学报(自然科学版), 2015, 36(2): 25-32.
YE Z P, YAN X H, DUAN S H. Investion on the relationship between saturation irradiance and chlorohyll contents of flag leaves and intrinsic characteristics of light-harvesting pigment molecules in high-yielding rice. Journal of Jinggangshan University (Natural Science), 2015, 36(2): 25-32. (in Chinese)
[33] 范淑秀, 陈温福. 超高产水稻品种叶绿素变化规律研究初报. 沈阳农业大学学报, 2005(1): 14-17.
FAN S X, CHEN W F. Changes of chlorophyll content of high- yielding rice. Journal of Shenyang Agricultural University, 2005(1): 14-17. (in Chinese)
[34] LAFITTE H R, PRICE A H, COURTOIS B. Yield response to water deficit in an upland rice mapping population: associations among traits and genetic markers. Theoretical and Applied Genetics, 2004, 109(6): 1237-1246.
[35] 李合生. 现代植物生理学. 北京: 高等教育出版社, 2012.
Li H S. Modern plant physiology. Beijing: Higher Education Press, 2012. (in Chinese)
Effect of Overexpression ofGene on Rice Leaf Development
MA YinHua1, MO KaiQin1, LIU Lu1, LI PingFang1, JIN ChenZhong1, YANG Fang2
1School of Agriculture and Biotechnology, Hunan University of Humanities, Science and Technology/Hunan Provincial Collaborative Innovation Center for Field Weeds Control, Loudi 417000, Hunan;2College of Life Sciences, Wuhan University/National Key Laboratory of Hybrid Rice, Wuhan 430072
【】(RoP-Interacting receptor-like kinase 1) is a member of the cytoplasmic receptor kinases RLCK VI family. In this study, the leaf morphology of OE-transgenic rice was observed to clarify the role of【】Primers were designed based on target sequences published in the rice genome database to constructoverexpression vector, then transformed to Japonica variety Hejiang 19 mediated by. Positive plants were identified by PCR analysis. The copy number of inserted exogenous genes in transgenic plants was identified by Southern blot hybridization. The expression level of transgenic plants at RNA level was confirmed by Northern blot hybridization and qRT-PCR. T2generation homozygote plants at heading stage was selected to determine the leaf rolling index (LRI). Paraffin sections and aniline blue staining were used to observe the changes of rice bulliform cells after cross-cutting, and Image J software was used to calculate the area of the bubble cells. Chlorophyll content in plant leaves was measured by chlorophyll tester.【】44 positive transgenic plants were obtained and 17 lines were randomly selected for Southern blot analysis. Among the 17 lines, 8 lines were single-copy insertion and 9 lines were multi-copy insertion. 2 multi-copy lines (OE-1 and OE-4) and 5 single-copy lines (OE-5, OE-21, OE-22, OE-24 and OE-25) were randomly selected for subsequent analysis. qRT-PCR analysis revealed thatwas overexpressed with different degree in different transgenic lines. Among them, OE-1, OE-4 and OE-25 lines with the highestexpression level, while OE-5 lines with the lowest and OE-21, 22 and 24 lines with the middle. Three single copy transgenic lines OE-5, OE-22 and OE-25 and WT control were selected for Northern blot analysis. The results were in consistent with the results of qRT-PCR results. Leaf rolling index of the seven selected lines and WT control revealed that the degree of leaf curl was positive correlated with the expression level of, with the higher the expression level, the higher the degree of rolling. Paraffin section and staining revealed the number and area of bulliform cells in the flag leaves of OE-transgenic plants changed obviously compared to WT. OE-transgenic plants showed less bulliform cell number than those in the control whose average is 4.6. OE-transgenic plants with curlier leaf, with the more severe bulliform cell degeneration, less number, smaller area. Chlorophyll content determination revealed that the OE-22, OE-24 and OE-25 lines have higher chlorophyll content than those of the WT rice leaves.【】The overexpression ofaffect the number and size of bulliform cells in rice leaves, which cause leaf rolling, and the degree of leaf rolling is positively correlated with the expression level of. The overexpression ofgene will lead to the increase of chlorophyll content in rice.
;; cytoplasmic receptor-like kinase; leaf rolling; chlorophyll content

10.3864/j.issn.0578-1752.2021.05.001
2020-07-16;
2020-08-26
国家自然科学基金(31800201)、湖南省自然科学基金青年项目(2019JJ50281)、湖南省教育厅优秀青年项目(18B455)、杂交水稻国家重点实验室(武汉大学)开放课题基金(KF201901)、娄底市应用技术与开发项目(33319013)、湖南省应用特色学科(植物保护)
马银花,E-mail:mayinhua1988@126.com。通信作者金晨钟,E-mail:hnldjcz@sina.com。通信作者杨芳,E-mail:fang-yang@whu.edu.cn
(责任编辑 李莉)

