ECMO治疗对心源性休克患者早期乳酸清除率及经皮氧分压监测的临床意义
刘建凌 李杰敏 刘治 邓海芳 卿勇军 明建青





【摘要】 目的:研究体外膜肺氧合(ECMO)治疗对心源性休克患者早期乳酸清除率及经皮氧分压监测的临床意义。方法:回顾性分析2015年10月-2020年8月于本院接受ECMO治疗的心源性休克患者79例的资料,根据ECMO撤离后28 d内患者生存情况分为死亡组(37例)和非死亡组(42例),比较两组患者ECMO治疗前(T1)、治疗3 h后(T)、治疗6 h后(T)的乳酸清除率和经皮氧分压监测结果,并分析其与病情严重程度的关系及对患者预后的预测价值。结果:死亡组患者入院时初始血乳酸值和T、T、T的急性生理和慢性健康状况(APACHEⅡ)评分、序贯器官衰竭(SOFA)评分均高于非死亡组,差异均有统计学意义(P<0.05)。死亡组患者T、T乳酸清除率均低于非死亡組,且死亡组患者乳酸清除率T>T>T,两两比较,差异均有统计学意义(P<0.05)。死亡组患者T、T经皮氧分压均低于非死亡组,且死亡组患者经皮氧分压T<T<T,差异均有统计学意义(P<0.05)。Pearson相关性分析显示,T、T的乳酸清除率、经皮氧分压与APACHEⅡ评分、SOFA评分均呈负相关(P<0.05)。ECMO治疗3、6 h后乳酸清除率、经皮氧分压均可预测心源性休克患者28 d死亡率,其ROC曲线下面积均>0.7;其中以ECMO治疗6 h后乳酸清除率、经皮氧分压预测能力更佳(P<0.05)。结论:心源性休克患者乳酸清除率及经皮氧分压监测可评估病情严重程度及疾病进展情况,对预测ECMO治疗的预后有一定价值,建议临床密切监测。
【关键词】 乳酸清除率 经皮氧分压 心源性休克 体外膜肺氧合 预后
Clinical Significance of ECMO Treatment for Early Lactate Clearance and Percutaneous Partial Oxygen Pressure Monitoring in Patients with Cardiogenic Shock/LIU Jianling, LI Jiemin, LIU Zhi, DENG Haifang, QING Yongjun, MING Jianqing. //Medical Innovation of China, 2021, 18(23): 009-013
[Abstract] Objective: To investigate the clinical significance of extracorporal membrane oxygenation (ECMO) for early lactate clearance and percutaneous partial oxygen pressure monitoring in patients with cardiogenic shock. Method: The data of 79 patients with cardiogenic shock who received ECMO treatment in our hospital from October 2015 to August 2020 were retrospectively analyzed. According to the survival status of patients within 28 d after ECMO withdrawal, they were divided into death group (37 cases) and non-death group (42 cases). Lactate clearance rate and percutaneous oxygen partial pressure monitoring results were compared between the two groups before ECMO treatment (T), after ECMO treatment for 3 h (T), and after ECMO treatment for 6 h (T), the relationship between the disease severity and prognosis was analyzed. Result: The initial blood lactic acid value, acute physiological and chronic health status (APACHEⅡ) score and sequential organ failure (SOFA) score of T, Tand T3 in the death group were higher than those in the non-death group, the differences were statistically significant (P<0.05). The lactate clearance rates of T and T in the death group were lower than those in the non-death group, and the lactate clearance rate of the death group was T2>T1>T3, the differences were statistically significant (P<0.05). Pearson correlation analysis showed that lactate clearance rate and percutaneous oxygen partial pressure at T and T were negatively correlated with APACHEⅡ score and SOFA score (P<0.05). Pearson correlation analysis showed that the lactic acid clearance rate and percutaneous partial oxygen pressure of T and T were negatively correlated with APACHEⅡ score and SOFA score (P<0.05). Both the lactate clearance rate and percutaneous partial oxygen pressure after 3 and 6 h of ECMO treatment could predict the 28 d mortality of patients with cardiogenic shock, and the area under the ROC curve was all >0.7; among them, the prediction ability of Lactic acid clearance rate and percutaneous partial oxygen pressure after 6 h treatment with ECMO was better (P<0.05). Conclusion: Lactate clearance rate and transcutaneous oxygen partial pressure monitoring in patients with cardiogenic shock can evaluate the severity and progression of the disease, and have certain value in predicting the prognosis of ECMO treatment, it is suggested that clinical close monitoring should be carried out.
[Key words] Lactate clearance rate Percutaneous oxygen partial pressure Cardiogenic shock Extracorporeal membrane oxygenation Prognosis
First-author’s address: Qingyuan People’s Hospital, Qingyuan 511500, China
doi:10.3969/j.issn.1674-4985.2021.23.003
心源性休克患者死亡率較高,其发病原因复杂多样,多种诱发因素导致心脏功能严重衰竭,心输出量显著降低从而导致急性周围组织缺血,引起肝、肾、脑等其他重要组织器官功能障碍或坏死,及时对心源性休克患者采取抢救措施可增加患者存活率[1-2]。其急救原则主要包括制动、扩充血容量、纠正酸碱平衡、使用血管活性药物、对严重心肺功能衰竭的患者使用体外膜肺氧合(ECMO)抢救等,ECMO是由体外人工肺和人工心脏组成,可对心源性休克伴重症心肺功能衰竭患者进行长时间心肺功能支持,为危重症的抢救争取宝贵时间[3-4],但目前少见关于评估心源性休克患者病情进展及ECMO治疗预后指标选取的相关研究,因此本研究通过将经ECMO治疗的心源性休克患者按预后结果不同分组,旨在探索ECMO治疗对心源性休克患者早期乳酸清除率及经皮氧分压监测的临床意义。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年10月-2020年8月于本院接受ECMO治疗的心源性休克患者79例的资料,根据预后情况分为死亡组(28 d死亡)37例和非死亡组42例。纳入标准:经临床体格和生命体征检查、心电图及超声心动图检查、血清酶学检查、微循环灌注情况等检查确诊为心源性休克,符合2015年发布的《成人心源性休克治疗管理专家建议》中相关诊断标准;持续性低血压、休克及低组织灌注表现(脉搏细速、冷汗、发绀、少尿等);补充血容量、液体复苏、主动脉内球囊反搏治疗无效,需进行ECMO治疗;年龄>18岁[5]。排除标准:伴有严重明显外伤、脑出血等;临床信息、实验室检查、体格检查等资料缺损不完整。
1.2 方法 (1)比较两组患者ECMO治疗前(T)、治疗3 h后(T)、治疗6 h后(T)的乳酸清除率和经皮氧分压监测结果。乳酸清除率检测方法:取患者血液2 mL,加入20 mg氟化钠及4 mg草酸钾抗凝,15 min内离心后取血浆,使用全自动血气生化分析仪检测患者乳酸含量,乳酸清除率=(初始乳酸值-复测乳酸值)/初始乳酸值×100%。经皮氧分压监测方法:将经皮氧分压监测系统传感器贴于患者皮肤表面,测得患者血氧分压数值。(2)收集资料,主要包括患者年龄、性别、原发疾病类型(急性心肌梗死、重症暴发性心肌炎、其他)、入院时初始乳酸值和T、T、T时间点急性生理和慢性健康状况(APACHEⅡ)评分、序贯器官衰竭(SOFA)评分等。
1.3 统计学处理 采用统计学软件SPSS 19.0对本研究收集数据进行计算与分析,计量资料用(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用χ检验;相关性采用Pearson相关性检验分析;采用受试者工作特征(ROC)曲线分析乳酸清除率、经皮氧分压预测28 d死亡率的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 两组患者年龄、性别、原发病类型比较,差异均无统计学意义(P>0.05);但死亡组入院时初始血乳酸值和T、T、T时间点APACHEⅡ评分、SOFA评分均高于非死亡组,差异均有统计学意义(P<0.05)。见表1。
2.2 两组患者各时间点乳酸清除率比较 两组患者T1的乳酸清除率比较,差异无统计学意义(P>0.05);死亡组患者T、T的乳酸清除率均低于非死亡组,差异均有统计学意义(P<0.05);死亡组患者乳酸清除率T>T>T,且两两比较,差异均有统计学意义(P<0.05);非死亡组患者T、T的乳酸清除率均高于T,差异均有统计学意义(P<0.05)。见表2。
2.3 两组患者各时间点经皮氧分压比较 两组患者T1时间点经皮氧分压比较,差异无统计学意义(P>0.05);死亡组患者T、T经皮氧分压均低于非死亡组,差异均有统计学意义(P<0.05);死亡组患者经皮氧分压T<T<T,T3的经皮氧分压均低于T1和T2比较,差异均有统计学意义(P<0.05)。见表3。
2.4 死亡组患者各时间点乳酸清除率、经皮氧分压与APACHEⅡ评分、SOFA评分的关系 Pearson相关性分析显示,T、T时间点乳酸清除率、经皮氧分压与APACHEⅡ评分、SOFA评分均呈负相关(P<0.05),见表4。
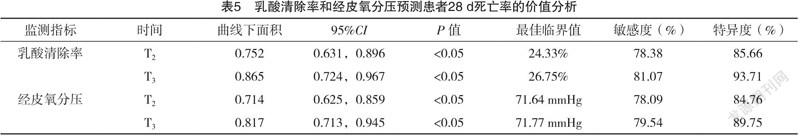
2.5 乳酸清除率和经皮氧分压预测患者28 d死亡率的价值分析 ECMO治疗3、6 h后的乳酸清除率、经皮氧分压均可预测心源性休克患者28 d死亡率,其ROC曲线下面积均>0.7;其中以ECMO治疗6 h后乳酸清除率、经皮氧分压预测能力更佳(P<0.05),见表5。
3 讨论
心源性休克患者均存在一定程度的周围血管循环障碍或者微循环障碍,通过监测患者皮肤氧分压有助于疾病的早期诊断,经皮氧分压监测如今已成为创伤治疗评估、高压氧医学、截肢高度判定等临床常用判断指标。对心源性休克患者进行经皮氧分压监测可及时了解到患者周围血运状态,对疾病疗效的评估具有重要意义[6-8]。血乳酸升高常见于某些病理情况下(呼吸衰竭、循环衰竭)组织高度缺氧,使体内细胞进行无氧代谢而产生大量乳酸,在休克、心肺功能障碍、心失代偿时常出现高乳酸血症[9]。乳酸清除率检测是目前临床常用的检测患者整体微循环状态的有效途径,但乳酸清除率检测无法满足持续监测的目的,而心源性休克患者病情变化迅速,只依靠乳酸清除率检测来关注病情及预估结果达不到较好的监测效果,同时休克患者血容量不足,反复抽血检验易造成患者产生医源性贫血[10-11]。另外临床也有通过检测心源性休克患者血液pH值或者胃黏膜CO分压等来监测患者病情变化,但其效果较差[12]。经皮氧分压监测系统主要通过加热与皮肤接触的电极片使皮肤角质层遇热发生改变,从而使电极片周围皮肤毛细血管动脉化和氧气溶解度降低以及增加氧气与血红蛋白亲和力,达到监测氧分压的效果。心源性休克患者首先主要影响到患者全身周围组织循环,因此监测患者微循环仍是目前心源性休克患者监测病情变化及预估患者预后结果的重要参考指标[13-14]。
本研究通过按不同预后结果对ECMO治疗的心源性休克患者进行分组比较,结果显示,死亡组患者T、T乳酸清除率和经皮氧分压均低于非死亡组(P<0.05),且T、T的乳酸清除率、經皮氧分压与APACHEⅡ、SOFA评分均呈负相关(P<0.05),其中APACHEⅡ、SOFA评分已被证实是预测ECMO治疗心源性休克患者死亡的独立危险因素[15],已作为评估重症患者病情及预后的公认指标。以上表明乳酸清除率、经皮氧分压可反映心源性休克患者病情情况及脏器损伤情况,其动态变化可评估病情进展及预后。且死亡组乳酸清除率T>T>T,经皮氧分压T>T>T,表示该组心源性休克患者经ECMO治疗后,其乳酸清除率得到短暂时间的改善之后迅速降低,经皮氧分压监测参数未得到明显改善,仍持续恶化,提示患者周围组织微循环障碍出现不可逆性损伤,除心脏、肺以外的其他重要组织器官受到损害,如肝肾脏器因缺氧导致组织受损,清除功能下降,使乳酸清除率降低,且周围组织血管受到严重影响,血管内皮细胞损害,使运用ECMO治疗后改善效果有限[16-17]。
同时,本研究发现ECMO治疗3、6 h后的乳酸清除率、经皮氧分压均可预测心源性休克患者28 d死亡率,以ECMO治疗6 h后乳酸清除率、经皮氧分压预测能力更佳,证实乳酸清除率监测和经皮氧分压监测对心源性休克ECMO治疗患者预后具有较高预测价值,分析其原因可能在于乳酸清除率升高反映患者机体内缺氧程度,与组织灌注密切相关,乳酸水平增高反映出机体组织器官缺氧明显,功能损害越严重,从而预测患者发生多器官功能障碍综合征的概率越大,增加死亡的风险。另外,有研究表示,休克患者组织灌注严重不足,导致机体细胞组织进行大量无氧代谢运动而产生乳酸[18],反之,检测乳酸持续升高,提示患者机体存在较为严重的无氧代谢,更为重要的是,乳酸的价值除反映机体无氧代谢运动外,还可以进一步反映机体各组织器官、系统功能衰竭,为后期治疗等提供判定标准[19]。联合经皮氧分压降低,提示患者周围循环障碍较为严重,且经皮检测不具有侵袭性,因此其可取得较为准确的血气分析结果,真实地反映出周围组织血运状况。经皮氧分压检测可弥补乳酸检测不能持续监测的缺点[15]。临床心源性休克患者会给予不同程度的吸氧治疗,有研究发现,经皮氧分压监测不易受到吸氧浓度、氧流量及吸氧时间的影响,相关指标仅随血流动力学改变,使经皮氧分压监测成为监测外周微循环障碍的良好指标,且其对血压等循环系统指标变化较为敏感,因此在病情变化早期就可做出准确预测[20]。
但本研究暂未排除患者自身状况,如吸烟、体位等对经皮氧分压监测结果的影响,使本研究结果具有一定的局限性,且未进一步分析乳酸清除率联合经皮氧分压监测预测患者预后的价值,相关研究有待进一步论证。
综上所述,对ECMO治疗的心源性休克患者进行乳酸清除率及经皮氧分压监测可较为准确的评估病情进展及判断预后状况,建议临床密切监测并及时采取针对性干预对策。
参考文献
[1]杨璇,李长江,李玉,等.急诊PCI的STEMI患者入院时心电图缺血程度对术后心源性休克的预测价值分析[J].中国医学创新,2015,12(14):28-30.
[2]李伟,陈旭锋,梅勇,等.cTnT对心源性休克患者接受V-A ECMO治疗的预后预测价值分析:一项连续5年的回顾性研究[J].中华危重病急救医学,2020,32(9):1091-1095.
[3]庞媛媛.体外膜肺氧合在肺移植患者护理中的现状[J].中国医学创新,2019,16(35):165-168.
[4] Raffa G M,Kowalewski M,Brodie D,et al.Meta-Analysis of Peripheral or Central ECMO in Postcardiotomy and Non-Postcardiotomy Shock[J].Ann Thorac Surg,2018,107(1):311-321.
[5] Levy B,Bastien O,Karim B,et al.Experts’ recommendations for the management of adult patients with cardiogenic shock(2015)[J].Annals of Intensive Care,2015,5(1):52.
[6]董亮,李朗,张秀红,等.经皮氧分压监测对行体外膜氧合治疗的心源性休克患者预后评估的价值[J].中国急救医学,2017,37(8):694-698.
[7]刘德林,王玉光,王敏娜,等.血乳酸测定评估ECMO治疗的心源性休克患者预后价值[J].中华胸心血管外科杂志,2019,35(10):617-622.
[8]王婷婷,富建华.新生儿重症监护病房诊治及监护技术新进展——经皮二氧化碳分压及氧分压监测在新生儿重症监护病房临床应用进展[J].中国实用儿科杂志,2017,32(5):323-327.
[9] Ann M Z,Ashley L A,Jennifer E P,et al.Utility of admission lactate concentration, lactate variables, and shock index in outcome assessment in dogs diagnosed with shock[J].J Vet Emerg Crit Care,2019,29(5):505-513.
[10]钟隽镌,张静,郑璇儿,等.血乳酸與血清清蛋白比值对新生儿脓毒性休克的早期预测价值[J].中华实用儿科临床杂志,2019,34(18):1386-1389.
[11]姜悦,周敦荣,黄樱菲,等.体外膜肺氧合治疗对心源性休克患者早期乳酸清除率及预后的影响[J].华夏医学,2020,33(4):171-173.
[12]李健,徐钰,席雯,等.APACHEⅡ和SOFA评分对不同原因休克预后评估的临床意义[J].中国实验诊断学,2019,23(6):959-962.
[13]刘可轩,李忠贤,唐会林.血清乳酸及乳酸清除率评估休克患者预后的临床意义[J].海南医学,2015,26(6):810-812.
[14] Ryoo S M,Jungbko L,Yoonseon L,et al.Lactate Level Versus Lactate Clearance for Predicting Mortality in Patients With Septic Shock Defined by Sepsis-3[J].Crit Care Med,2018,46(6):489-495.
[15] Cakici M,Ozcinar E,Baran C.A retrospective cohort analysis of percutaneous versus side-graft perfusion techniques for veno-arterial extracorporeal membrane oxygenation in patients with refractory cardiogenic shock[J].Perfusion,2017,32(5):363-371.
[16] Teng J,Njue F,Lam K.1 Year Outcomes Following Veno-Arterial Extracorporeal Membrane Oxygenation for Refractory Cardiogenic Shock[J].Heart Lung & Circulation,2016,25(2):93.
[17]董亮,张秀红,梁锋鸣,等.经皮氧分压监测对体外膜氧合治疗的重症急性呼吸衰竭患者预后的评估价值[J].中华结核和呼吸杂志,2017,40(9):683-688.
[18] Ankit G,Akhil K,Shyam G,et al.Intraoperative partial pressure of oxygen measurement to predict flap survival[J].Indian J Plast Surg,2018,51(3):266-273.
[19]董亮,张秀红,梁锋鸣,等.氧负荷试验对评估ECMO治疗的心源性休克患者预后的价值[J].中华危重病急救医学,2017,29(12):1102-1106.
[20]徐靓,严静,龚仕金,等.感染性休克患者经皮氧分压与血乳酸的相关性[J].中华内科杂志,2018,57(11):841-843.
(收稿日期:2021-07-09) (本文编辑:张爽)

