非糖尿病腹透患者不同腹膜转运功能的临床特点及与预后的关系
李旭东 倪 军 饶立科 翁 宁 俞东容
腹膜透析(peritoneal dialysis,PD)是终末期肾病肾替代治疗的重要方法之一,腹膜转运功能被认为是影响PD 疗效及长期预后的重要因素[1]。然而有研究表明,腹膜转运状态本身并不是引起死亡和技术失败的独立危险因素[2-3]。也有研究显示,高转运腹膜功能与糖尿病腹透患者技术失败相关,但并不是患者死亡的独立影响因素[4]。本研究通过回顾性分析单中心不同腹膜转运功能的非糖尿病PD 患者临床特点及预后,探讨腹膜转运功能对非糖尿病PD 患者预后的影响。
1 资料与方法
1.1 一般资料 选取2016 年9 月—2016 年10 月于浙江中医药大学附属广兴医院腹透门诊随诊的终末期非糖尿病肾病PD 患者176 例。本研究经本院伦理委员会审核通过(伦理批件编号:2020KY092)。
1.2 纳入、排除标准 纳入标准:因多种原因(非糖尿病肾病)诊断为慢性肾衰竭而进行维持性PD 至少3 个月以上[5]。排除标准:(1)同时进行血液透析、血浆置换、血液滤过治疗;(2)近1 个月内发生急性炎症性疾病如腹膜炎、肺部感染等;(3)合并恶性高血压、肝功能损害、急性心脑血管病,或其他心脑肺肝和造血系统等严重疾病及精神病患者;(4)拟行肾脏移植手术、恶性肿瘤、妊娠或哺乳期患者。
1.3 分组方法 采用标准腹膜平衡试验(PET)评估腹膜转运功能及分组[5],根据腹膜对小分子溶质的清除能力其转运功能分为高转运、高平均转运、低平均转运和低转运四种。
1.4 观察指标 测定血清肌酐(CR)、尿素氮(BUN)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)、高敏C 反应蛋白(HsCRP)、血白蛋白(ALB)、血清钙(Ca)、血清磷(P)、甲状旁腺激素(PTH)等以及腹透液尿液CR、BUN、血红蛋白(HB)指标;以血ALB 和体重校正的蛋白分解率(nPCR)评估患者的营养状况;以尿素清除指数(Kt/V)和总肌酐清除率(Tccr)评估患者的溶质清除状况。
1.5 随 访 纳入患者随访观察至2020 年7 月31日。随访终点:(1)退出腹透改血透;(2)患者死亡;(3)移植。
1.6 统计学方法 应用SPSS 25.0 软件进行统计分析。计量资料符合正态分布以均数±标准差()表示,非正态分布的计量资料以中位数(下四分位数,上四分位数)表示。正态分布且方差齐的计量资料组间比较用方差分析,非正态分布或方差不齐的计量资料组间比较用秩和检验,计数资料组间比较用卡方检验。采用Kaplan-Meier 方法进行生存分析,评估不同腹膜转运功能患者的生存率、技术生存率,生存分析随访至患者死亡或随访截止日期;技术生存分析随访至患者转血液透析、死亡或随访截止日期,Log Rank 检验对各组腹透生存率两两比较。P<0.05视为差异有统计学意义。
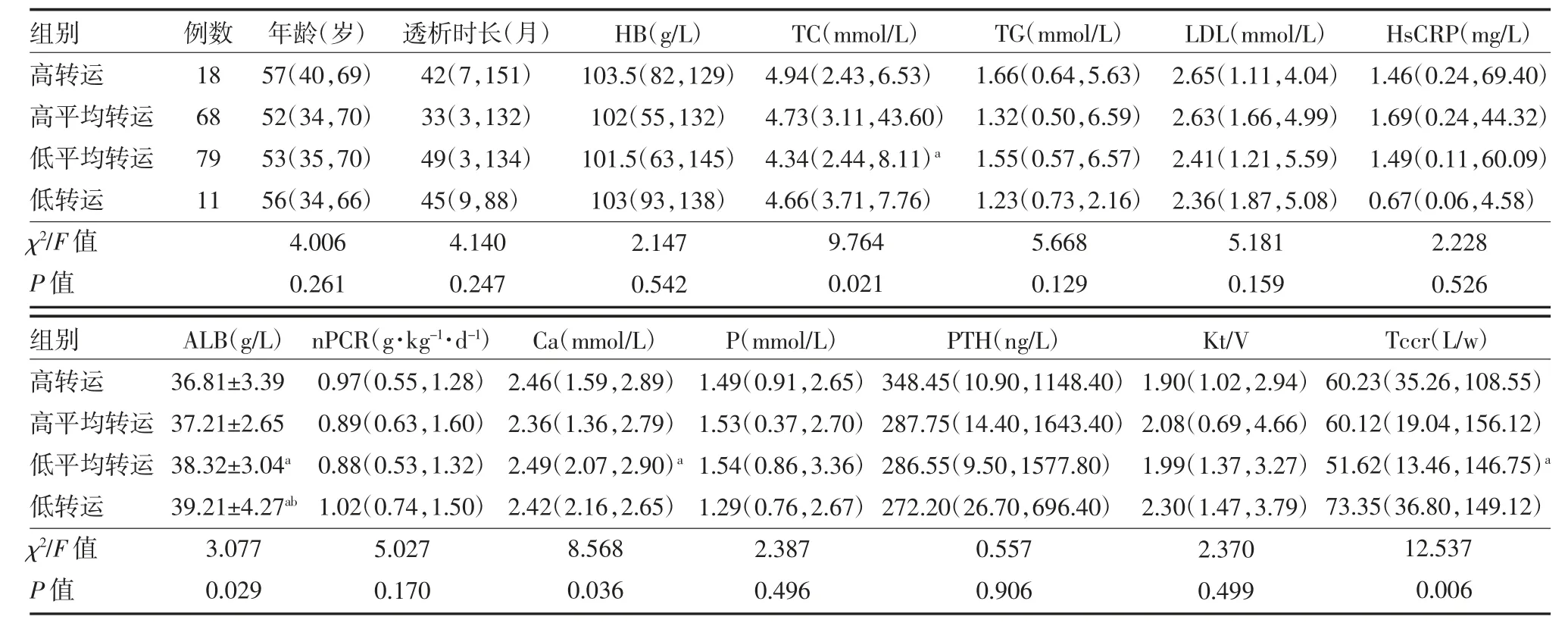
表1 非糖尿病腹透患者不同腹膜转运类型与临床特征的比较[M(P25,P75)]
2 结果
2.1 一般资料 本组176 例患者中,男78 例(44.3%),女98 例(55.7%);基础疾病慢性肾炎166例(94.3%),多囊肾5 例(2.8%),血管炎肾损害2 例(1.1%),高血压肾损害1 例(0.6%),痛风肾1 例(0.6%),药物性肾损害1 例(0.6%)。年龄53(46,60)岁,最大70 岁,最小34 岁;透析时长43.5(23.0,71.5)个月;随访时间(39.91±11.56)个月;HB 102.0(93.3,111.8)g/L,ALB(37.80 ±3.07)g/L,nPCR 0.89(0.77,1.02)g·kg-1·d-1,Kt/V 2.03(1.73,2.31),Tccr 55.54(48.32,72.22)L/w;其中高转运患者18 例,高平均转运68 例,低平均转运79 例,低转运11 例。
2.2 腹膜转运功能与临床特征的关系 各组年龄、透析时长差异无统计学意义(P>0.05),实验室指标HB、TG、LDL、P、PTH 差异无统计学意义(P>0.05);ALB 各组差异有统计学意义(P<0.05),从高转运组到低转运组,ALB 逐渐升高,其中低转运组与高转运、高平均转运组比较差异有统计学意义(P<0.05);TC 水平低平均转运组患者与高平均转运组患者比较有明显下降(P<0.05),但nPCR 各组间无差异(P>0.05);钙磷代谢方面显示血PTH、P 水平组间无差异(P>0.05),但血钙组间有差异(P<0.05);四组间HsCRP 无明显差异(P>0.05);小分子溶质清除方面显示Kt/V 各组间无差异(P>0.05),Tccr 各组间有差异(P<0.05),其中低平均转运组较高平均转运组显著降低(P<0.05)。见表1。
2.3 腹膜转运功能与预后的关系 至随访末,176例非糖尿病PD 患者中改移植10 例,改行血透26例,死亡17 例,总死亡率9.66%。其中高转运组转入血透最多(5/18),低平均转运组死亡最多(13.9%,11/79)。Kaplan-Meier 分析腹透生存率(χ2=5.056,P=0.168)及技术生存率(χ2=3.495,P=0.321),显示各组之间无明显差异。见表2,图1-2。
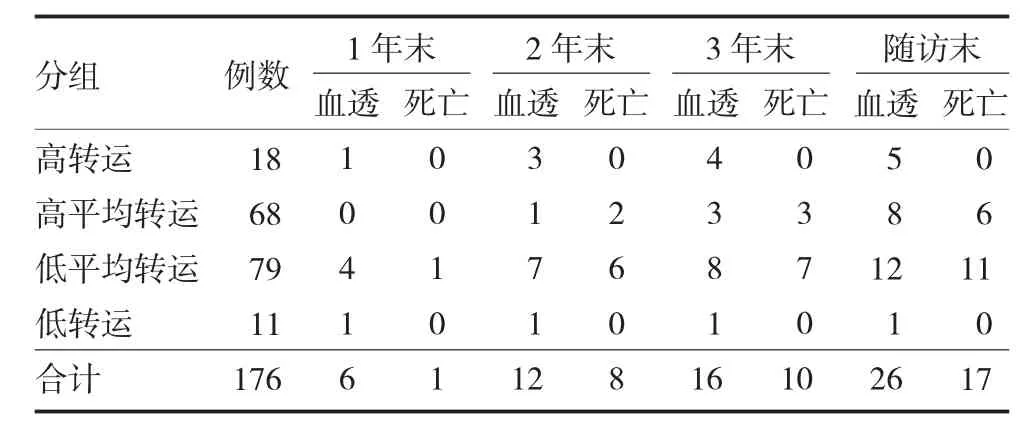
表2 非糖尿病腹透患者不同腹膜转运类型的预后(例)
3 讨论
PD 在国内外已取得长足的发展,其长期生存率与营养、炎症、透析充分性等密切相关,其中腹膜转运功能起到了复杂、重要的作用,一方面高转运PD患者具备比较好的小分子溶质清除,有较高的Kt/V、Tccr,但ALB 等营养指标下降,而低转运患者虽然小分子溶质清除差,却有更好的营养状态[6-9],高腹膜转运状态被认为是营养不良的独立危险因素[10]。本研究也发现,从高转运组到低转运组,ALB 逐渐升高。高转运PD 患者ALB 下降与腹膜血管通透性增加致蛋白丢失增加、超滤功能下降液体超载食欲下降等有关。
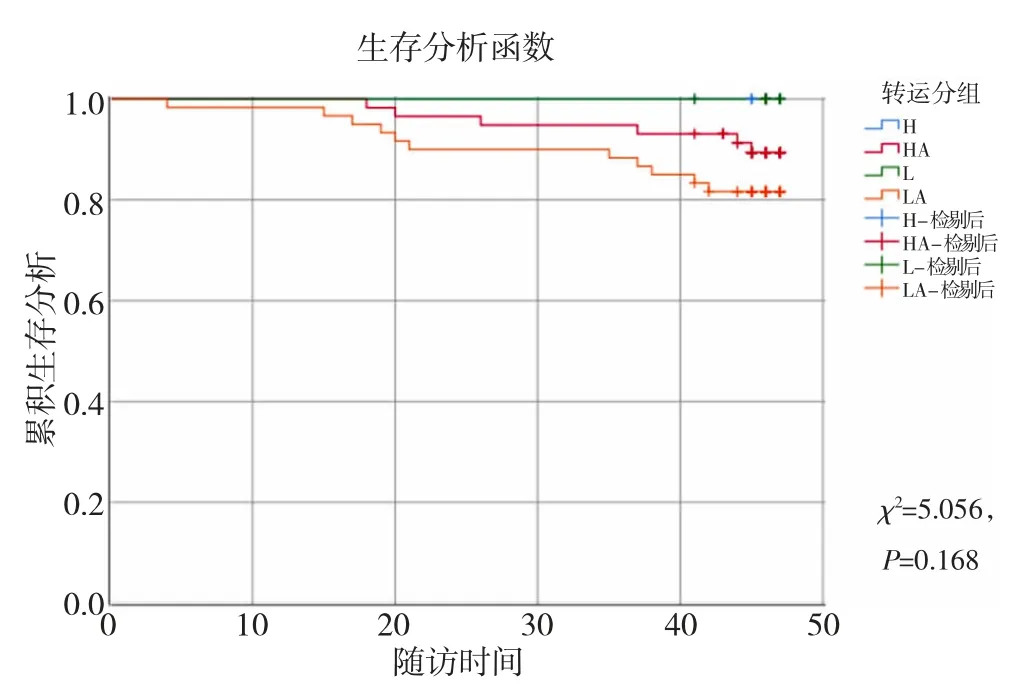
图1 Kaplan-Meier 分析各组腹透生存率
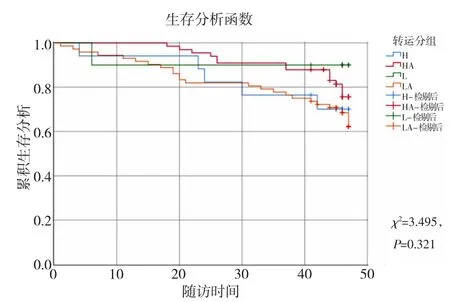
图2 Kaplan-Meier 分析各组腹透技术生存率
代谢综合征是PD 患者全因死亡、心血管疾病死亡的独立危险因素[11],并增加死亡率[12]。高转运PD患者因其腹膜功能特点,吸收糖并影响患者胰岛功能,更容易导致患者血脂异常及代谢紊乱。本研究中,高平均转运组TC 水平较低平均转运组高,差异有统计学意义(P<0.05)。
小分子溶质的清除是透析充分与否的重要指标,Kt/V 一度被认为透析充分性的金指标,但之后研究显示,小分子溶质清除达到一定值后再增加并不能进一步改善预后,一般来说,高转运、高平均转运患者可以到达更高Kt/V、Tccr,本研究显示各组Kt/V无明显差异,低平均转运Tccr 比较高平均转运患者明显下降,但中位数也达到50L/w 以上,而低转运患者Tccr 73.4L/w,这与低转运患者病例少(11 例),8例具备明显残余肾功能(ccr>10L/w),且腹透处方的个体化有关。
以往研究发现,腹膜高转运状态与PD 患者更高的死亡率有关[13-14],高转运腹透患者蛋白质和氨基酸等物质经腹透液丢失,营养低下,超滤能力差,不利于容量控制,同时,高糖的吸收,脂代谢紊乱,心血管事件增加,都可能影响腹透生存,提示容量的控制比小分子溶质的清除更为重要。但也有研究显示,高腹膜转运状态本身并不是死亡独立危险因素,也不是预后不良的预测指标[2-3,15],其合并症、残余肾功能对预后更具意义,对于腹膜高转运带来的蛋白清除率和死亡的相关性仍存在争议[16]。本研究发现,四组腹透患者的腹透生存率、技术生存率没有差异,但高转运组患者进入血透比例最大(5/18),近4 年的随访中18 例患者无死亡病例,高平均转运组68 例患者8 例进入血透(11.8%),6 例死亡(8.8%),低平均转运组79 例患者12 例进入血透(15.2%),11 例死亡(13.9%),11 例低转运组患者1 例进入血透,无死亡。提示腹膜的高转运状态可能更多与腹透技术失败有关,较早因容量问题而改行血透,但不影响其长期生存;而腹透处方的及时调整有可能弥补腹膜转运功能带来的不足。
PD 患者不同腹膜转运功能具有不同的临床特征,高转运PD 患者较低转运患者ALB 水平更低,容易导致技术失败进入血透,但并不影响其远期预后。

