恙虫病东方体目视LAMP现场化检测方法的建立
陶志勇,UMAR Ibrahim,吕樵岚,刘韦萍,张培艺,靳小霞,方强,夏惠
蚌埠医学院病原生物学教研室,安徽 蚌埠 233030
恙虫病由恙虫病东方体引起的,其传播媒介为恙螨[1-2]。本病主要流行于东南亚、东北亚等亚洲地区[3-5],近年来我国恙虫病的流行区由南向北不断扩大[6-7],安徽沿淮流域的恙虫病发病人数和发病率呈逐渐升高的趋势[8-9]。其中,蚌埠市的怀远县恙虫病发病较为严重,恙螨带菌状况亟需研究[10]。恙虫病东方体培养和动物接种较为困难,因此,开发适合现场应用的低成本检测方法对于恙虫病的防控具有重要价值。本研究在已有基础上[11],针对恙虫病东方体GroEL基因,建立了一种基于“染料-蜡丸”的目视LAMP检测恙螨体内恙虫病东方体的方法,通过与便携式LAMP仪联合使用,可以为恙虫病的防治提供新的检测工具。
1 材料和方法
1.1材料 恙螨:采用小黑板法捕捉来自蚌埠市怀远县的恙螨,贮存于70%乙醇中,由蚌埠医学院病原生物学教研室保存。微晶蜡:购自荆门石化公司。克隆载体和GroEL核酸片段:购自南京金斯瑞有限公司。主要试剂仪器:Bst酶、Taq酶、Sau3AI内切酶、dNTPs、硫酸镁购自NEB公司;Axygen组织DNA提取试剂盒购自Corning公司;SYBR Green I购自Invitrogen公司。便携式LAMP仪原型机为本课题组自行研发。
1.2方法
1.2.1靶序列选择与引物设计 将OtGroEL基因(GenBank:JX235722)序列上传到Primer Explorer 5.0(http://primeexplorer.jp/lampv5e/index.html)网站用于引物组设计,根据系统推荐,结合引物的一般要求,选择其中的一套引物并合成。
1.2.2重组质粒pUC57-rOt-GroEL的构建OtGroEL基因片段由金斯瑞公司合成,并克隆到pUC57载体上,同时对重组质粒进行测序。
1.2.3恙螨DNA提取 将恙螨从乙醇保存的标本管中取出放置在平皿中,用生理盐水冲洗恙螨,在解剖镜下用一次性塑料研磨棒将恙螨磨碎。按照厂商的说明书,采用Axygen 组织DNA Miniprep试剂盒(Corning公司,中国杭州)从研磨好的螨样品中提取DNA,检测DNA浓度后,样品在-20℃冰箱保存。
1.2.4“染料-蜡丸”的制备 将1 mL一次性注射器的针筒在0.1 mL处切断,保留注射器下部和注射推杆作为蜡丸模具。用不锈钢药匙盛取适量微晶蜡,酒精灯加热使其熔化。倾倒约0.2 mL液态蜡进入模具,加1 μL 1000× 荧光染料SYBR Green I在冷却凝固蜡表面上,再倾倒另外0.2 mL的液态蜡进入模具,等蜡完全凝固后,推动针栓,将体积约为0.5 mL的圆柱体“染料-蜡丸”推到1 mL无菌塑料离心管中,放置-20℃冰箱保存。
1.2.5蓝光检测器的制备 将市售玩具LED手电筒的灯珠取下,替换成478 nm波长蓝光LED灯珠即可。
1.2.6目视LAMP法 按照文献[12-13]配制LAMP反应体系,以rOt-GroEL质粒为阳性对照,无菌去离子水为阴性对照,在冰面上常规加样。在扩增反应开始前,将“染料-蜡丸”置于反应管中,紧闭管盖,并移入便携式LAMP仪上。反应参数设置为65℃加热60 min,热盖温度为80℃,此为第一阶段常规LAMP扩增。其后,加热至99℃,10 min,此为第二阶段熔解蜡丸释放染料、核酸染色和Bst酶灭活的过程。反应全程由锂电池供能,反应结束后用步骤5制备的蓝光检测器照射,肉眼观察结果,绿色为阳性,桔色为阴性。
1.2.7目视LAMP扩增的特异性与检测限 扩增产物由Sau3AI酶切FIP引物中的相应酶切位点,通过电泳验证扩增的特异性。检测下限的测定:将质粒用步骤3提取所得恙螨DNA溶液连续稀释为1×104、1×103、1×102和1×101拷贝,并以无菌去离子水为阴性对照,其余按步骤6操作,目视判断结果。同时利用外引物F3、B3作为普通PCR引物,扩增前述系列浓度的质粒样本,并与LAMP进行比较。
2 结 果
2.1引物设计结果 该组引物见表1。其检测的靶标为OtGroEL基因中一段237 bp的序列。
表1 Ot GroEL LAMP引物组
2.2“染料-蜡丸”制备 所制备的“染料-蜡丸”外观为白色蜡状圆柱体,直径约4 mm,柱高约6 mm,放置进普通PCR管内,与管内液体不接触(图1)。

注:A:成品“染料-蜡丸”;B:“染料-蜡丸”放置在普通PCR管内。
2.3蓝光检测器 通过拨动开关,蓝光检测器可发出蓝色光(图2)。

注:A:普通LED玩具电筒;B:电筒的内部结构,箭头所指为白光LED灯珠;C:更换为蓝光LED灯珠后,电筒发蓝光;D:自制蓝光检测器成品。
2.4目视LAMP结果 在便携式LAMP仪上完成第一阶段反应后,“染料-蜡丸”保持完整,在第二阶段反应完成后,蜡丸熔化,染料被自动释放到反应液中,核酸被染色,阳性对照管呈现亮丽的绿色,而阴性对照管呈桔黄色(图3)。
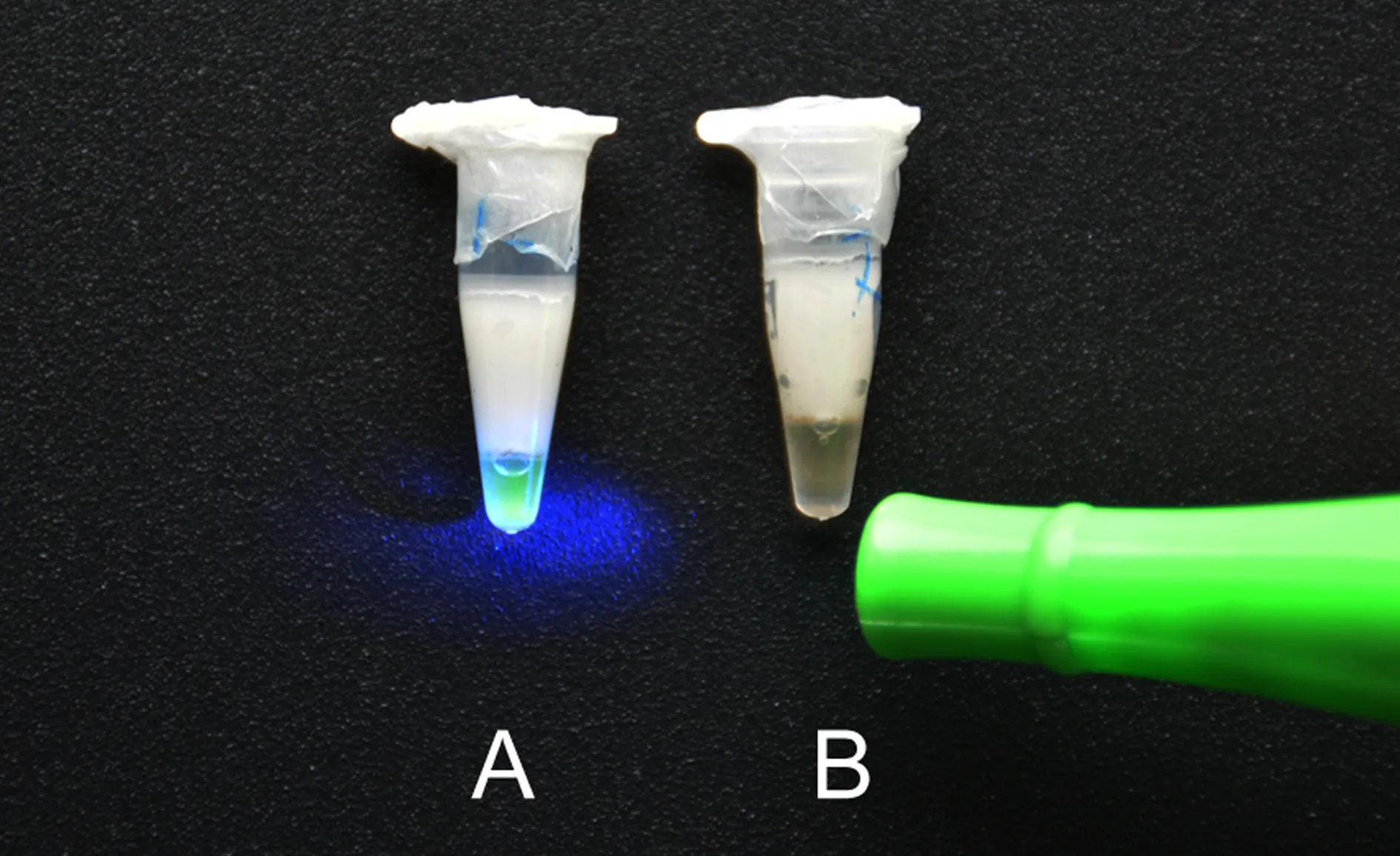
注:A:阳性反应呈亮绿色 B:阴性反应呈桔黄色。
2.5目视LAMP扩增的特异性 琼脂糖凝胶电泳显示,LAMP产物经Sau3AI酶切后,原典型Ladder样条带被切割为一条约120 bp 的条带(图4)。

注:M:DNA Marker;1:LAMP扩增产物;2:LAMP产物Sau3AI酶切。
2.6目视LAMP的检测下限 将系列稀释的质粒作为样品,在便携式LAMP仪上完成目视LAMP的两个阶段反应后,结果显示该法检测下限为1×102拷贝质粒(图5A),而PCR法检测下限为1×103拷贝质粒(图5B)。

注:M:DNA Marker;1:阴性对照;2:1×101拷贝质粒;3:1×102拷贝质粒;4:1×103拷贝质粒;5:1×104拷贝质粒。
3 讨 论
LAMP技术是具有高敏感性和高特异性的核酸检测方法,在病原体检测领域具有较大的应用潜力。该法不需要PCR的变温循环,在65℃单一温度下进行核酸扩增,扩增效率极高,且不依赖昂贵的仪器,适合在现场推广[12,14]。但是LAMP法也存在结果断读困难的问题,反应自然产生的白色沉淀肉眼观察困难,如果反应后开盖加入核酸染料,在提高结果可读性的同时,也增加扩增产物扩增子污染实验体系的风险,限制了LAMP在条件受限地区的现场化应用。本研究利用微晶蜡丸的凝熔特性,制备含有高敏感荧光核酸染料SYBR Green I的蜡丸,在反应前投放在反应管内,从而避免了染料直接进入反应液抑制扩增。在反应的第二阶段,蜡丸熔化为液态后,SYBR Green I的比重大,自然落入到反应液中,受热力影响自然与反应液混匀,并将核酸染色。反应结束后,一旦温度低于微晶蜡的熔点,液态重新凝聚成固态,在LAMP反应液的上层自然形成一道屏障,把扩增产物封闭起来,避免反应管意外开启导致实验环境被扩增子污染,造成持续的假阳性[15]。
LAMP产物电泳后呈特征性Ladder样条带,可被适合的内切酶切割,电泳可对其进行验证。经内切酶Sau3AI消化后,OtGroELLAMP扩增产物被切割成单一条带,与预期一致。使用目视LAMP法检测OtGroEL的下限为1×102拷贝质粒,而同批样本使用普通PCR法检测下限为1×103拷贝质粒,提示LAMP检测的敏感性高于普通PCR法。LAMP反应无需变温,Bst酶在恒温条件下持续高效延伸合成DNA产物,同时LAMP检测反应体系中的引物、酶的用量大,进一步提高了产物量,甚至肉眼可见少量白色沉淀。LAMP高敏感性决定了其易受假阳性困扰,尤其需要严格防止扩增子对实验体系的污染。在病原体LAMP检测开发过程中,常用酶切和电泳来验证LAMP扩增的特异性。酶切需要开盖取样,电泳过程是开放的,因此特别容易产生难以去除的扩增子气溶胶污染。在操作过程中如能做到人员、物品、场所的严格分离,则可很大程度地避免污染LAMP实验体系。
本研究首次应用的LAMP仪的原型机,可以为LAMP扩增反应提供恒温的操作环境,设置简便,易于操作,具有一定的便携性,在锂电池的驱动下,即可实现LAMP扩增。将本仪器与“染料-蜡丸”目视LAMP法联合应用,在没有市电供应的场所,可供LAMP检测顺利开展,使得该方法能够更接近于现场的应用。本研究新设计的针对OtGroEL靶点的LAMP引物,能够检测出1×102个质粒拷贝,结合“染料-蜡丸”和便携式LAMP仪,可以为现场条件下恙螨感染恙虫病东方体的检测提供新的工具。
——一道江苏高考题的奥秘解读和拓展

