毛蚴感染对湖北钉螺生存及抗氧化酶系统的影响
易佳,何汇,李博,涂珍,唐丽,张聪,刘建兵
湖北省疾病预防控制中心,湖北 武汉 430079
湖北钉螺(Oncomelaniahupensis)是日本血吸虫的唯一中间宿主,日本血吸虫毛蚴必须在钉螺体内经过无性繁殖才能发育为感染人、畜的尾蚴[1]。因此,钉螺在日本血吸虫病的传播与流行中起着关键作用[2-3],而控制和消灭钉螺是防控血吸虫病的重要措施[4-6]。为了更好实现防控血吸虫病的目标,开展钉螺的生活史研究(包括血吸虫毛蚴感染阶段)就显得尤为重要。众所周知,包括钉螺在内的所有生物体其体内的氧化还原平衡是机体正常行使功能的基础。因此,评估钉螺感染毛蚴后其抗氧化酶体系的变化对全面认识钉螺生活史具有重要意义。生物体内的氧化还原平衡主要由超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)等组成的抗氧化酶系统调节。当化学物质或机体自身的应激反应激发细胞产生过多的活性氧自由基(reactive oxygen species,ROS)时,SOD、CAT和POD可协同发挥作用,清除活性氧自由基,对增强吞噬细胞防御能力和机体免疫功能有重要作用[7]。当抗氧化防御系统遭到破坏时,活性氧自由基不断积累并攻击细胞膜的脂肪酸发生脂质过氧化反应产生丙二醛(malondialdehyde,MDA),引起氧化损伤反应[8-9]。
毛蚴感染钉螺后,钉螺体内的免疫应答反应将导致螺体内产生大量的不稳定活性氧自由基,进而可能诱导机体抗氧化酶体系激活以适应高度的氧化胁迫压力[10]。然而,目前湖北钉螺对日本血吸虫侵袭感染的氧化应激响应及免疫防御机制仍不清楚。本研究探讨了毛蚴入侵对钉螺存活情况和抗氧化酶体系的影响,旨在为钉螺免疫功能的研究提供参考,也为更加全面认识钉螺生活史提供基础数据。
1 材料与方法
1.1实验材料 在春季药物灭螺前从湖北省阳新县现场采集肋壳钉螺,室内经逸蚴法鉴定为阴性后,用爬行法选取活力较强的成螺(7~8个螺旋)用于实验。采用湖北省血吸虫病防治研究所实验室数次传代的日本血吸虫湖北株尾蚴人工感染家兔,45 d后解剖分离兔肝脏,用捣碎法提取新鲜虫卵,按常规方法孵化获得毛蚴。
1.2实验处理及样本采集 实验设置对照组和实验组,每组各设3个平皿做平行对照。每个平皿中放入500只钉螺,实验组钉螺毛蚴感染参照文献[11],采用钉螺群体感染法,按钉螺与毛蚴数量比为1∶10的比例量取毛蚴孵化液至平皿中;对照组加入同等体积不含毛蚴的去氯水至平皿中。两组同样置于25℃室温4 h,并盖上尼龙纱网防止钉螺爬出。4 h后,将对照组和实验组钉螺分别置于泥钵中饲养,温度保持在22℃。每3天换水加饲料1次,每天清除其中的死亡钉螺并记录各组死亡数量。此外,在感染后的0、6、12、24、48、72 h和1、2、4、6、8、12周从每个泥钵随机挑取10只活钉螺,迅速置于解剖镜下进行解剖,快速分离出软体组织,准确称取钉螺软体组织重量,做好标记,置于-80℃保存待用。
1.3酶活性的测定 按钉螺组织与生理盐水质量比为1∶9的比例加入生理盐水,冰水浴条件下机械匀浆。充分匀浆后,700g离心10 min,取上清液用于蛋白质浓度、酶活及MDA含量的测定。试剂盒均购自南京建成生物工程研究所,所有测定步骤均严格按照试剂盒说明书进行。蛋白浓度测定采用考马斯亮蓝法,测定单位为 g/L;SOD活性测定采用WST-1法,SOD活力单位定义为37℃下,每毫克组织蛋白(mg prot)在每毫升反应液中超氧化物歧化酶抑制率达50%时所对应的酶量为1个活力单位(U);CAT活性测定采用可见光法,CAT活力单位定义为每毫克组织蛋白(mg prot)每秒钟分解1 μmol H2O2的量为1个活力单位(U);POD测定采用比色法,POD活力单位定义为37℃下,每毫克组织蛋白(mg prot)每分钟催化1 μg底物的酶量为1个活力单位(U);采用TBA法测定钉螺组织中的MDA含量。
1.4数据处理 实验数据整理后,用SPSS 22.0进行统计分析。计算各观察时间钉螺的死亡率、酶活性及MDA含量(以算术均数±标准差表示),并用χ2检验比较钉螺存活情况,用双因素方差分析及多重比较分析不同时间点两组间酶活力及MDA含量的差异,以P<0.05为差异有统计学意义。
2 结 果
2.1钉螺感染血吸虫毛蚴后的死亡情况 自感染结束第1周起,每周实验组和对照组均有钉螺死亡,但有血吸虫感染的实验组钉螺每周死亡率均高于对照组,且二者之间差异均有统计学意义(表1)。第10周后实验组钉螺死亡数增多,至15周时实验组钉螺累计死亡率为43.60%,对照组累计死亡率为5.93%。
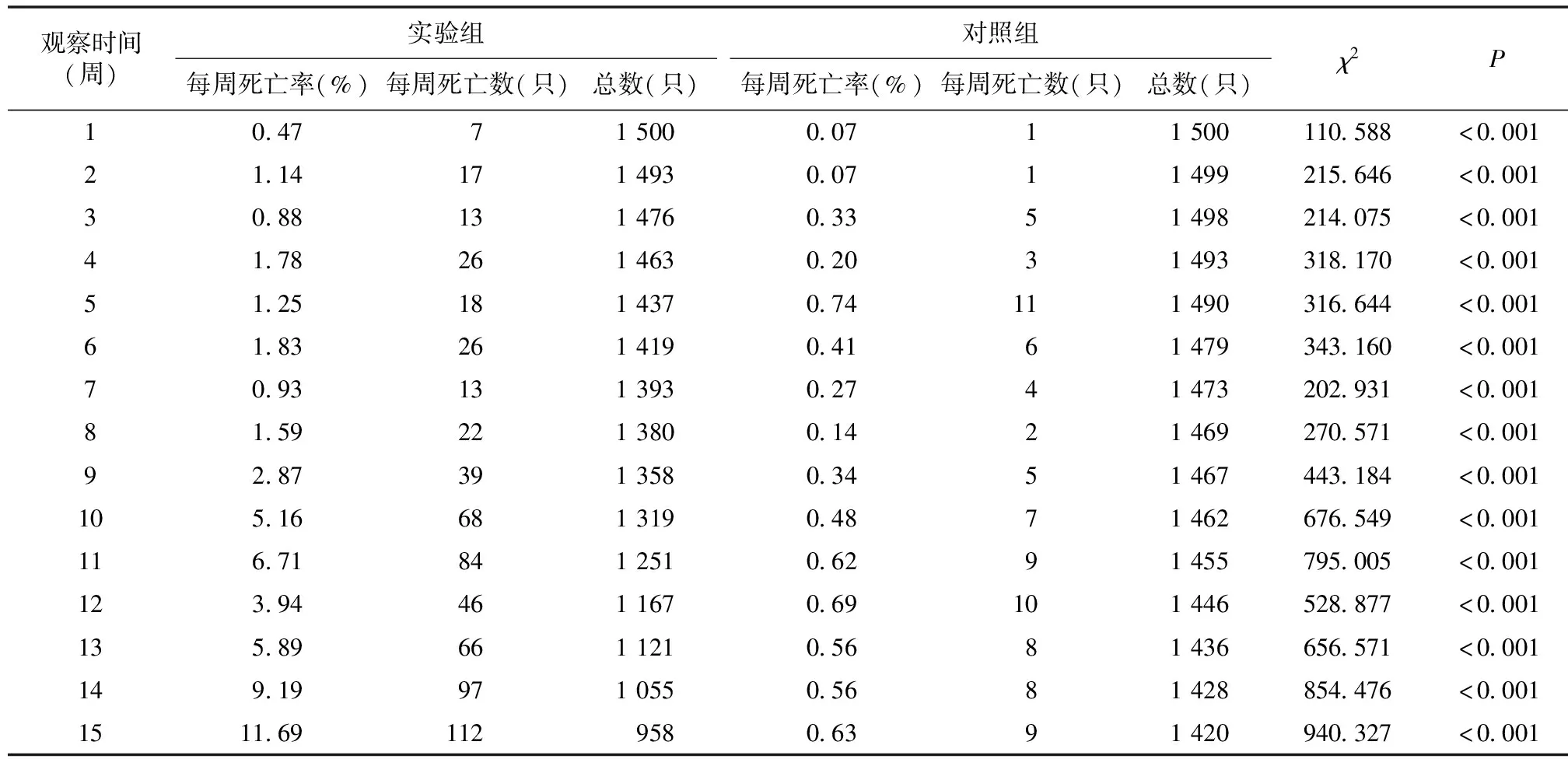
表1 钉螺死亡情况
2.2钉螺感染血吸虫毛蚴后72 h内抗氧化酶活性及丙二醛含量变化 钉螺感染血吸虫毛蚴后72 h内,实验组和对照组钉螺SOD、CAT、POD活性差异有统计学意义(SOD:F=34.63,P<0.01;CAT:F=23.50,P<0.01;POD:F=8.594,P<0.01),实验组钉螺SOD、CAT、POD活性随时间逐步升高。钉螺感染血吸虫毛蚴后24、48、72 h,实验组SOD活性分别为(42.78±5.81)U/mg prot、(46.11±2.91)U/mg prot和(47.91±2.12)U/mg prot,与对照组相比,差异均有统计学意义(P均<0.01)(图1a);感染血吸虫毛蚴后72 h,实验组CAT和POD活性分别为(23.15±1.21)U/mg prot和(15.66±1.44)U/mg prot,较对照组相比活性上升,差异均有统计学意义(P均<0.01)(图1b、图1c)。

注:与对照组比较,*表示P<0.05;**表示P<0.01。
2.3钉螺感染血吸虫毛蚴后12周内抗氧化酶活性及丙二醛含量变化 钉螺感染血吸虫毛蚴后12周内,实验组和对照组SOD、CAT、POD活性和MDA含量差异有统计学意义(SOD:F=88.00,P<0.01;CAT:F=68.69,P<0.01;POD:F=49.19,P<0.01;MDA:F=56.1,P<0.01)。与对照组相比,感染血吸虫毛蚴的钉螺组SOD活性在第1周出现上升,第4周到达峰值,第6周开始下降至对照组水平,随后趋于稳定,第1、2、4周实验组SOD活性与对照组相比,差异均有统计学意义(P均<0.01)(图2a)。实验组CAT活性在第1周就达到峰值,随后开始下降,第4周开始趋近于对照组水平,随后趋于稳定。与对照组相比,第1、2周CAT活性上升,差异均有统计学意义(P均<0.01)(图2b)。实验组POD活性在第1周出现上升,第2周到达峰值,第4周下降,随后趋于稳定。与对照组相比,第1、2周POD活性上升,差异均有统计学意义(P均<0.01)(图2c)。实验组MDA含量随着时间逐渐上升,自第2周开始,MDA含量均高于对照组,且差异均有统计学意义(P均<0.01)(图2d)。

注:与对照组比较,*表示P<0.05;**表示P<0.01。
3 讨 论
钉螺感染血吸虫后,会产生幼虫移行的机械损伤、螺体抗感染的免疫损害、营养物质被掠夺的生理代谢紊乱等损害,甚至导致死亡[12]。关于毛蚴侵入对钉螺生存生长的影响,熊春蓉等[13]发现钉螺与毛蚴按照数量1∶20比例室内人工群体感染4 h后,60 d钉螺死亡率高达71.1%。田月等[14]用不同宿主源性日本血吸虫毛蚴单个钉螺感染法感染钉螺,钉螺与毛蚴数量比为1∶5,感染4 h并室内饲养60 d后,钉螺死亡率为13.5%~49.5%,平均死亡率为 26.8%。本研究中,钉螺人工感染血吸虫毛蚴后,15周(105 d)时累计死亡率为43.60%,与张聪等[11]室内人工感染后110 d钉螺死亡率为43.80%的研究结果较为接近。对照组钉螺15周时累计死亡率仅为5.93%。以往研究报道感染螺的寿命一般为3~6个月,感染了血吸虫的钉螺死亡率明显增高,生存时间显著缩短[15]。
钉螺通常能够通过抗菌肽、凝集素、溶菌酶、酚氧化酶等体液免疫方式攻击入侵的寄生虫[16-18]。除体液免疫外,钉螺血淋巴细胞也会通过吞噬、胞饮和细胞毒反应防御入侵的寄生虫,在此过程中血淋巴细胞会消耗大量的氧,并产生多种活性氧化物。钉螺等需氧生物具有SOD、CAT和 POD等组成的较为完整的抗氧化酶系统,能及时清除活性氧化物,而使自身免于遭受氧化伤害[19-20]。本研究中,感染早期钉螺的抗氧化酶活性升高,SOD活力在24 h、CAT和POD活力在72 h开始与对照组有统计学差异,MDA值72 h内无明显变化,说明毛蚴入侵能够诱导钉螺启动抗氧化系统,产生抗氧化防御,即为了阻止活性氧带来的氧化损伤,螺体内合成分泌大量SOD、CAT和POD来维持正常的新陈代谢。随着时间的延长,抗氧化酶活性逐渐降低,SOD活性在感染后第6周、CAT和POD活性在第4周时趋近于对照组水平。而MDA自第2周开始呈现不断积累趋势,可能是抗氧化酶系统逐渐遭到破坏,大量活性氧自由基不能及时清除,导致脂质过氧化反应产物增多,丙二醛含量增多间接反映了钉螺氧化损伤程度在不断加剧,这也与感染钉螺死亡情况相一致。自第2周开始,实验组和对照组钉螺死亡率差异有统计学意义,并且随时间延长,氧化损伤加剧,实验组钉螺死亡率逐渐升高。
总之,本研究表明感染早期钉螺能够通过调节抗氧化酶的活性来适应毛蚴入侵的胁迫,以清除体内积累的活性氧自由基,免受氧化损伤。然而,随着毛蚴在钉螺体内增殖、生长和发育,钉螺的抗氧化酶体系可能逐渐失效,钉螺组织氧化损伤的程度加剧,导致钉螺出现死亡。本研究有助于加深对血吸虫与钉螺共存机制的认识,也为钉螺免疫功能的研究提供参考依据。

