病变周围区域与病变内部区域的MRI影像组学特征对临床显著性前列腺癌的诊断价值
张 涵 毛 宁 谢海柱 李天平 骆训容 李祥林
1 滨州医学院医学影像学院 山东 烟台 264003; 2 烟台毓璜顶医院影像科 山东 烟台 264000
前列腺癌(prostate cancer,PCa)的发病率与死亡率逐年升高,已成为威胁男性生命健康的主要因素之一[1-2]。其中,Gleason评分≥3+4或(和)肿瘤体积≥0.5 cm3或(和)肿瘤前列腺外侵犯的前列腺癌被定义为临床显著性前列腺癌(clinically significant prostate cancer,csPCa)。而非临床显著性前列腺癌(clinically insignificant prostate cancer,ciPCa)通常生长缓慢,不需要干预性治疗[3]。因此早期明确诊断csPCa对于给予患者针对性治疗、提高前列腺癌患者生存率具有重要意义。
随着影像组学(radiomics)的兴起与发展,已经有大量研究将影像组学应用于csPCa的诊断[4-7],然而上述研究中的影像组学特征提取自病变内部区域。随着科研人员对肿瘤机制研究的深入,相关研究发现肿瘤的微环境在肿瘤的生成与进展中起到了重要作用[8-9]。因此,本研究提取了病变周围区域的MRI影像组学特征,并将其对csPCa的诊断价值与病变内部区域的MRI影像组学特征对csPCa的诊断价值进行比较。
1 资料与方法
1.1 一般资料 本研究回顾性分析了2017年3月至2019年12月于毓璜顶医院进行前列腺磁共振扫描检查的患者资料。纳入标准为:进行过前列腺磁共振扫描检查;在磁共振检查后4周内进行前列腺穿刺活检或前列腺切除术后且前列腺内病变类型得到病理证实。排除标准为:磁共振检查前6个月内进行过前列腺穿刺活检;磁共振检查前接受过内分泌治疗、放射治疗等治疗;前列腺MRI图像内未发现可疑病变或可疑病变边缘模型无法勾画感兴趣区(region of interest,ROI);图像存在伪影或影像资料不完整;前列腺被其它肿瘤侵犯。最终140名患者被纳入本研究,并按照4∶1的比例随机分为训练集112人,测试集28人。通过查询电子病历系统获取患者的年龄、血清前列腺特异性抗原(prostate specific antigen,PSA)浓度以及前列腺穿刺活检或前列腺切除病理结果。前列腺穿刺结果与前列腺切除病理结果并存时,以前列腺切除的病理结果为准。
1.2 图像扫描 本研究纳入的MRI图像通过3.0T磁共振扫描仪(GE 750W,美国)扫描获得,扫描线圈为16通道腹部线圈。纳入研究的序列包括T2加权成像(T2 weighted imaging,T2WI)、表观弥散系数(apparent diffusion coefficient,ADC)、动态对比增强磁共振成像(dynamiccontrast-enhanced magnetic resonance imaging,DCE-MRI)。图像扫描参数为:T2WI回波时间为95 ms,重复时间为3 000 ms,层厚为3 mm,矩阵为400×400,层间距为0,扫描视野为252 mm×224 mm;DWI回波时间为67 ms,重复时间为4 600 ms,层厚为4 mm,矩阵为128×128,层间距为0;b值为0、1000 mm2/s;DCE-MRI回波时间为1.37 ms,重复时间为3.7 ms,体素尺寸为0.76 mm×0.76 mm×1.5 mm,层间距为3 mm,扫描视野为220 mm×220 mm。DCE-MRI扫描时使用高压注射器在预扫描后以2.5 mL/s的速率经肘静脉注射钆对比剂(钆喷酸葡胺,Bayer Pharma AG,德国),用量为0.2 mmol/Kg体重,经生理盐水稀释后,注射剂量为0.2 mL/Kg体重,共扫描13期。
1.3 感兴趣区分割 首先运用3D slicer(Version 4.10.2 r28257)[10]软件中的“Segment Editor”模块分别在T2WI、ADC及DCE-MRI强化后第一期序列图像上逐层手动勾画可疑病变的边界,获取可疑病变内部区域(intralesional volume,ILV)。然后运用3D slicer中的“Dilate Label Map”模块对获得的ILV标签进行膨胀处理。本研究将前列腺可疑病变周围5 mm区域定义为前列腺病变周围区域(perilesional volume,PLV)。依据T2WI、ADC及DCE-MRI序列的像素尺寸,膨胀半径分别设置为10、3、7,人工去除超出前列腺边缘的部分。接下来运用“Subtract Scalar Volumes”模块从膨胀后的标签去除ILV,得到的区域即为PLV。分割工作首先由两位影像科医师(医师1、医师2,分别具有3、5年前列腺磁共振诊断经验)对随机挑选的30名患者的图像同时进行分割,剩余患者图像的分割工作由医师2完成。医师2在间隔1个月后再次对上述30名患者的图像进行分割。
1.4 影像组学特征提取及特征可重复性评估 运用3D slicer中的“Radiomics”模块分别在T2WI、ADC及DCE-MRI强化后第一期图像内提取两名医师勾画的所有ROI内的影像组学特征。选择提取的影像组学特征包括形状特征、一阶直方图特征及纹理特征。通过医师1与医师2同时勾画的ROI内的影像组学特征计算组间相关系数,运用医师2对30名患者的图像两次勾画的ROI内的影像组学特征计算组内相关系数,运用组内相关系数及组间相关系数对勾画ROI内的影像组学特征的可重复性进行评估,组内相关系数及组间相关系数大于0.8则认为影像组学特征具有良好的可重复性。
1.5 影像组学特征筛选及诊断模型建立 首先通过单变量分析去除患有csPC患者与未患有csPCa患者中差异无统计学意义的特征。然后通过最小绝对值收敛和选择算子(least absolute shrinkage and selection operator,LASSO)筛选出对诊断csPCa最有价值的特征,筛选特征过程中运用10折交叉验证确定LASSO中最优λ值。基于最优λ值确定LASSO回归中每个特征对应的系数及截距项,分别构建基于LASSO回归的ILV、PLV预测模型。通过预测模型使用相应影像组学特征数据计算出每个患者的影像组学积分(radiomics score,RS)及每个患者患有csPCa的概率,并比较患有csPCa患者与未患有csPCa患者的RS。
1.6 诊断模型效能评估与比较 通过受试者操作特征(receiver operating characteristic,ROC)曲线分析分别评估ILV预测模型与PLV预测模型在训练集及测试集中的区分能力,约登指数作为模型的截断点。同时运用准确率(accuracy)分别评估ILV预测模型与PLV预测模型预测csPCa的准确性。运用德隆检验(Delong test)比较ILV预测模型与PLV预测模型的诊断效能。

2 结果
2.1 一般资料情况 在112名训练集患者中,有64名患者患有csPCa, 患有csPCa的比例为57%。在28名测试集患者中,有18名患者患有csPCa, 患有csPCa的比例为0.64%。训练集与测试集患者的年龄、血清PSA浓度及患有csPCa的比例差异均无统计学意义,见表1。
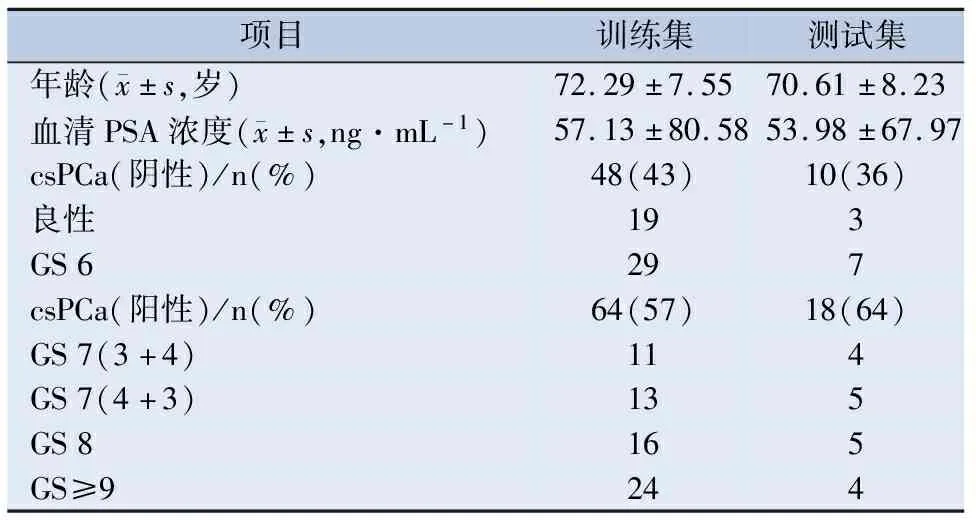
表1 训练集及测试集患者的一般资料情况
2.2 影像组学特征提取及特征可重复性评估 每个序列从每个感兴趣区中提取851个影像组学特征,包括14个形状特征,162个一阶直方图特征及675个纹理特征。从每个患者每个感兴趣区中共提取2 553个影像组学特征,最终从每个患者共提取5 106个特征。组内相关系数及组间相关系数分别为0.84、0.82,影像组学特征具有良好的可重复性。
2.3 影像组学特征筛选及诊断模型建立 通过单变量分析,ILV、PLV特征数据集中分别剩余236、119个影像组学特征。通过LASSO筛选特征最终在ILV、PLV最优数据集中均包含6个影像组学特征,影像组学名称及相应的系数见图1。ILV、PLV预测模型的每个患者的RS在训练集与测试集中差异均有统计学意义(P<0.05)。
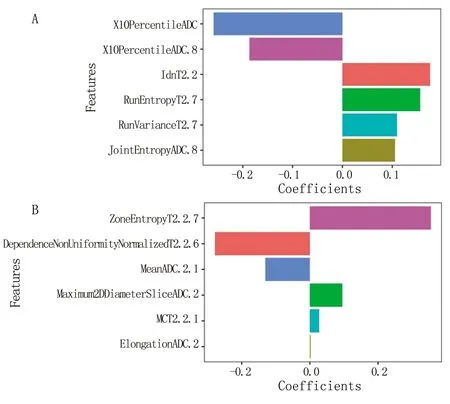
A.ILV预测模型特征及相应系数;B.PLV预测模型特征及相应系。
2.4 诊断模型效能评估与比较 ILV预测模型在训练集、测试集中的受试者操作特征曲线下面积(area of receiver operating characteristic curve,AUC)分别为0.91(95%置信区间为0.86~0.97,特异性为0.88,敏感性为0.86,)和0.91(95%置信区间为0.79~1,特异性为0.94,敏感性为0.80),准确率分别为0.82(95%置信区间为0.74~0.89)和0.89(95%置信区间为0.72~0.98)。PLV预测模型在训练集、测试集中的AUC分别为0.89(95%置信区间为0.84~0.95,特异性为0.77,敏感性为0.88)和0.87(95%置信区间为0.72~1,特异性为0.94,敏感性为0.64),准确率分别为0.82(95%置信区间为0.63~0.94)和0.81(95%置信区间为0.73~0.88)。ILV模型与IPLV模型的截断点均为0.57。ILV、PLV模型的ROC曲线见图2。ILV模型与IPLV模型的诊断效能差异无统计学意义。
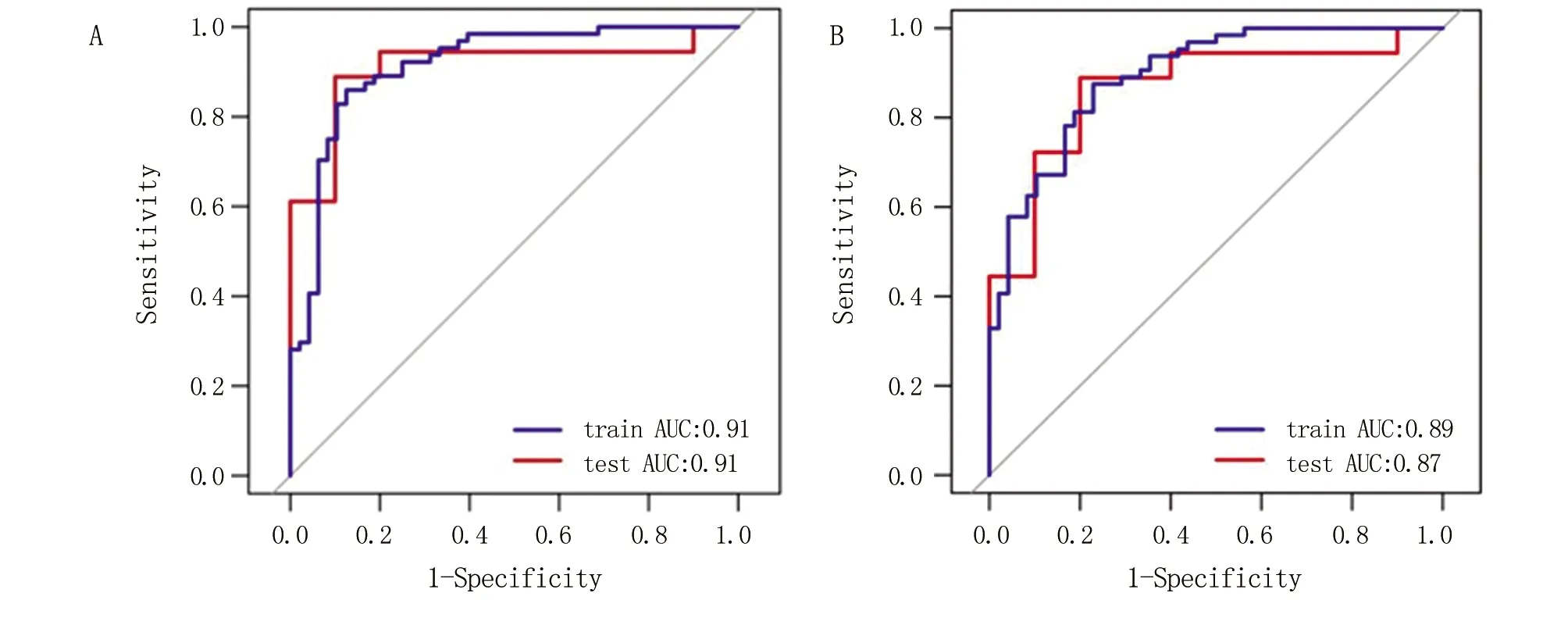
A.ILV模型在训练集及测试集中的ROC曲线;B.PLV模型在训练集及测试集中的ROC曲线。
3 讨论
本研究提取了肿瘤内部及肿瘤边缘区域的MRI影像组学特征,并分别筛选影像组学特征后构建基于LASSO回归的预测模型预测患者患有csPCa的概率。基于肿瘤内部的MRI影像组学特征的模型的诊断效能高于基于肿瘤边缘区域的MRI影像组学特征的模型的诊断效能,但两者差异无统计学意义。本研究初步验证了前列腺可疑病变周围区域的影像组学特征对于csPCa的诊断价值。
目前已有相关研究将影像组学应用于csPCa的诊断。Zhang等[11]联合多模态磁共振成像影像组学特征、临床风险因子构建模型鉴别csPCa与ciPCa,取得了良好的预测效果。Bernatz等[13]比较了不同机器学习算法及不同影像组学特征对于影像组学模型预测前列腺外周带csPCa的影像,最终发现不同影像组学特征及不同机器学习算法对前列腺癌外周带csPCa的预测存在一定的影响,不同的影像组学预测模型预测效果存在一定差异。Cuocolo等[7]探究了对诊断csPCa最有价值的形状特征,发现提取自ADC的肿瘤表面积与体积的比值是诊断csPCa最有价值的形状特征。上述研究初步验证了基于MRI的影像组学特征对csPCa的诊断价值,但影像组学特征均提取自病变内部。本研究提取了病变区域周围的影像组学特征,并建立了预测模型,且将其诊断效能与基于病变内部的影像组学特征的预测模型进行比较,进一步探究了基于MRI的影像组学特征对诊断csPCa的价值。
本研究在DCE-MRI强化后第一期进行影像组学研究。对于影像组学研究中增强扫描不同强化期的影像组学特征对于预测模型预测效果的影响,已有学者在前列腺癌及其它癌症领域做了研究。Liu等[13]研究发现,对于前列腺侵袭性的预测,增强扫描强化后第一期的影像组学特征的表现好于强化最明显期的影像组学特征的表现。Nie等[14]发现,强化后第3期的影像组学特征对于直肠癌化疗效果的预测有较好的表现。Fan等[11]发现,增强扫描前3期的影像组学特征对于预测乳腺癌对新辅助化疗疗效具有应用价值。前列腺癌作为富血供肿瘤,具有早期强化的特点,在增强扫描强化后第一期强化程度高于周围前列腺组织,前列腺癌的边缘相对于其它期能较好地显示。
本研究也有其不足之处。首先,本研究为回顾性研究,需要进一步前瞻性研究对本研究的结果做进一步验证。其次,本研究用手动勾画的方法分割ROI,分割结果存在一定的主观性,然而研究中通过组内相关系数及组间相关系数对影像组学特征的可重复性进行了评估,结果表明本研究中的影像组学特征具有较好的可重复性,间接证明了研究中ROI分割具有较好的可重复性。最后,本研究的数据来自单中心,未来需要多中心研究对本研究结果做进一步探究。
综上所述,前列腺可疑病变周围区域的MRI影像组学特征对于csPCa的诊断价值具有一定的价值。基于前列腺可疑病变周围区域的MRI影像组学特征与可疑病变内部的MRI影像组学特征的诊断模型诊断csPCa的效能差异无统计学意义。

