直径≤3 cm非小细胞肺癌淋巴结转移危险因素及规律的研究
佘天宇 佘真真 徐海涛 刘建伟 刘 帅 张靖雨 张庆广
1 滨州医学院附属医院胸外科 山东 滨州 256603;2 无棣县人民医院心电图室 山东 滨州 251900
肺癌是我国恶性肿瘤中发病率和死亡率增长速度最快、对人群健康和生命威胁最大的恶性肿瘤之一。肺癌的组织学类型主要为非小细胞肺癌(non-small cell lung cancer,NSCLC),占肺癌病例总数的85%左右,其病理学类型包括腺癌、鳞癌和大细胞癌等,以腺癌最为多见[1-2]。肺癌最常见的转移途径是淋巴结(lymph node,LN)转移和血行转移,LN转移情况是决定肺癌分期、治疗方案及预后的重要因素[3]。早期NSCLC应首选手术治疗,手术时系统清扫淋巴结(systematic lymph node dissection,SLND),对NSCLC明确N分期、指导术后辅助治疗、提高患者术后无病生存期有着重要作用,然而其并发症及对患者的创伤也随之增加。在早期肺癌患者手术中,淋巴结清扫范围一直存在争议[4]。近年来许多学者认为选择性淋巴结清扫(elective lymph node dissection,ELND)在早期肺癌患者的无病生存期,肿瘤复发率的研究中与SLND比较无统计学意义。因此,笔者通过分析直径≤3 cm NSCLC淋巴结转移危险因素及规律,以期实现肺癌个体化治疗,为指导患者术中淋巴结清扫范围提供理论依据。在不影响患者生存期的前提下,完全清扫可能发生转移的淋巴结同时,缩小淋巴结清扫范围,减少患者术后并发症及术中创伤。
1 资料与方法
1.1 一般资料 选取滨州医学院附属医院2010年1月—2020年7月期间行手术治疗的526例NSCLC患者的临床数据,其术前均由患者或家属签署手术同意书,符合医学伦理道德标准。临床特征包括患者性别、年龄、吸烟史(吸烟指数)、血清CEA、病理类型、病变位置(左右肺,上中下叶)、肿瘤直径、脉管瘤栓、胸膜受侵情况及淋巴结转移情况等,见表1。
表1 病例研究纳入标准及排除标准
1.2 方法
1.2.1 手术及TNM分期 患者均采用肺叶/肺段切除及系统性淋巴结清扫术,我科常规清扫第2-14组淋巴结,其中左侧包括4L、5、6、7-14组,右侧包括2R、3、4R、7-14组。TNM分期采用国际肺癌研究学协会(International Association for the Study of Lung Cancer,IASLC)第八版肺癌分期标准,对纳入病例重新分期。N1淋巴结是指第10~14组,N2淋巴结是指第1~9组。着重强调胸膜受侵在分期中的作用,在直径≤3 cm NSCLC中,不论肿瘤大小,脏层胸膜受侵犯即为T2a期。跳跃性转移是指N1淋巴结(-),N2淋巴结(+)。跨区域跳跃性转移是指上叶肺癌仅出现7~9组淋巴结(+),下叶肺癌仅出现1~6组淋巴结(+)。
1.2.2 病理诊断方法 所有手术标本应用甲醛溶液固定后取材分析,石蜡切片,行HE和弹力纤维(elastic fibers ,EFs)染色,报告由教授等上级医师审核后,统一诊断结果。
1.2.3 统计学分析 采用SPSS 23.0软件行数据统计学分析,率的比较、单因素分析采用χ2检验,筛选具有统计学意义(P<0.05)的变量;多因素分析采用Logistic回归分析,P<0.05,确定淋巴结转移的独立危险因素。
2 结果
2.1 526例患者的临床特征和淋巴结转移情况 纳入此次研究的526例患者,其手术方式均为肺叶/肺段切除+淋巴结清扫术,30 d内无死亡病例。病例中男性患者234例,女性292例;年龄在31~79岁之间,平均年龄为59.39岁;血清CEA≥3.5 ng/L者112例,CEA<3.5 ng/L者414例;腺癌者478例,鳞癌者40例,其他类型者8例;右肺者354例,左肺者172例;上叶者296例,中叶者49例,下叶者181例;直径0<Ø≤1 cm者109例,1 cm<Ø≤2 cm者253例,2 cm<Ø≤3 cm者164例;脏层胸膜受侵者119例,胸膜未受侵者407例。共清扫淋巴结8 966枚,发生转移的387枚,转移率为4.32%;N1淋巴结发生转移的有76例,转移率为14.45%,N1、N2共同转移的有36例,转移率为6.84%;跳跃性N2淋巴结发生转移的有49例,转移率为9.32%。
2.2 淋巴结转移危险因素的χ2检验分析 单因素χ2检验分析显示,患者年龄、性别、肿瘤的病理类型、脉管瘤栓、血清CEA、肿瘤直径、脏层胸膜受侵与淋巴结转移存在统计学差异,是淋巴结转移的危险因素(P<0.05)。患者吸烟史及肿瘤的位置(左右肺、上下叶)与淋巴结转移无关,见表2。
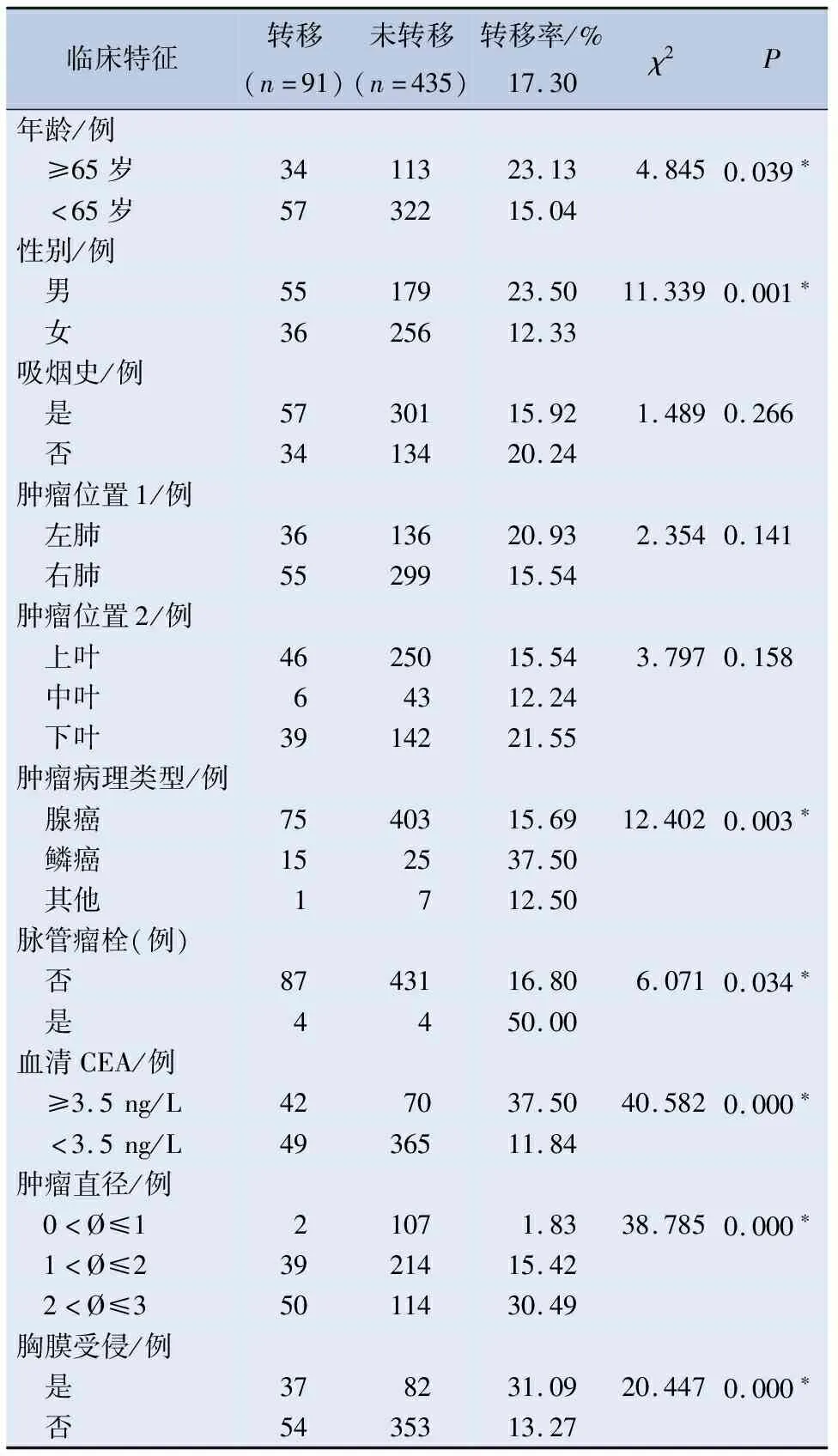
表2 526例直径≤3 cm NSCLC淋巴结转移危险因素的χ2检验分析
2.3 淋巴结转移危险因素的Logistic回归分析 对单因素分析有统计学意义的变量进行多因素Logistic回归分析显示,肿瘤的类型、肿瘤直径、血清CEA、脉管瘤栓、脏层胸膜受侵犯是淋巴结转移的独立危险因素(P<0.05),见表3。
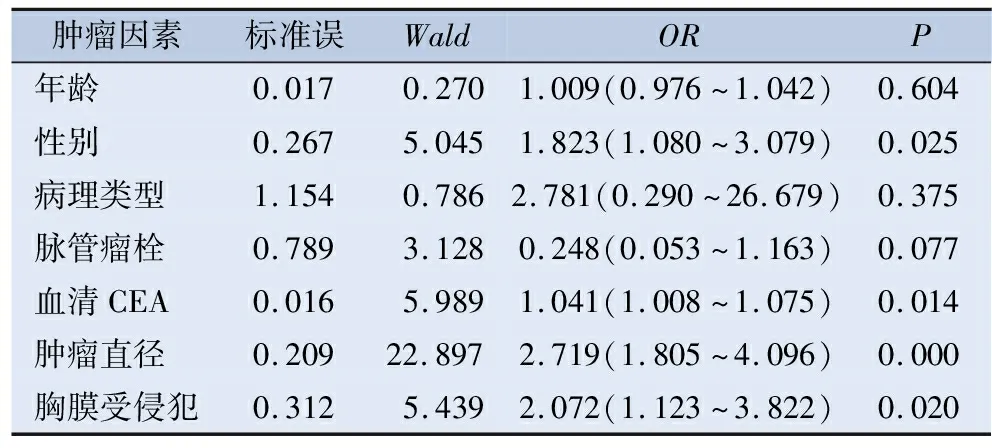
表3 多因素Logistic回归分析危险因素与淋巴结转移关系
3 讨论
肺癌是我国最常见的恶性肿瘤,在国际范围内,肺癌也是癌症患者死亡的主要原因。近年来,许多国家报道称肺癌的发病率和死亡率均居首位。随着低剂量CT在体检中的普遍应用,越来越多的肺癌患者在体检时被发现,其多数患者肿瘤直径≤3 cm,处于早期[5]。解剖性肺叶切除+系统性淋巴结清扫被视为NSCLC根治的标准术式。但随着肺癌患者趋于年轻化,以往经典的肺叶切除+系统性淋巴结清扫的术式不断受到挑战。既能最大程度清扫可能转移的淋巴结,又能减少过度清扫带来的免疫力下降及创面渗出的手术方式越来越受欢迎。但许多学者分析直径≤3 cmNSCLC淋巴结转移危险因素及规律,为实现肺癌个体化治疗,患者术中淋巴结清扫术式的选择具有指导意义,在不影响患者生存期的前提下,完全清扫可能发生转移的淋巴结的同时,缩小淋巴结清扫范围,减少患者术后并发症及术中创伤值得深入研究。
对术中淋巴结的清扫方式各持己见[6],部分学者认为行SLND的患者可以延长总生存期,防止术后复发和转移;但也有部分学者认为SLND方式增加患者的创伤,损伤其免疫系统,并没有给早期患者带来生存效益。马锴等[7]研究IA期直径≤2 cm的患者中,系统清扫淋巴结及采样清扫淋巴结,其5年生存率及无病生存期差异无统计学意义。
目前我国男性肺癌发病率和死亡率在男性所有恶性肿瘤中居第一位;女性肺癌发病率在女性所有恶性肿瘤中居第二位,死亡率居第一位。可能与男性直接吸烟及间接吸入二手烟有关系。
对于病理类型而言,一般来说腺癌较鳞癌更容易发生LN转移,本次研究中,腺癌淋巴结的转移率为15.69%,鳞癌的淋巴结转移率为37.5%,两者单因素分析差异有统计学意义,但多因素分析时,病理类型差异无统计学意义,不是淋巴结转移的独立危险因素,可能与样本中鳞癌患者少或者总样本容量少有关系。肺癌主要转移途径为血行转移及淋巴结转移,脉管瘤栓极为可能与淋巴结转移有直接的关系,目前尚未研究清楚。在多因素Logistic回归分析中,脉管瘤栓亦为淋巴结转移的独立危险因素。
肺癌的肿瘤标记物在临床上被认为与肿瘤的发生、发展和转归有密切的关系[8]。目前越来越多的标记物如CEA、SCC、NSE、EGFR、HER-2等被发现。CEA的显著升高在恶性肿瘤的鉴别诊断、病情监测、疗效评价等方面有重要的临床价值。这与Cabrera-AL等[9]的研究结果CEA与存在阳性淋巴结显著相关,其水平是淋巴结恶性参与的临床预测因子结果一致。同样也证明了Hattori的研究CEA水平是淋巴结转移的重要预测因子是正确的[10]。
对于直径≤3 cm的NSCLC中,随着肿瘤直径的增大,淋巴结转移率逐渐增加[11]。Xiong等[12]也证实了T分期是影响N1N2淋巴结转移的独立危险因素,这与Lee等[13]学者的研究结果纵隔淋巴结转移率与病变直径成正相关相一致。
脏层胸膜受侵犯(visceral pleura invasion,VPI)是肿瘤具有侵袭性的标志之一,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南将VPI列为IB期NSCLC术后复发转移及预后不良的危险因素[14]。多位学者研究表明脏层胸膜受侵的NSCLC淋巴结转移率更高,但其发生机制不明确,目前尚不清楚VPI肿瘤是否需要更广泛的淋巴结清扫来优化生存。癌细胞通过淋巴液、淋巴管转移是最常见的转移方式,该途径与正常生理性淋巴液回流通路相一致。法国学者M Qiquet通过解剖肺癌患者尸体发现,脏层胸膜下的淋巴液可不通过肺内的淋巴通路直接回流到上纵隔和支气管旁淋巴结,此通路可能与肺癌患者淋巴结跳跃性转移有关,也可能增加了受累胸膜附近淋巴结转移的可能性[15-16]。
综上所述,直径≤3 cm的NSCLC淋巴结转移受多种因素的影响。本研究发现,患者男性、脉管瘤栓、2 cm<肿瘤直径≤3 cm、血清CEA≥3.5 ng/L、脏层胸膜受侵犯是淋巴结转移的独立因素,这类患者应行系统性淋巴结清扫。当患者肿瘤直径≤1 cm时,淋巴结转移率极低,若患者不存在上述危险因素时,可选择淋巴结采样或不清扫,以减少手术中给患者带来的创伤,此观点与宋祥华等人的研究观点一致[17]。当患者肿瘤直径在1~3cm之间时,随着肿瘤直径的增加,淋巴结转移率逐渐增高,若患者术前血清CEA≥3.5 ng/L、术中脏层胸膜受侵犯,手术应行系统性淋巴结清扫;若患者不存在上述危险因素,可根据术中病理,指导淋巴结清扫范围。未来手术应更专注患者淋巴结转移的危险因素及规律,根据其规律选择合理的淋巴结清扫方式,以减少不必要的创伤。

