不经胸切除术治疗合并慢性阻塞性肺疾病食管癌的效果研究
杨三虎,杨 锋
(空军军医大学第二附属医院胸腔外科,陕西 西安 710038)
近年来随着人们膳食结构及生活习惯的改变,食管癌的发病率持续增高[1-2]。外科手术为临床治疗食管癌的重要方法,传统经典根治术可有效切除病灶,但存在创伤较大、术后康复慢、并发症多等问题[3-5]。同时,针对合并慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的食管癌患者,传统经典根治术会不同程度损伤肺功能,导致患者出现乳糜胸、脓胸等并发症,影响患者肺功能康复及预后[6-7]。近年来,不经胸食管癌切除术在合并COPD的食管癌治疗中得到重点关注,其主要是利用充气式纵隔腔镜技术实施相关操作,可不经胸切除病灶,从而减少创伤及对肺功能造成的影响[8]。但关于不经胸食管癌切除术治疗合并COPD的食管癌在减轻炎性应激反应、免疫功能损伤等方面是否具有显著优势尚不明确,基于此,本研究拟选取我院合并COPD的食管癌患者102例,探讨经典根治术与不经胸食管癌切除术的治疗效果,以期为临床提供参考。
1 资料与方法
1.1 临床资料
选取2019年1月至2020年2月我院合并COPD的食管癌患者102例,根据手术方案分为不经胸切除组与经典组,每组51例。不经胸切除组采取不经胸切除食管癌策略,经典组采取传统经典根治术。纳入标准:①符合《食管癌和胃癌治疗指南》[9]中食管癌的诊断标准,符合《慢性阻塞性肺疾病基层诊疗指南(实践版·2018)》[10]中COPD的诊断标准;②年龄<80岁;③临床分期为Ⅰ~Ⅲa期。排除标准:①合并其他良恶性肿瘤;②合并心、肺等脏器器质性病变;③合并严重高血压及糖尿病;④既往采取放化疗治疗;⑤存在血液系统、内分泌系统、代谢系统病变;⑥发生周边脏器侵犯。2组患者性别、年龄、病灶长度、病灶位置、临床分期、病理分型等临床资料均衡可比(P>0.05),见表1。本研究经我院医学伦理委员会审批通过。
1.2 方法
1.2.1 经典组 患者取右侧卧位,全身麻醉后于左后外侧第6肋间行切口进入胸腔,打开纵隔胸膜,游离食管;打开膈肌,游离胃部,离断胃左动脉与胃动静脉,对胃网膜右动静脉予以保留,贲门与部分胃小弯经一次性切割闭合器切除,实施管状胃成形术,连续缝合包埋管状胃断端;于左颈作5 cm切口,切断食管,采用一次性机械吻合器对管状胃体左颈和食管断端实施端侧吻合,实施二野淋巴结清扫术,包括胃左动脉旁、胃小弯侧、贲门旁、食管旁、隆突下等部位淋巴结。
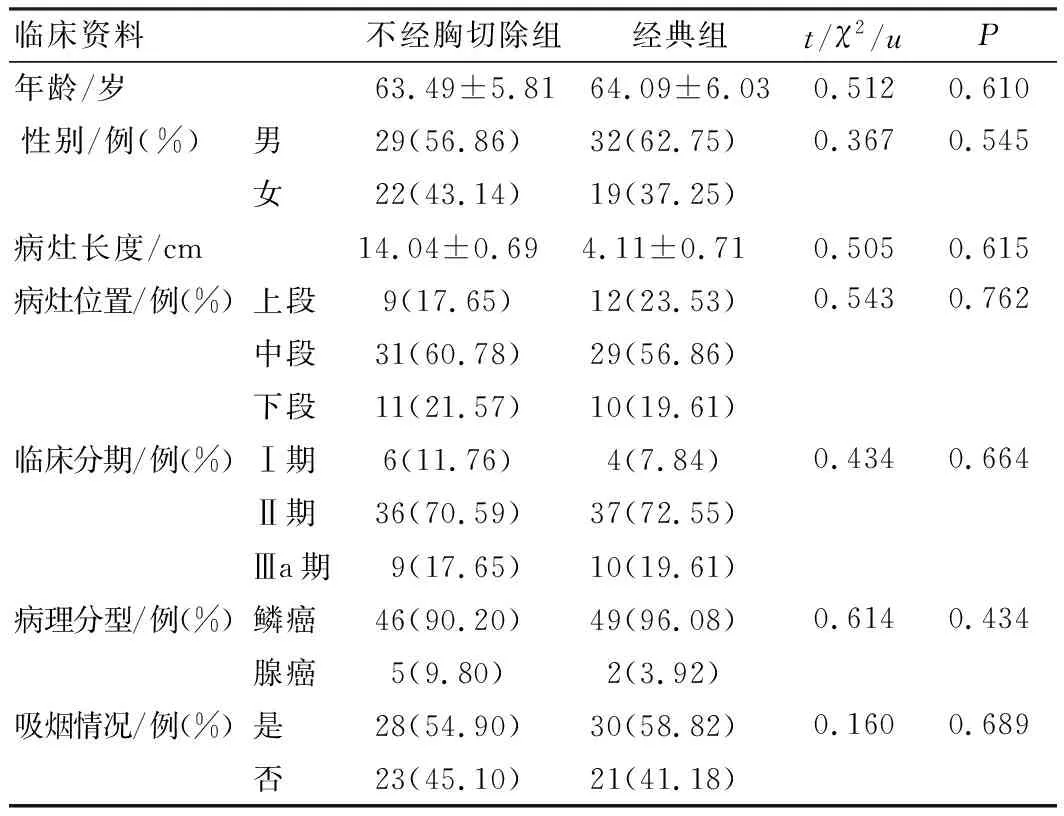
表1 患者临床料比较(n=51)
1.2.2 不经胸切除组 患者单腔气管插管复合全身麻醉,双肺通气,仰卧位,双腿分开约60°,垫高胸背部,头颈后仰、偏向右侧,颈下垫圆枕。颈部操作:采取Y型管,腹部与纵隔同时充入CO2,压力维持在12~16 mmHg,于左颈锁骨上1 cm作5 cm左右的横向切口;沿胸锁乳突肌内侧竖向游离至食管,放入专用保护套,游离喉返神经并作标记处理;Trocar(3个)穿入专用保护盖并固定于保护套内,构成密闭空间,充入CO2扩大操作空间。游离食管时注意显露奇静脉与胸导管,避免损伤奇静脉造成无法控制性出血。腹部操作:于双侧锁中线和平脐水平线交汇处、两侧锁中线和肋弓交汇处、剑突下作穿刺点,构建气腹,经腹腔镜辅助游离胃组织至食管裂孔,向上继续游离食管;常规清扫胃左动脉旁、食管旁、隆突下、贲门旁和胃小弯侧淋巴结,双侧相向游离食管、汇合(操作过程中注意保护奇静脉、胸导管);于剑突下作4 cm左右切口,自贲门切断食管,将残胃制作为直径约3~5 cm的管状胃;于管状胃最高处进行缝合,并自颈部提出食管,荷包缝合食管上端吻合器头,经纵隔食管床牵拉管状胃到左颈实施胃食管手工吻合或者器械吻合。
1.2.3 检测方法 抽取外周静脉血6 mL,离心取上清液,采用美国Bio-RAD公司Bio-RAD550型酶标仪与配套试剂盒经酶联免疫吸附法测定血清炎性因子[白细胞计数(white blood cell count,WBC)、C反应蛋白(C-reactive protein,CRP)、白细胞介素-6(interleukin-6,IL-6)]水平和氧化应激反应指标[血清皮质醇(cortisol,Cor)、超氧化物岐化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)]水平;经FACS Caliber型流式细胞仪测定免疫功能指标(CD3+、CD4+、CD4+/CD8+)水平;采用日本福田ST-150型肺功能仪测定肺功能指标[用力肺活量(forced vital capacity,FVC)、第1秒用力呼气量(forced expiratory volume in the first second,FEV1)、最大通气量(maximum ventilation,MVV)]水平。
1.3 观察指标
统计2组患者手术情况(手术时间、术中失血量、引流时间、淋巴结清扫数目、住院时间);统计2组患者术前及术后1 d、3 d血清炎性因子(WBC、CRP、IL-6)、氧化应激反应指标(Cor、SOD、MDA)及免疫功能指标(CD3+、CD4+、CD4+/CD8+)水平;统计2组患者术前及术后1 d、1个月肺功能指标水平,包括FVC、FEV1、MVV;统计2组患者术后并发症发生率。
1.4 统计学方法
2 结果
2.1 患者手术情况比较
2组患者淋巴结清扫数目比较,差异无统计学意义(P>0.05);不经胸切除组患者手术时间、引流时间、住院时间、术中失血量短/少于经典组,差异具有统计学意义(P<0.05),见表2。
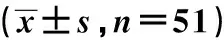
表2 患者手术情况比较
2.2 患者血清炎性因子水平比较
术前2组患者血清WBC、CRP、IL-6水平比较差异无统计学意义(P>0.05);2组患者术后1 d、3 d血清WBC、CRP、IL-6水平均较术前增高,但不经胸切除组血清WBC、CRP、IL-6水平均低于经典组,差异均具有统计学意义(P<0.05),见表3。
2.3 患者氧化应激反应指标水平比较
术前2组患者血清Cor、SOD、MDA水平比较差异无统计学意义(P>0.05);2组患者术后1 d、3 d血清Cor、SOD、MDA水平较术前增高,但不经胸切除组血清Cor、SOD、MDA水平均低于经典组,差异均具有统计学意义(P<0.05),见表4。
2.4 患者免疫功能指标水平比较
术前2组患者CD3+、CD4+、CD4+/CD8+水平比较差异无统计学意义(P>0.05);2组患者术后1 d、3 d CD3+、CD4+、CD4+/CD8+水平较术前降低,但不经胸切除组CD3+、CD4+、CD4+/CD8+水平高于经典组,差异均具有统计学意义(P<0.05),见表5。
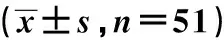
表3 患者血清炎性因子水平比较
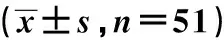
表4 氧化应激反应指标水平比较
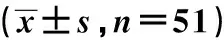
表5 患者免疫功能指标水平比较
2.5 患者肺功能指标比较
术前2组患者MVV、FEV1、FVC比较,差异无统计学意义(P>0.05);2组患者术后1 d、1个月MVV、FEV1、FVC较术前降低,但不经胸切除组患者MVV、FEV1、FVC水平高于经典组,差异均有统计学意义(P<0.05),见表6。
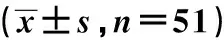
表6 患者肺功能指标水平比较
2.6 术后并发症发生情况
不经胸切除组患者并发症发生率低于经典组,差异具有统计学意义(P<0.05),见表7;所有并发症发生后均及时参照并发症类型及病情程度进行对症处理,包括呼吸支持、抗生素等,经对应处理后所有并发症均缓解。
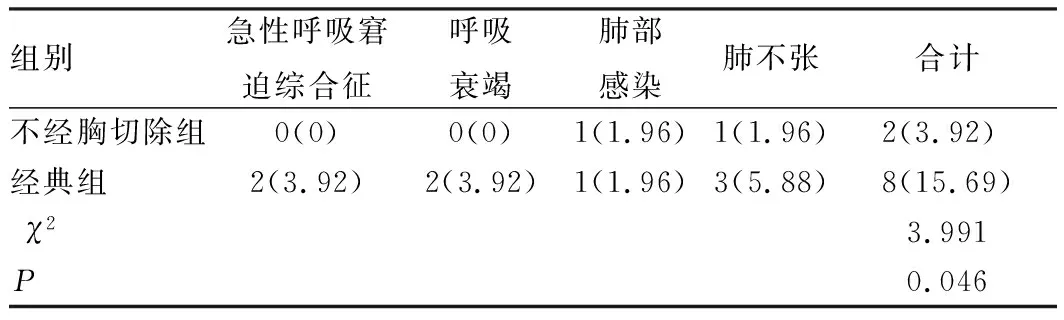
表7 患者并发症发生率比较[n=51,例(%)]
3 讨论
食管癌为消化系统多发恶性肿瘤,当前外科手术仍为其临床治疗的重要方式,传统开放术式虽能取得良好切除效果,但存在创伤较大、术后并发症发生率较高等问题,其中以肺部并发症最为常见,严重影响预后[11-13]。因此,如何对食管癌进行安全有效的治疗仍是目前的研究热点。
随着腔镜技术不断进步,食管癌外科治疗逐渐趋向微创,但全腔镜食管癌根治术治疗期间CO2气腹可造成血流动力学异常,引发高碳酸血症、肺不张等,故不适用于合并COPD的食管癌患者[14-16]。此外,经胸手术操作对心肺造成的干扰较大,且若存在胸腔粘连则会进一步增加手术难度,对于合并COPD的食管癌患者,由于其肺功能较差,极易因无法耐受经胸手术而中断治疗[17]。而本研究采取不经胸食管癌切除术,可增加纵隔操作空间,清晰显露奇静脉、胸导管及气管等上纵隔解剖结构,并能对左喉返神经旁淋巴结进行完整清扫。同时,不经胸食管癌切除术无需开胸,经腔镜辅助对纵隔内食管肿瘤和淋巴结实施操作,可有效避免传统纵隔腔镜手术操作空间及视野范围不足等弊端,且创伤较小[18]。本研究结果表明,不经胸切除组淋巴结清扫数目与经典组比较无显著差异,但其他手术指标优于经典组,MVV、FEV1、FVC高于经典组,表明相较于经典术式,采取不经胸食管癌切除术治疗合并COPD的食管癌可减少手术创伤,且对肺功能损害较小,有利于患者术后肺功能早期康复。分析其原因主要在于:①不经胸切除为了术中更好地显露食管,在颈部作切口前对食管实施游离、标记,有利于镜下牵拉、游离食管,可保证术野清晰,有利于术者精准实施操作,在保证有效切除病灶的同时可最大程度减少创伤;②不经胸切除术可避免对心、肺等重要脏器的挤压,有效减少对呼吸系统造成的影响,且术中无需离断奇静脉,可通过充气扩大纵隔,加之腔镜具有放大作用,从而可清晰辨别淋巴结、喉返神经及其走行等,进而减少术中失血及误伤;③不经胸切除术仅需1个体位便可实施颈部与腹部操作,能有效缩短麻醉时间及手术时间;④不经胸切除术无胸部切口及胸腔引流管,有利于减轻术后疼痛,促使患者术后咳嗽排痰及早期康复[19-20]。
有研究认为,不经胸食管癌切除术虽能减少创伤,但其仍为侵袭性治疗方式,可引发炎性反应、氧化应激反应,表现为血清WBC、CRP、IL-6、Cor、SOD、MDA含量异常波动,进而影响患者免疫功能,造成免疫抑制[21-22]。T淋巴细胞亚群中CD3+、CD4+、CD4+/CD8+具有重要免疫辅助作用,能反映机体免疫调节状态[23]。而本研究中,术后不同时间段不经胸切除组炎性因子及氧化应激反应指标水平均低于经典组,CD3+、CD4+、CD4+/CD8+水平均高于经典组,进一步证实不经胸切除术可减轻侵袭性操作造成的炎性反应及氧化应激反应程度,减少对免疫功能造成的影响,在合并COPD的食管癌患者中应用价值更高,创伤更小。此外,由本研究结果可知,不经胸切除组并发症发生率低于经典组,表明不经胸食管癌切除术安全性较高,分析其原因可能为该术式术野清晰、操作精准、创伤小。同时,为保证不经胸食管癌切除术治疗合并COPD食管癌的有效性及安全性,临床实际中需注意:①术中应选取仰卧位,垫高肩部,头部偏向右侧,下颌高度不宜超出胸骨上凹,头高足低约10°,以便器械操作;②在颈部于胸锁乳突肌内缘作切口,经肌间隙入路实施操作,无需离断颈部肌肉,以防颈部渗血影响术野;③术中需注意保护胸导管、气管、重要脏器,并尽量避免牵拉纵隔胸膜,防止过度牵拉造成纵隔胸膜破损,影响术中循环及呼吸稳定。
综上所述,与经典根治术相比,不经胸食管癌切除术治疗合并COPD的食管癌创伤较小,手术创伤所致炎性应激反应较小,免疫功能及肺功能的损伤程度较低,且并发症发生率较低,安全性较高。

