HSYA对骨关节炎大鼠膝关节软骨损伤的修复作用研究
李燕霞,王 琳,姚弘毅
(华中科技大学同济医学院附属梨园医院康复科,湖北 武汉 430000)
关节是骨与骨连接的部分,软骨可以减少骨摩擦,随着年龄的增加,累积性运动损伤等炎症反应会加重膝关节软骨损伤,导致骨关节炎(osteoarthritis,OA)产生[1]。有研究表明,中老年人群均会出现不同程度的骨关节疾病,其中OA的发生率约为4%,与老龄化程度呈正相关[2]。OA患者关节疼痛及肿胀等与关节周边肌肉控制能力不足、柔韧功能减退等有关。目前,随着医疗技术的不断进步,探讨OA的发病机制及防治方案已经成为学术界研究的热点。
羟基红花黄色素A(hydroxy safflower yellow A,HSYA)是从红花中提取的活性制剂,具备红花的药理活性。以往研究表明,HSYA同时对心肌缺血和缺血脑组织等有保护作用[3]。基质金属蛋白酶(matrix metalloproteinase,MMP)是由钙离子及锌离子组成的大家族,以降解细胞外间质而被熟知,在OA等多种病理生理中发挥作用,其中MMP-3是该家族的重要成员。转化生长因子-β1(transforming growth factor β1,TGF-β1)属于多功能蛋白质,对细胞生物活性及机体免疫具有调节作用[4]。Notch信号广泛存在于成骨细胞和软骨细胞中,间充质干细胞向成骨细胞分化的过程主要受Notch1信号通路的影响,因此,Notch1信号在骨生长中起重要作用。目前,有研究证实HSYA能一定程度上促进OA修复,但其作用机制尚不明确,因此,为了探究HSYA对OA大鼠血清中炎性因子的影响及其作用机制,本研究通过建立OA大鼠模型,以分析HSYA对大鼠膝关节及MMP-3、TGF-β1、Notch1水平的影响。
1 材料与方法
1.1 材料
25只SPF级SD大鼠(中国上海基尔顿生物),MMP-3抗体(USA,Abcam),TGF-β1抗体(中国上海沪峥生物),Notch1抗体(中国上海士峰生物),生化实验电泳蛋白仪(中国上海知信),苏木精—伊红试剂盒(中国上海江莱)。
1.2 HSYA溶液配制
HSYA(中国上海源叶生物科技,批号:Z01010BA13,质量分数≥98%)配制成100 mg/mL,用无血清DMEM/F12 (25 mL)培养液溶解,储存浓度为1.28 mM,0.22 μm滤膜过滤除菌后于4 ℃保存备用。用含10% FBS的DMEM/F12倍比稀释成为所需终浓度的培养液。
1.3 分组及OA大鼠建模
将25只大鼠随机分为正常组、OA组、低HSYA组、中HSYA组和高HSYA组,每组5只。所有大鼠适应性饲养3 d,随后OA组、低HSYA组、中HSYA组和高HSYA组大鼠依据文献[5]建立OA大鼠模型,即在大鼠右侧膝关节注射4%木瓜蛋白酶溶液与0.03 mol/L L-半胱氨酸溶液混合液20 μL,7 d后OA模型建立成功。低HSYA组、中HSYA组和高HSYA组大鼠分别在尾部注射浓度为2.5、5.0、10.0 mg/kg的HSYA,HSYA浓度参考文献[6],OA组和正常组大鼠分别注射100 mg/kg生理盐水,每周1次,共5次。
1.4 ELISA检测血清中IL-1β和TNF-α含量
末次尾部注射后,抽取每组大鼠尾静脉血,4 000 r/min离心,取上清液置入EP管中,低温保存备用。采用ELISA酶法在全自动生化仪器上测定患者IL-1β和TNF-α表达水平。顺序加入HRP标记的CEA,结合成抗体后,多次洗涤,TMB显色,呈现蓝色,在酸的作用下,最终呈现黄色,于450 nm波长下的酶标仪检测OD值,实验过程严格按操作说明书实验步骤进行。
1.5 Pelletier评分评估大鼠膝关节软骨损伤
末次注射及尾部采血结束后,大鼠行颈部脱臼法安乐死,取右侧后肢膝关节标本,观察股骨髁和胫骨平台关节面平整度,采用Pelletier评分评估膝关节关节面软骨损伤,分数越高表示软骨损伤越严重[6]。
1.6 大鼠组织病理形态观察及Mankin评分
取各组大鼠股骨内髁关节面,甲醛固定24 h,经脱钙、常规脱水机切片处理后进行HE染色[7],200倍倒置显微镜下观察病理情况。采用Mankin评分对每组大鼠软骨和滑膜组织进行评估,分数越高表示损伤越严重。
1.7 免疫组化检测MMP-3阳性表达
各组大鼠膝关节组织脱水、包埋后,采用甲醛固定,水化后37.5 ℃静置0.5 h,加入1%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)液,山羊血清封闭。加入1抗(1∶500)、MMP-3抗体,加入二抗0.5 h后,复染,封皮。选择不交叉的10个视野,以淡黄色至棕褐色为阳性,计算阳性率。
1.8 Western blot检测TGF-β1、Notch1的蛋白水平
各组大鼠膝关节组织加入裂解液,于4 ℃离心0.5 h。用PIERCE检测总蛋白浓度。SDS-PAGE电泳并转膜至PVDF膜,随后加入TGF-β1、Notch1和GAPDH抗体,于4 ℃一抗孵育24 h,PBS洗涤后进行辣根过氧化物酶共轭二抗处理1 h,冷却后计算TGF-β1、Notch1蛋白水平,用Nuance分析软件进行数据处理,化学发光试剂显影曝光,拍照保存。
1.9 统计学分析
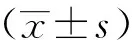
2 结果
2.1 大鼠血清中IL-1β、TNF-α水平比较
OA组血清中IL-1β、TNF-α水平均高于其余各组(P<0.05),高HSYA组IL-1β、TNF-α水平低于低HSYA组及中HSYA组(P<0.05),见表1。
表1 大鼠血清中相关因子水平比较
2.2 大鼠Pelletier评分比较
OA组、低HSYA组、中HSYA组、高HSYA组及正常组大鼠Pelletier评分依次降低,各组间比较差异有统计学意义(F=30.770,P<0.05),见图1。
2.3 大鼠组织病理学观察及Mankin评分比较
病理观察结果显示:正常组软骨结构清晰、完整,组织间隙无水肿及炎症浸润;OA组软骨结构混乱且不完整,组织间隙严重肥大,炎症浸润显著;低HSYA组、中HSYA组、高HSYA组关节软骨排列较整齐,少量炎症浸润,与OA组相比均有一定改善,见图2。OA组软骨和滑膜组织Mankin评分高于其余各组(P<0.05),高HSYA组Mankin评分低于低HSYA组和中HSYA组(P<0.05),见表2。
*:与正常组相比,P<0.05;#:与OA组相比,P<0.05;△:与低HSYA组相比,P<0.05;▲:与中HSYA组相比,P<0.05
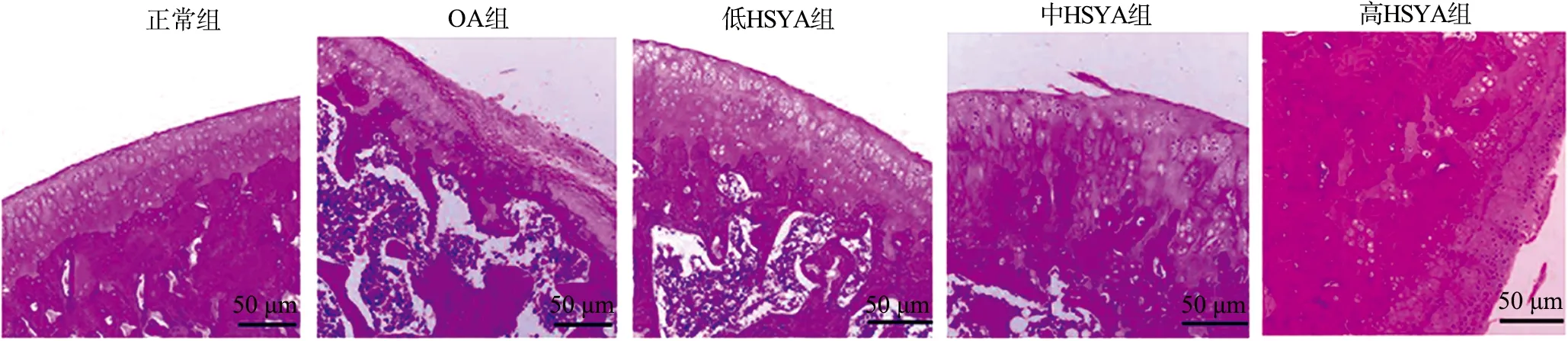
图2 大鼠组织病理学观察
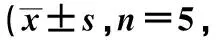
表2 大鼠软骨和滑膜组织Mankin评分比较分)
2.4 大鼠膝关节组织MMP-3阳性细胞率比较
MMP-3在膝关节组织阳性表达呈现棕黄色,OA组MMP-3在细胞浆中阳性表达明显,主要在炎性肉芽肿内的组织细胞及少量的血管内皮细胞中表达(图3)。低HSYA组、中HSYA组、高HSYA组中MMP-3阳性表达逐渐减少,炎症浸润降低。OA组、低HSYA组、中HSYA组、高HSYA组、正常组大鼠关节组织MMP-3阳性细胞率依次降低,各组间比较差异有统计学意义(F=240.200,P<0.05),见图4。
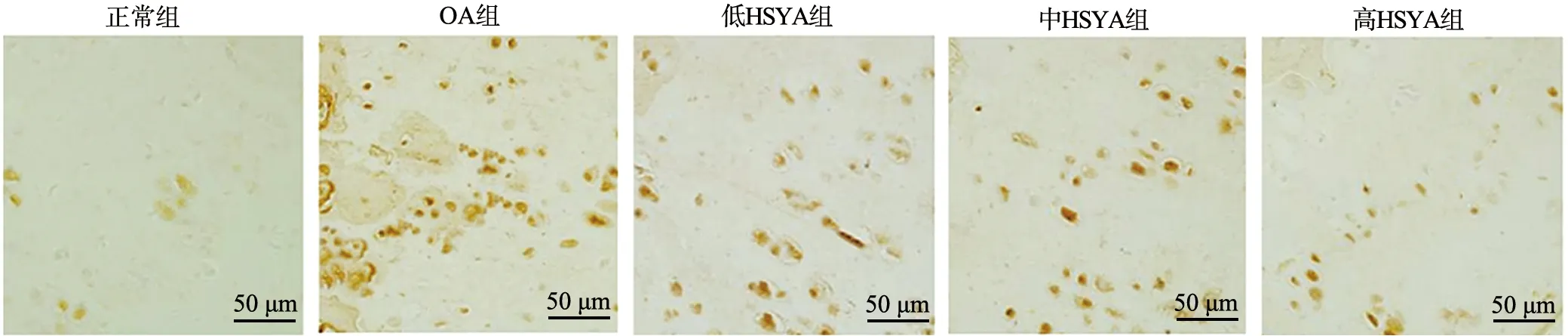
图3 大鼠膝关节组织中MMP-3表达
*:与正常组相比,P<0.05;#:与OA组相比,P<0.05;△:与低HSYA组相比,P<0.05;▲:与中HSYA组相比,P<0.05
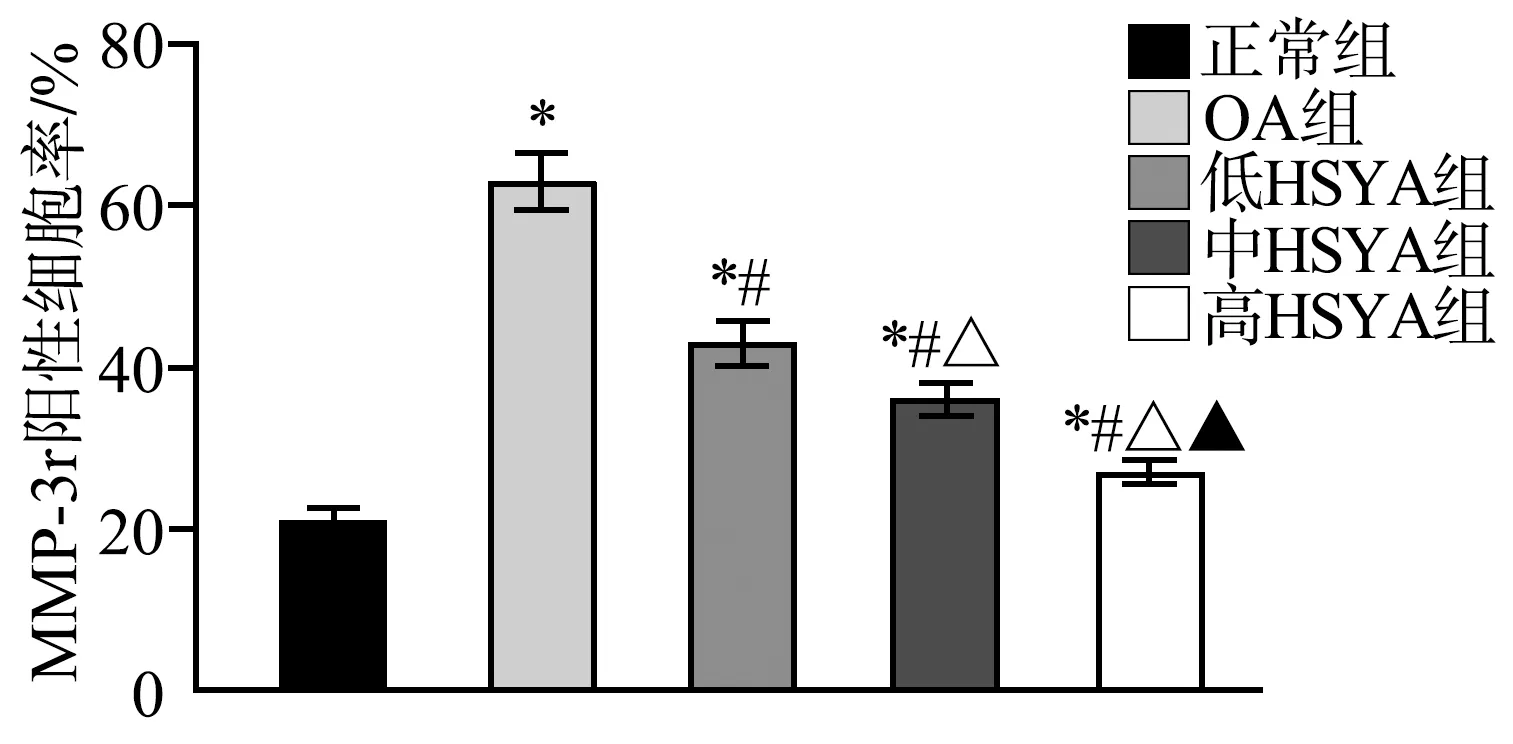
2.5 大鼠TGF-β1、Notch1蛋白水平比较
正常组大鼠膝关节组织TGF-β1蛋白水平高于OA组、低HSYA组、中HSYA组、高HSYA组(P<0.05),低HSYA组、中HSYA组、高HSYA组TGF-β1蛋白水平较OA组高(F=112.400,P<0.05);正常组大鼠膝关节组织Notch1蛋白水平低于OA组、低HSYA组、中HSYA组、高HSYA组(P<0.05),低HSYA组、中HSYA组、高HSYA组Notch1蛋白水平较OA组低(F=68.680,P<0.05),见图5。
*:与正常组比较,P<0.05;#:与OA组比较,P<0.05;Δ:与低HSYA组比较,P<0.05;▲:与中HSYA组相比,P<0.05
3 讨论
研究表明,OA患者骨关节受到损伤时,会导致骨关节液的吸收和释放功能紊乱,软骨组织内营养供给不足,软骨中的有害物质不能及时排除,进而使软骨损伤不断加剧[6]。目前,OA的临床治疗存在多样性,其中中药的生物活性在多种疾病中均发挥重要作用。红花的药理活性广泛,HSYA是从红花中提取的活性物质,具有抗血小板聚集、抗自由基及抗炎等特点。
IL-1β经多种细胞刺激后产生,其表达水平与OA的严重程度呈正相关,IL-1β会导致OA患者关节软骨炎症加重。前列腺素E2属于疼痛因子,其表达升高表示机体疼痛程度增加。TNF-α可促使机体血清中炎症介质白介素-6水平升高,导致软骨分泌的前列腺素E2升高,增加软骨破坏性[8]。HSYA是由多个酚羟基组成的化合物,具有活血、抗炎及止痛作用,能够有效调节炎症NF-κB信号,降低自由基水平,改善炎症浸润[9]。Wang等[10]研究表明,HSYA能够降低OA患者血清中IL-1β、TNF-α水平,有利于减少关节软骨退变。本研究结果显示,HSYA能够降低OA大鼠血清中IL-1β、TNF-α水平,且呈剂量依赖性,说明高剂量HSYA具有较强的抑制IL-1β和TNF-α因子的能力,这与牛凯等[11]的研究结果相似。
本研究对OA大鼠注射不同剂量HSYA后发现,Pelletier评分均降低,且剂量越高评分越低,提示不同剂量的HSYA对OA大鼠关节软骨及组织病理均有改善作用,且呈浓度依赖性。注射HSYA后能加快骨增生,减少软骨层缺损。顾超兰等[12]的研究表明,HSYA能够降低IL-1β水平,从而保护关节软骨组织,减少关节退变发生,本研究结果与之相似。
研究表明,MMP是导致OA发生病理改变的关键,其作用机制是加深OA患者胶原网破坏程度,增加软骨暴露及炎症因子刺激,促进Ⅱ型胶原蛋白降解,从而加重病情[13]。有研究认为,HSYA能够通过提高Ⅱ型胶原蛋白水平,抑制MMP-3表达,平衡软骨细胞代谢,从而减少软骨降解,保护骨组织[14]。本研究结果表明,HSYA能够降低膝关节组织中MMP-3阳性表达,且呈浓度依赖性,与王君等[15]的研究结果相似。
Notch是一种进化上高度保守的信号通路,能够通过调节相邻细胞而影响器官发育。有研究表示,Notch1在OA大鼠关节软骨中水平较高,可影响软骨的发育和生长,导致骨细胞平衡紊乱[16]。TGF-β1是调节细胞生长和分化的β超家族,其信号传导作用需要结合Smad完成。TGF-β1水平升高往往与自身免疫等有关[17]。TGF-β1在正常人群中表达相对稳定,而在OA患者体内表达异常,这与关节损伤后软骨启动自我修复相关[18]。本研究结果显示,HSYA能够降低Notch1表达水平,减少炎症反应,同时,HSYA能通过提高TGF-β1水平从而加快软骨细胞分化,提高软骨修复能力,这与国内外的研究结果相似[19-20],但具体机制还需要进一步研究。
综上所述,OA大鼠尾部注射HSYA能够降低血清炎性因子IL-1β、TNF-α水平,缓解滑膜组织损伤,且呈浓度依赖性,其作用机制与抑制MMP-3、Notch1表达,提高TGF-β1水平相关。

