种植密度对尾巨桉幼苗光合特性和生物量分配的影响
陈沫,何沙娥,陈少雄,欧阳林男,刘学锋,张程,张维耀
种植密度对尾巨桉幼苗光合特性和生物量分配的影响
陈沫,何沙娥,陈少雄,欧阳林男,刘学锋,张程,张维耀
(国家林业和草原局桉树研究开发中心,广东 湛江 524022)
本研究从光合特性及光合产物分配两个方面阐释种植密度促进植株径向生长的作用机制。以3月龄尾巨桉DH32-29无性系为研究对象,比较分析2个种植密度下幼苗的生长性状、叶片光合特性、生物量及其分配模式。结果表明:在低种植密度条件下,尾巨桉的直径、冠幅、冠长、茎生物量、单株总叶面积、叶片净光合速率和五种光合酶活性(Rubisco、RCA、SuSy、AGPase和SBPase)均显著增大,其中直径和茎生物量分别增大26.29%、75.84%,净光合速率、Rubisco、RCA、SuSy、AGPase和SBPase分别增大145.75%、44%、40.70%、24.94%、52.17%和58.06%;而根生物量比(RMR)、根冠比(R/C)分别减小18.0%、21.0%,表明低种植密度条件下植株具有较强的光合能力和向主茎输送光合产物的能力。因此,种植密度可通过影响植株总叶面积和光合酶活性,调节植株的光合能力;同时也可影响光合产物在各器官中的分配模式,在促进主茎径向生长方面尤为突出。这为揭示密度调控林木主茎径向生长的作用机制提供了依据。
种植密度;光合特性;生物量分配;径向生长
密度调控是人工林培育的关键技术之一,合理的林分密度能够显著促进林木生长,尤其是径向生长,提高木材产量,揭示密度调控林木主茎径向生长的机制具有重要意义。光合作用是植株生长发育的基础,光合产物及其分配模式在决定植株器官生长量方面具有关键作用。阐释种植密度对植株光合作用及其产物分配的影响是揭示密度影响林木主茎径向生长机制的重要方面。
植株光合作用受内部因素如比叶面积、叶绿素含量、冠层结构、营养状况、光合酶活性等和外部环境因素如光照、温度、水分、CO浓度等多种因子的影响。人工林培育措施可改变这些内外因素,如密度可影响植株叶面积、叶面积指数、冠型结构、叶片叶绿素含量、光合酶活性等内部因素,也能改变林分内的水、热、光等环境因素,因而对植株光合作用产生影响。
植物的光合产物分配对各器官生物量起决定性作用,其分配模式受生长环境内可获得性资源分配数量的影响,如土壤养分和水分减少植株将会增加对地下器官光合产物的分配比例,养分和水分充沛或光资源受限则减少叶片中的分配。群体内植株个体对可获得性资源的分配比例受种植密度的影响,使各植株发生地上器官对光资源、地下器官对水资源与养分的争夺,因而对植株光合产物分配模式产生影响。如红葱个体随种植密度增加将会扩大对地上器官生物量的分配比例,而减少地下根系的生物量分配比例。
桉树()生长迅速,适应能力强,木材产量高,被世界各地区广泛引种,现已成为全球重要的速生人工林树种之一。国内外已有大量关于桉树人工林密度调控的研究报道,多数研究表明林分密度影响植株生长,尤其对径向生长产生显著影响。在一定范围内,林分种植密度与径向生长呈显著负相关关系,密度越小,植株直径越大,但关于不同种植密度对植株个体光合作用和光合产物分配的影响研究尚少,密度对林木主茎径向生长的调控机制尚未明确。本研究以尾巨桉(×)幼苗为对象展开研究,阐述种植密度对植株个体生长发育、生物量积累与分配、光合酶活性等方面的影响,以期从光合作用及其产物分配两个方面阐释种植密度促进主茎径向生长的作用机制。
1 材料与方法
1.1 试验材料
试验材料为尾巨桉DH32-29无性系组织培育苗,于2019年3月进行扩繁,2019年7月选择长势均一且健壮的幼苗进行栽种。试验材料由湛江开发区博尔顿种苗有限公司提供。
1.2 试验设计
2019年7月,在广东省湛江市南方国家级林木种苗示范基地(21°30´N,111°38´E)将尾巨桉幼苗移栽到高为0.5 m直径为0.3 m种植袋中,并按照10株·m高种植密度(株行距0.3 m × 0.3 m)和5株·m低种植密度(株行距0.6 m × 0.6 m)移放至长×宽×高为5 m × 4.5 m × 0.5 m的样地内,每个处理设置3个重复,共计6个样地。在幼苗生长过程中,各植株的水分和营养充分供应且保持一致。
1.3 试验方法
1.3.1 生长性状测定
苗木种植后,每月进行一次每木检尺,测定植株基部10 cm处地径、株高、冠幅和冠长。根据测定结果,选取其中直径增长量具有显著差异的生长时期开展后续试验。采用游标卡尺测定植株的直径,钢卷尺测定株高、冠幅和冠长。
1.3.2 生物量测定
根据每木检尺结果,种植后第2至第3月期间内,直径生长量具有显著差异。选取3月龄不同处理下的平均木各3株,使用钢卷尺测量冠幅和冠长后,分别采集叶、茎、枝和根,用电子天平(精确度为千分之一)称量鲜质量(Fresh Weight,FW),75℃烘干24 h至恒质量后称其干质量(Dry Weight,DW),获得单株各器官生物量和单株总生物量。根据测定结果,计算叶片含水量(Leaf Water Content,LWC)和生物量分配参数:叶生物量比(Leaf Mass Ratio,LMR,叶干质量/植株总干质量),茎生物量比(Stem Mass Ratio,SMR,茎干质量/植株总干质量),枝生物量比(Branch Mass Ratio,BMR,枝条干质量/植株总干质量),根生物量比(Root Mass Ratio,RMR,根干质量/植株总干质量),根冠比(Root Mass/Crown Mass,R/C,根干质量/地上部分总干质量)。

式中:LWC为叶片含水量;FW为鲜质量;DW为干质量。
1.3.3 光合特性的测定
选取不同密度下的平均木各3株,测定其上部、中部和下部3个不同分枝位置叶片的净光合速率(Pn)、叶面积、叶绿素含量(SPAD)和光合作用关键酶的活性。
1.3.3.1 叶面积
使用LI-3000C叶面积仪测定。选取上部、中部和下部3个不同位置处分枝各1条,分别测定各分枝总叶面积和总叶片数,计算分枝的平均叶面积(分枝总叶面积/分枝叶片总数),以分枝的平均叶面积作为对应;分别计数3个不同位置处的叶片数量,与对应分枝位置的平均叶面积相乘,获得各分枝位置的总叶面积,3个位置的总叶面积之和为单株的总叶面积。
1.3.3.2 叶绿素含量
使用SPAD-502叶绿素仪测定上部、中部和下部3个不同位置叶片的叶绿素含量。每个位置测定5个叶片,每个叶片测定6次,取其算术平均数作为植株叶片的叶绿素含量。
1.3.3.3 净光合速率
选择晴朗无风的天气,于上午9:30—11:30,使用LI-6400光合仪测定上部、中部和下部3个不同分枝位置处叶片的净光合速率。根据所测不同分枝位置实际光照强度,测定时上、中、下部光照强度分别设定为1 300、750、250 μmol·m·s。每个分枝从上往下选取第3和第4叶位进行测定,每个部位测定3张叶片,取算术平均数,与该植株总叶面积的乘积作为其净光合速率的测定值。
1.3.3.4 光合作用关键酶活性
净光合速率和叶绿素含量测定结束后剪下叶片,迅速放入液氮内,带回试验室置于−80℃超低温冰箱保存备用。本研究测定5种光合关键酶的活性:(1)核酮糖-1,5-二磷酸羧化酶(Ribulose-1,5-bisphosphate carboxylase/oxygenase,Rubisco);(2)Rubisco活化酶(Rubisco activase,RCA);(3)蔗糖合酶(SurcoseSynthese,SuSy);(4)腺苷二磷酸葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,AGPase);(5)景天庚酮糖-1,7-二磷酸酯酶(Sedoheptulose-1,7-bisphosphatase,SBPase)。
粗酶的提取:将叶片剪碎,称取0.5 g于研钵中加液氮研磨至粉末状,并迅速转移到10 ml的离心管中,加入4.5 ml的0.01 mol·LPBS(pH=7.4)缓冲液,于旋涡震动器上震动2 min后充分混匀,4℃ 12 000 × g 冷冻离心15 min。上清液做酶活测定用。以上操作均在4℃下进行。
光合关键酶活性的测定:采用ELISA试剂盒法测定(上海纪宁实业有限公司)。粗酶提取完成后,经ELISA试剂反应后,使用酶标仪在450 nm波长处测定吸光度,每个样品设置3个重复。根据试剂盒的操作步骤,得出样品的浓度。
1.4 数据分析
使用SPSS 20.0软件进行独立样本t检验分析数据,使用EXCEL 2016软件绘图,以<0.05表示差异显著。
2 结果与分析
2.1 幼苗种植密度对尾巨桉生长性状的影响
树木的树高、直径、冠幅和冠长可以反映植株的生长情况。尾巨桉各生长性状对种植密度的响应如图1所示。在试验期内,低种植密度植株的树高和直径均高于高种植密度的,且处理间差异随生长时间的增加而逐渐增大,其中平均树高在2、4月龄时达到显著性水平;平均直径在2、3、4月龄时均呈现出显著差异,其中,3月龄时低种植密度平均直径6.84 mm,较高种植密度的5.41 mm增加了26.29%(图1-A,B)。月生长量分析结果显示:树高生长量差异在4月龄时达到显著水平,直径生长量在3月龄和4月龄时表现出显著差异(图1-C,D),3月龄时低种植密度条件下直径月生长量2.36 mm,比高种植密度的1.41 mm增加了67.77%。选择3月龄的尾巨桉幼苗测定冠幅和冠长,结果显示:低种植密度植株的冠幅和冠长较高种植密度的增大56.18%和28.19%,差异达到显著水平(图1-E)。这说明尾巨桉幼苗各生长性状受种植密度的调控,种植密度较小时更有利于植株的生长发育;相对于树高,直径对种植密度的响应更加明显。
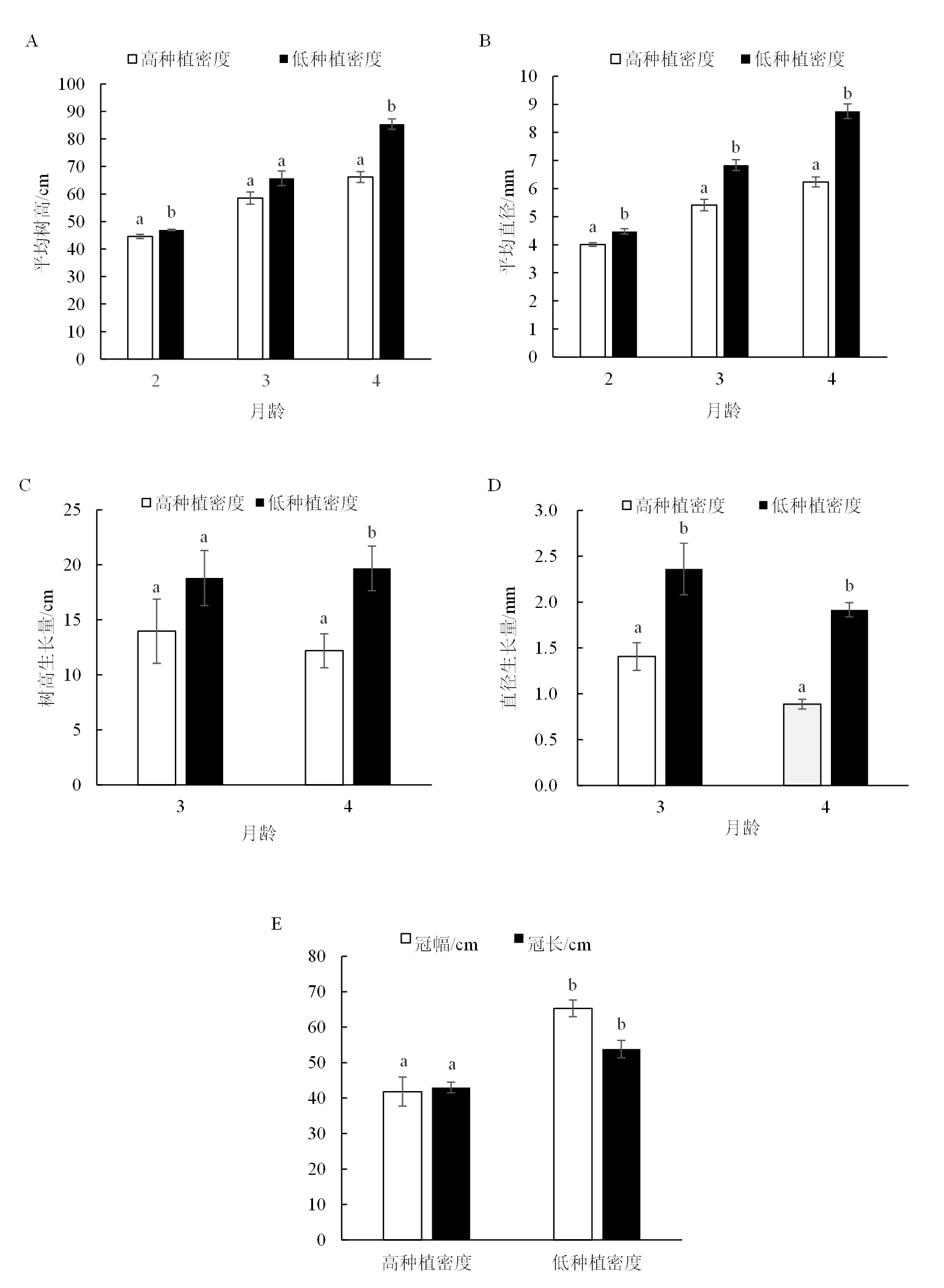
图1 种植密度对尾巨桉生长性状的影响
注:柱形图中不同小写字母表示<0.05。
2.2 幼苗种植密度对尾巨桉生物量积累及分配的影响
生物量的大小可以用来衡量植物的光合生产能力。由图2可知,各器官和全株的生物量积累均表现出随种植密度减小而增大的趋势,说明较小的种植密度有利于个体生物量积累。2种种植密度间的叶、枝、根和全株的生物量积累差异不显著,而主茎的生物量积累差异显著,表现为低种植密度比高种植密度大75.84%,说明与其他器官相比,种植密度对主茎生物量积累产生的影响较大。

图2 种植密度对尾巨桉各器官生物量积累的影响
生物量分配模式决定了植株各部位的生长量。由图3可知,2种种植密度条件下植株生物量分配参数差异不显著,但具有一定的趋势,其中各器官生物量比均为:叶生物量比(LMR)>茎生物量比(SMR)>根生物量比(RMR)>枝生物量比(BMR)。相比高种植密度,低密度的单株叶、茎和枝生物量比均增大,而根生物量比和根冠比(R/C)减小,分别减小18%和21%。这说明在较小的种植密度条件下,尾巨桉更倾向于选择向地上器官分配生物量,而降低地下部分器官的生物量分配比例。
2.3 幼苗种植密度对尾巨桉光合参数的影响
2个种植密度下尾巨桉叶片光合参数的测定结果显示(表1):低种植密度单株总叶面积(1 654.69 cm)显著大于高种植密度的(820.66 cm),约为高密度的2倍;植株的净光合速率,低种植密度为3.07 μmol·s,显著大于高密度的1.25 μmol·s,增大了145.7%;同时,对光合关键酶活性的测定结果显示:种植密度对5种光合关键酶Rubisco、RCA、SuSy、AGPase和SBPase的活性具有显著影响,均表现出低种植密度条件下较大,分别比高种植密度大44%、40.70%、24.94%、52.17%和58.06%,这说明低种植密度对植株的光合作用和光合酶活性有显著促进作用。另外,叶绿素含量差异不显著且参数数值大小基本一致,叶片含水量也呈现相似的规律,说明在本试验条件下,种植密度主要影响植株叶片的形态发育、数量和植株光合能力。
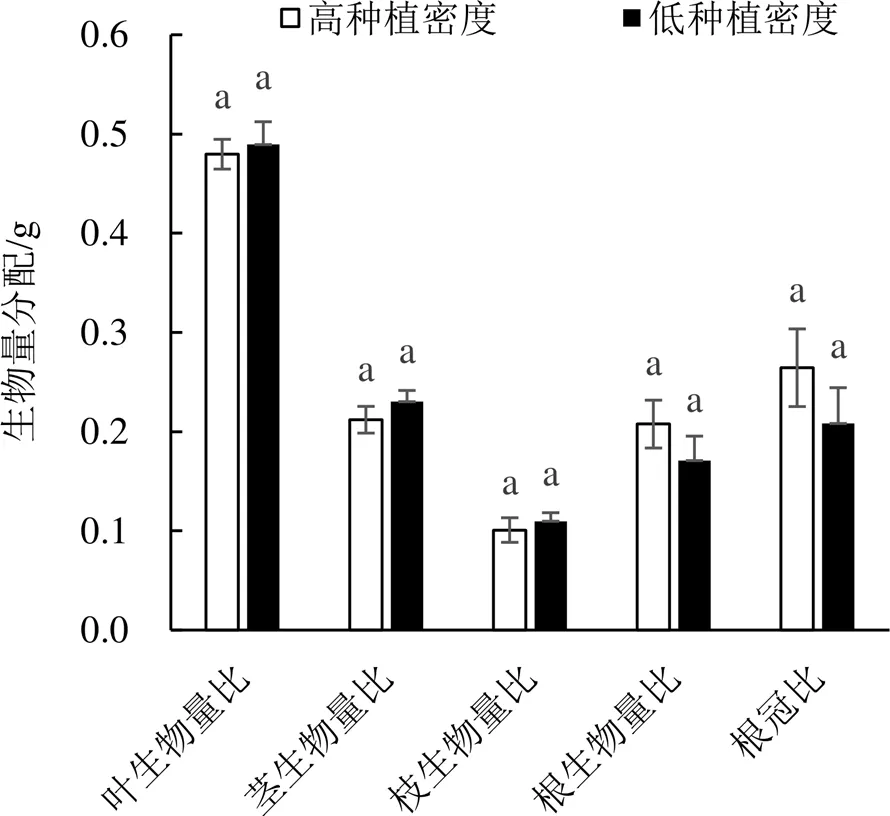
图3 种植密度对尾巨桉生物量分配比例的影响
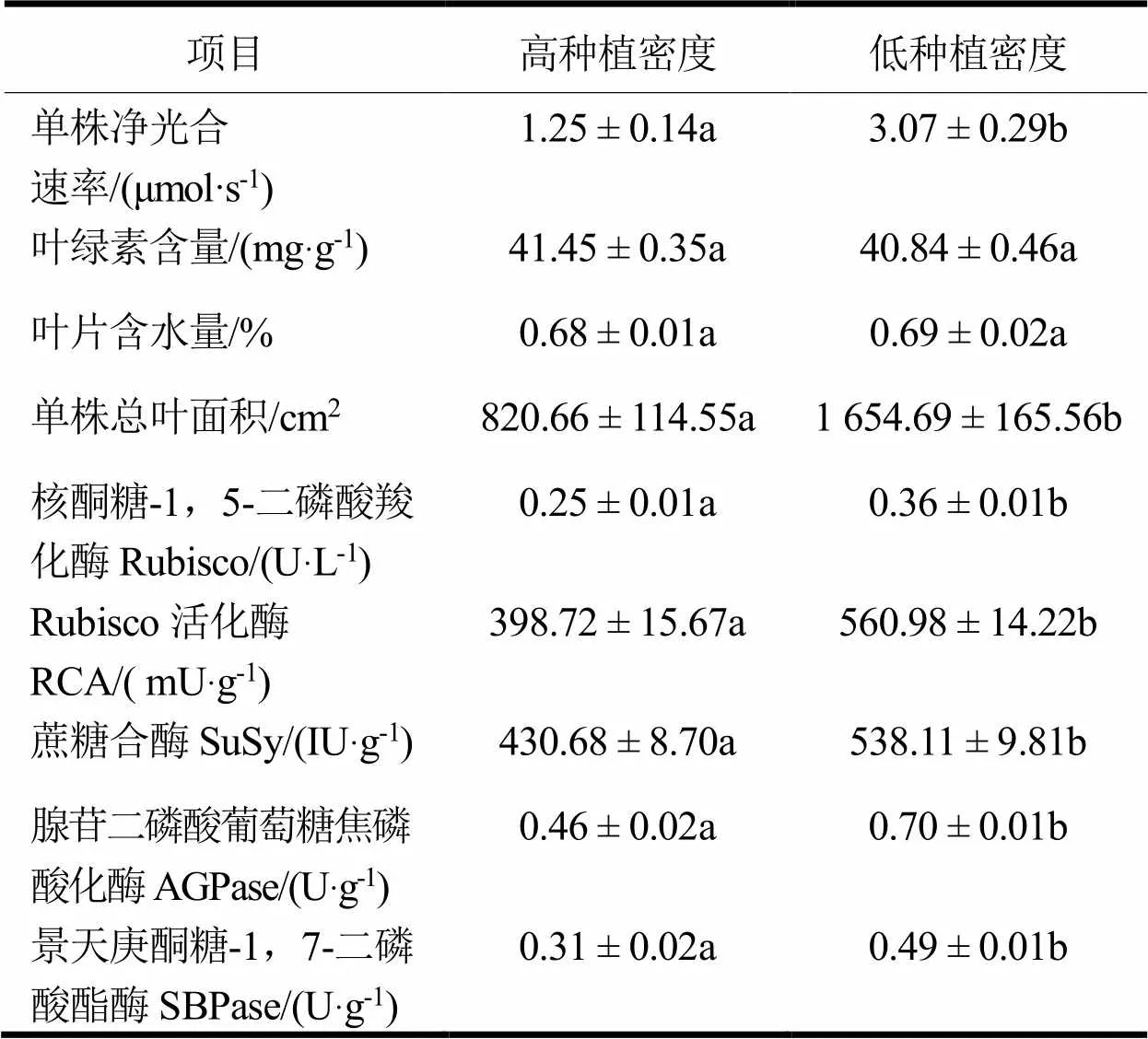
表1 不同种植密度对尾巨桉光合特性的影响
注:同行数据后不同小写字母表示<0.05。
3 讨论与结论
本研究中种植密度对尾巨桉幼苗生长产生影响,在较低的种植密度条件下植株各项生长指标均增大,但种植密度对各生长性状的影响程度不尽相同,表现为3月龄时植株的树高及其生长量差异不显著,而直径、冠幅和冠长差异显著,说明与树高相比,直径更易受到种植密度的影响,这与已有的报道保持一致。就生物量而言,种植密度越大,各器官生物量越小,这与宿爱芝等对辣木()的研究结果保持一致;本试验中不同密度条件主茎的生物量存在显著差异,说明主茎生长更易受到种植密度的影响。这些结果进一步证实了种植密度主要调控主茎径向生长的结论。
光合产物是植株生物量积累和生长的基础,而光合产物的分配即生物量的分配是植株不同器官生长的前提。因此,本研究从光合作用及其产物分配两个方面阐述种植密度对主茎径向生长的调控机制。植物主要在叶片内进行光合作用,叶面积是影响植株光合产物积累的一个重要因素。曾祥艳等的研究表明种植密度对1年生多穗柯()叶面积的影响不显著,其认为可能是幼龄多穗柯树体结构或其所处地的光照条件还不足以对叶面积产生较大影响。而本研究中单株叶片总面积在不同密度之间存在显著差异,表现为低种植密度植株的总叶面积显著大于高种植密度,这可能是由于尾巨桉分枝多且各分枝偏好横向生长,在种植3个月后,高种植密度植株邻体间枝条交互重叠,抑制了枝条的横向伸长,从而使植株总叶面积减小;低种植密度条件下,植株具有更为开放的生长空间,有利于植株枝条和叶片横向生长,因此具有相对较大的总叶面积。
光合酶活性是影响植株光合产物积累的最直接的因素。Rubisco是光合作用的关键酶,在高等植物中起催化固定二氧化碳的作用,其活性水平与植物的净光合速率趋势相同,但Rubisco需经RCA活化后才可发挥催化作用。RCA可促进和稳定Rubisco催化活性,在高等植物光合作用中发挥重要作用。SBPase是卡尔文(Calvin)循环中的关键酶,主要负责二氧化碳分子受体1,5-二磷酸核酮糖(ribulose-1,5-bisphosphate,RuBP)的再生,其活性轻微受抑制即可导致光合活性的减弱。SuSy是蔗糖转化为淀粉过程中的第一个限速酶,在光合作用反馈调节中发挥关键作用,其活性可影响植物叶片中光合产物的分配方式。AGPase是淀粉合成起始步骤中的关键酶,在淀粉合成过程中发挥了重要作用。已有研究表明,抑制AGPase的活性会造成淀粉合成途径部分或全部停止。光合酶活性可显著影响光合作用效率,在适宜温度下,光合酶活性越高,植物的光合作用越强。而光合作用的强弱可通过植株的净光合速率来反映。本试验中,低种植密度条件下植株叶片的5种光合酶活性和植株的净光合速率均显著高于高种植密度,这与前人的研究结论保持一致。表明低种植密度条件下,植株叶片中相对较高的光合酶活性可使其具有更大的净光合速率,即在此条件下植物拥有较强的光合能力,更有利于植物积累光合产物,从而促进植株生长。
生物量的分配模式决定了植株各器官的生长量。黎磊等和宿爱芝等认为低种植密度条件下植物将会扩大对地下器官生物量的分配比例。本研究中,在种植密度较低时植物更倾向于减少地下器官生物量的分配比例,而扩大地上器官生物量分配。造成这种现象的原因可能是本试验中尾巨桉幼苗独立栽植于种植袋中且水分和营养物质的供应保持一致,解除了个体间对地下水、矿质营养的竞争。说明在水肥管理适宜的条件下,种植密度通过影响光合产物在各器官中的分配使主茎获得更多的生物量,促进主茎径向生长。
本研究不同种植密度条件下尾巨桉叶片中的叶绿素含量差异不显著,这也许是因为本试验所用材料为幼苗,植株正处于旺盛生长阶段,叶片幼嫩且大多为功能叶片,该指标对林分密度的响应尚不足以表现出差异。另外,生物量分配参数在不同种植密度间的差异性尚未达到显著水平,这可能是在本研究中,植株的水分、营养供应保持一致,减弱了植物各器官对地下水、矿质营养的竞争。因此,本试验所获得的结果是否适应于较大林龄林分还有待进一步验证。
综上所述,在幼苗阶段种植密度主要通过以下两个方面调控尾巨桉主茎径向生长:一是通过调节植株功能叶叶面积及其光合酶活性,影响植株的光合能力及总光合产物生产量;二是通过调整植株个体光合产物的分配模式进而影响各器官生物量的积累,使植株在较低密度条件下采取一种偏好向地上器官分配生物量的生存方式而向茎中输送更多的光合产物,最终促进主茎径向生长。
[1] 董星光,曹玉芬,田路明,等.中国野生山梨叶片形态及光合特性[J].应用生态学报,2015,26(5):1327-1334.
[2] 刘雪丽,陈月,吴瑞宁,等.人工群落光环境对海州常山生长与观赏品质的影响[J].中国农学通报,2016,32(28): 90-96.
[3] 杨清云,晏姝,徐燕,等.3种幼林叶片的叶绿素和养分特征[J].华南农业大学学报, 2008,29(1): 53-56.
[4] 曹永慧,周本智,王小明,等.冠层高度对毛竹叶片光合生理特性的影响[J].西北植物学报,2016,36(11): 2256-2266.
[5] 陈翠莲,张继强,赵通,等.追施氮肥对‘李广杏’树体营养及光合特性的影响[J].经济林研究,2019,37(2):13-22.
[6] 廖玲,曹淑燕,荣毅,等.不同砧木对黄果柑光合特性、光合作用关键酶及其基因表达的影响[J].浙江农业学报, 2016,28(5):769-775.
[7] 翁晓燕,陆庆,蒋德安.水稻Rubisco活化酶在调节Rubisco活性和光合日变化中的作用[J].中国水稻科学, 2001,15(1):35-40.
[8] 齐欣,曹坤芳,冯玉龙.热带雨林蒲桃属3个树种的幼苗光合作用对生长光强的适应[J].植物生态学报,2004, 28(l):31-38.
[9] 王博轶,冯玉龙.生长环境光强对两种热带雨林树种幼苗光合作用的影响[J].生态学报, 2005,25(1): 23-30.
[10] 袁嫚嫚,朱建国,刘钢,等.不同天气水稻光合日变化对大气CO浓度和温度升高的响应—FACE研究[J].生态学报,2018,38(6): 1897-1907.
[11] 郑鹏丽,黄晓蓉,费永俊,等.水分胁迫对桢楠幼树光合生理特性的影响[J].中南林业科技大学学报,2019,39(10): 64-70.
[12] 郎莹,张光灿,张征坤,等.不同土壤水分下山杏光合作用光响应过程及其模拟[J].生态学报,2011,31(16): 4499-4508.
[13] ALCORN P J, PYTTEL P, BAUHUS J, et al. Effects of initial planting density on branch development in 4-year-old plantation grownandtrees[J].Forest Ecology and Management,2007,252(1/3): 41-51.
[14] KEARNEY D, JAMES R, MONTAGU K, et al. The effect of initial planting density on branching characteristics ofand[J]. Australian Forestry, 2007,70(4):262-268.
[15] 公宁宁,马履一,贾黎明,等.不同密度和立地条件对北京山区油松人工林树冠的影响[J].东北林业大学学报, 2010,38(5): 9-12.
[16] 李勇,韩海荣,康峰峰,等.抚育间伐对油松人工林光合作用的影响[J].东北林业大学学报,2014, 42(2): 1-6.
[17] 邱霞.栽植密度对黄果柑光合特性的影响及其光响应机制研究[D].成都:四川农业大学, 2017.
[18] Glynn C, Herms D A, Egawa M, et al. Effects of nutrient availability on biomass allocation as well as constitutive and rapid induced herbivore resistance in poplar[J]. Oikos, 2003, 101: 385-397.
[19] PETTERI V, ANNIKKI M. Carbon budget for Scots pine trees: effects of size, competition and site fertility on growth allocation and production[J].Tree Physiology, 2005,25:17-30.
[20] 贺海波,李彦.干旱、盐胁迫条件下两种盐生植物生物量分配对策的研究[J].干旱区研究,2008,25(2): 242-247.
[21] 谭淑娟,李婷,余素睿,等.光照强度对8种红树植物幼苗生长和生物量分配的影响[J].生态科学,2020,39(3): 139-146.
[22] 黎磊,周道玮,盛连喜.密度制约决定的植物生物量分配格局[J].生态学杂志,2011,30(8): 1579-1589.
[23] 祁述雄.中国桉树[M].第2版.北京:中国林业出版社,2002: 21-35.
[24] 陈少雄.桉树中大径材培育理论及关键技术研究[D].长沙:中南林业科技大学, 2010.
[25] 楚秀丽,王艺,金国庆,等.不同生境、初植密度及林龄木荷人工林生长、材性变异及林分分化[J].林业科学,2014, 50(6): 152-159.
[26] Harrington T B, Harrington, C A, DeBell D S. Effects of planting spacing and site quality on 25-year growth and mortality relationships of Douglas-fir (var.)[J]. Forest Ecology and Management, 2009, 258: 18-25.
[27] 李洁,列志旸,许松葵,等.不同密度的银合欢林生长分析[J].中南林业科技大学学报,2016, 36(6): 70-74.
[28] 宿爱芝,郑益兴,吴疆翀,等.不同栽培密度对辣木人工林分枝格局及生物量的影响[J].生态学杂志,2012,31(5): 1057-1063.
[29] 曾祥艳,陈金艳,廖健明,等.不同栽培密度对多穗柯幼林生长的影响[J].经济林研究,2014, 32(1): 113-116.
[30] 李卫芳,王秀海,王忠.小麦旗叶Rubisco和Rubisco活化酶与光合作用日变化的关系[J].安徽农业大学学报,2006,33(1):30-34.
[31] Portis A R. The regulation of Rubisco by Rubisco activase[J].Journal of Experimental Botany,1995,46: 1285-1292.
[32] 冀宪领,盖英萍,马建平,等.桑树景天庚酮糖-1,7-二磷酸酶基因的克隆、原核表达与植物表达载体的构建[J].林业科学,2008,44(3):62-69.
[33] BROWN J N, PALMER G B, STANLEY S, et al. Cacid decarboxylases required for Cphotosynthesisare active in the mid-vein of the C3 species, and are important in sugar and amino acid metabolism[J]. The Plant Journal, 2010, 61: 122-133.
[34] 黄斌全.玉米淀粉合成关键酶:AGPase和isoamylase的功能研究[D].成都:四川农业大学,2012.
[35] MÜller-RÖber B, Sonnewald U, Willmitzer L. Inhibition of the ADP-glucose pyrophosphorylase in transgenic potatoes leads to sugar-storing tubers and influences tuber formation and expression of tuber storage protein genes[J]. EMBO Journal,1992,11(4): 1229-1238.
[36] Sweetlove L J, MÜller-RÖber B,Willmitzer L, et al. The contribution of adenosine 5’-diphosphoglucose pyrophosphorylase to the control of starchsynthesis in potato tubers[J]. Planta,1999,209(3): 330-337.
[37] 李洪岐,蔺海明,梁书荣,等.密度和种植方式对夏玉米酶活性和产量的影响[J].生态学报,2012,32(20): 6584-6590.
[38] 覃鸿妮,蔡一林,孙海燕,等.种植密度对不同株型玉米蔗糖代谢和淀粉合成相关酶活性的影响[J].中国生态农业学报, 2010, 18(6): 1183-1188.
Effects of Planting Density on Photosynthetic Characteristics and Biomass Allocation of×Seedlings
CHEN Mo, HE Shae, CHEN Shaoxiong, OUYANG Linnan, LIU Xuefeng, ZHANG Cheng, ZHANG Weiyao
()
To elucidate how planting density influences stem radial growth, aspects of photosynthetic characteristics and biomass allocation, we compared the growth characteristics, leaf photosynthetic characteristics, biomass and biomass allocation model of×clone DH32-29 at age 3-month under a high planting density and a low planting density. The plants grown at the low planting density showed markedly higher stem diameter, tree crown size and stem biomass. The low planting density also led to higher total leaf area per plant with increased net leaf photosynthetic rate (Pn) and also increased activities of five key photosynthesis enzymes (Rubisco, RAC, SBPase, SuSy and AGPase). Among the traits examined, stem diameter, stem biomass, net leaf photosynthetic rate and the photosynthesis enzyme activities of Rubisco, RCA, SuSy, AGPase and SBPase increased by 26.29%, 75.84%, 145.75%, 44.0%, 40.70%, 24.94%, 52.2% and 58.06% respectively, whilst under the high planting density the root mass ratio (RMR) and root to crown ratio (R/C) increased by 18.0% and 21.0% respectively. These results indicated that plants grown under low planting densities acquire stronger photosynthetic capacities and better abilities to transport photosynthetic products to their stems. Accordingly, we suggest that planting density regulates the photosynthetic capacity of the plant by affecting the total leaf area and activities of key photosynthesis enzymes, while increasing stem biomass by affecting the biomass allocation in organs which contribute to radial stem growth. These results provided insights to mechanisms of stem radial growth under varying planation densities.
planting density; photosynthetic characteristics; biomass allocation; radial growth
S725.6
A
10.13987/j.cnki.askj.2021.01.001
广东省林业科技创新项目(2019KJCX005)、国家重点研发计划课题(2016YFD0600502)、湛江桉树培育国家长期科研基地运行补助(2020132509)
陈沫(1994— ),女,森林培育专业在读硕士研究生,E-mail:954584495@qq.com
何沙娥(1983— ),女,博士,助理研究员,主要从事人工林定向培育技术研究,E-mail:cerchese@caf.ac.cn

