下调SLC6A3对肾透明细胞癌细胞SNU-349增殖、迁移的影响
王 佳,艾中中,周 菁
1.空军军医大学西京医院泌尿外科,陕西 西安 710000;
2.西安医学院第二附属医院口腔科,陕西 西安 710000;
3.陕西省肿瘤医院肿瘤内科,陕西 西安 710061
肾细胞癌作为常见的恶性肿瘤,发病率呈逐年上升趋势,其中80%的组织学亚型为肾透明细胞癌[1]。虽然肾透明细胞癌可以通过手术治疗进行切除,但约有30%的患者在确诊初期已发生转移,即便手术切除,后期也有将近40%的患者会出现转移[2]。因此,探究肾透明细胞癌的发生、发展机制具有重要意义。
溶质载体家族6成员3(solute carrier family 6 member 3,SLC6A3),也被称为DAT1,是一种多巴胺转运蛋白,在多项研究[3-4]中已被证实在肾透明细胞癌患者中表达上调,可以作为生物标志物用于诊断肾透明细胞癌,但SLC6A3对肾透明细胞癌具体的调控机制尚不清楚。本研究探讨SLC6A3对肾透明细胞癌细胞增殖、迁移的影响,并对可能涉及到的分子机制进行分析。
1 材料和方法
1.1 材料
人肾皮质上皮细胞HK-2及肾透明细胞癌细胞SNU-349购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。DMEM培养基及胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司。RNA提取试剂盒及实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自天根生化科技(北京)有限公司。二喹啉甲酸(bicinchoninic acid,BCA)蛋白测定试剂盒及细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司。SLC6A3、磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)及磷酸化抗体购自美国Cell Signaling Technology公司;shSLC6A3(5’-CACCGGGCAAGAAGATCGACTTTCTTTC AAGAGAAGAAAGTCGATCTTCTTGCCC-3’)和shNC(5’-CACCGCTTCACGGTCATCCTCAT CTCGAAAGATGAGGATGACCGTGAAGC-3’)质粒购自苏州吉玛基因股份有限公司;AnnexinⅤ-FITC/PI试剂盒购自北京欣博盛生物科技有限公司;Transwell小室购自美国Corning公司。
1.2 组织样本收集
收集2017年1月—2018年1月在陕西省肿瘤医院收治确诊的肾透明细胞癌患者56例,取其手术切除的肾透明细胞癌标本及相应的癌旁组织,置于-80 ℃保存待用。本实验经陕西省肿瘤医院伦理委员会审批通过。
1.3 免疫组织化学法检测SLC6A3蛋白水平
采用10%甲醛溶液固定样本组织,石蜡包埋、切片。然后二甲苯脱蜡、枸缘酸钠修复液修复抗原。冷却后用磷酸盐缓冲液(phosphatebuffered saline,PBS)洗涤,3%过氧化氢室温封闭30 min。SLC6A3抗体4 ℃温育过夜。PBS冲洗后,二抗37 ℃温育1 h。二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染,结果由两名经验丰富的医师进行判断[5],根据细胞染色强度及染色阳性率进行打分。细胞染色强度评分:棕褐色(3分),棕黄色(2分),淡黄色(1分),无色(0分)。染色阳性率评分:无阳性细胞(0分),阳性细胞率≤1 0%(1 分),1 0%<阳性细胞率≤5 0%(2分),50%<阳性细胞率≤75%(3分),阳性细胞率>75%(4分)。按细胞染色强度和染色阳性率综合判断,两者之积≤平均值为低表达组,>平均值为高表达组。
1.4 细胞培养及转染
HK-2、SNU-349细胞分别接种于含10%FBS的DMEM培养基中,在37 ℃、CO2体积分数为5%的条件下培养。将细胞随机分为2组,分别为shNC组和shSLC6A3组,培养24 h后,采用LipofectamineTM3000将构建的shNC和shSLC6A3质粒转染至SNU-349细胞中。转染48 h后,收集细胞进行后续相关实验。
1.5 RTFQ-PCR检测SLC6A3的mRNA表达
采用RNAprep Pure动物组织总RNA提取试剂盒提取肾透明细胞癌组织中的总RNA;采用RNAprep Pure培养细胞总RNA提取试剂盒提取细胞中的总RNA。采用分光光度计分析评估RNA的浓度和纯度。按照说明书,采用FastKing一步法RTFQ-PCR检测SLC6A3 mRNA水平,以GAPDH作为内参。SLC6A3上游引物:5’-CACTCCCGGATGCACTCAAC-3’;下游引物:5’-GATTCCAATCTACGGACGAGC-3’。GAPDH上游引物:5’-CTGACTTCAACAGC GACACC-3’;下游引物:5’-TGCTGTAGCC AAATTCGTTG-3’。采用2-△△Ct计算SLC6A3mRNA的相对表达量,其中△Ct=C tSLC6A3-CtGAPDH。每组设置3个复孔。
1.6 蛋白质印迹法(Western blot)检测SLC6A3、PI3K、Akt蛋白水平
采用RIPA裂解液冰上裂解细胞。12 000 r/min离心20 min收集上清液,获得细胞总蛋白。取50 μg蛋白上样于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)垂直电泳用于分离,运行完毕后采用湿转法将蛋白转移至PVDF膜上。室温封闭1 h,SLC6A3和GAPDH抗体4 ℃温育过夜,PBST洗涤,二抗室温下温育1 h。曝光、显影。使用Image J进行定量分析,其中以GAPDH作为内参计算目的蛋白的相对表达水平。
1.7 CCK-8法检测细胞增殖能力
取适量处于对数生长期的细胞接种于96孔板上,每组设置3个复孔。第2天向每孔加入10 μL的CCK-8试剂,37 ℃避光温育2 h。然后采用酶标仪测定450 nm处的吸光度(D)值。选取的时间点为0、12、24、48 h。
1.8 流式细胞术检测细胞凋亡及细胞周期分布
收集适量处于对数生长期的细胞消化离心收集细胞沉淀,制备细胞悬浮液。细胞凋亡:将细胞与Annexin Ⅴ结合液混合均匀,加入碘化丙啶(propidium iodide,PI)染色液,室温避光温育15 min后,采用流式细胞术检测细胞凋亡。细胞周期:70%乙醇溶液固定细胞30 min,PBS洗涤,收集细胞,加入PI染色液,室温避光温育20 min,PBS洗涤后在流式细胞仪488 nm波长下进行测定。
1.9 Transwell检测细胞迁移能力
收集适量处于对数生长期的细胞,无血清培养基重悬细胞计数,将100 μL 2×104个细胞置于transwell小室上层,下层为500 μL含5%FBS的DMEM培养基。37 ℃温育24 h后,用棉棒刮下膜表面细胞,用0.1%的结晶紫染色液染色20 min。显微镜下观察细胞迁移数目。
1.10 统计学处理
采用Graphpad Prism7.0分析数据。计数资料用%表示,比较采用χ2检验;计量资料用x±s表示,两两比较采用独立t或Mann-WhitneyU非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 SLC6A3在肾透明细胞癌及细胞中高表达
采用免疫组织化学法分析SLC6A3在肾透明细胞癌及相应癌旁组织中的表达,结果显示,肾透明细胞癌癌组织中SLC6A3的阳性率(67.86%,38/56)显著高于癌旁组织(1 2.5 0%,7/5 6),差异有统计学意义(χ2=35.7,P<0.05,图1A);其中肾透明细胞癌癌组织中SLC6A3呈高表达的占25%(14/56)。随后检测SLC6A3在人肾皮质上皮细胞HK-2及肾透明细胞癌细胞SNU-349中的表达,RTFQ-PCR结果显示,与HK-2比较,SNU-349细胞中SLC6A3表达显著上调(1.02±0.04vs4.90±0.17,P<0.05,图1B);与此同时,Western blot结果显示,SNU-349细胞内SLC6A3表达显著上调(0.27±0.03vs1.20±0.06,P<0.05,图1C)。上述结果表明,SLC6A3在肾透明细胞癌组织及细胞中呈高表达。
2.2 下调SLC6A3抑制SNU-349细胞的生长
分别将shNC和shSLC6A3质粒转染至SNU-349细胞中,采用RTFQ-PCR和Western blot进行分析,结果显示,与shNC组比较,shSLC6A3组SLC6A3 mRNA表达(1.00±0.05vs0.37±0.09,P<0.05,图2A)和蛋白水平(0.83±0.04vs0.12±0.02,P<0.05,图2B)均显著降低,表明shSLC6A3转染细胞株构建成功。然后采用CCK-8法检测SLC6A3对细胞增殖的影响,结果显示,下调SLC6A3后细胞增殖能力显著降低(48 h:1.50±0.05vs0.94±0.04,P<0.05,图2C)。
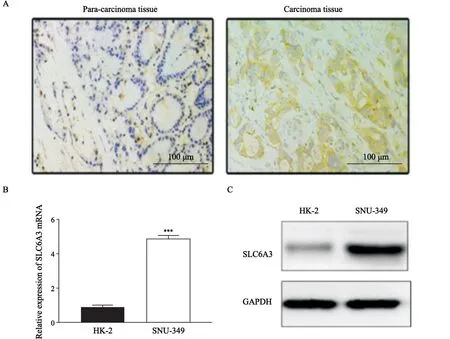
图1 SLC6A3在肾透明细胞癌及细胞中的表达情况Fig.1 SLC6A3 expression in renal clear cell carcinoma and its cells

图2 下调SLC6A3对SNU-349细胞增殖的影响Fig.2 Effects of SLC6A3 downregulation on SNU-349 cell proliferation
2.3 下调SLC6A3促进SNU-349细胞凋亡
采用流式细胞术分析SLC6A3对SNU-349细胞凋亡及周期的影响,结果显示,下调SLC6A3后,癌细胞凋亡比例显著提高(1.70±0.26vs5.70±0.32,P<0.05,图3A),并将细胞生长阻滞于S期(26.70±0.87vs37.30±0.61,P<0.05,图3B)。
2.4 下调SLC6A3抑制SNU-349细胞迁移
采用transwell实验检测SLC6A3对SNU-349细胞迁移能力的影响,结果显示,下调SLC6A3后,细胞迁移能力显著降低(80.3±6.1vs20.7±3.2,P<0.05,图4)。
2.5 SLC6A3通过调控PI3K/Akt信号通路影响SNU-349细胞的生长
采用Western blot检测发现,下调SLC6A3后细胞内PI3K(0.73±0.04vs0.21±0.03,P<0.05)及Akt磷酸化(1.10±0.09vs0.14±0.02,P<0.05)水平显著降低(图5A)。进一步采用CCK-8法检测,结果显示,与shSLC6A3组比较,shSLC6A3+740 Y-P(PI3K激动剂)组细胞活力显著升高(48 h:0.95±0.04vs1.40±0.02,P<0.05,图5B)。上述结果表明,SLC6A3通过调控PI3K/Akt信号通路影响SNU-349细胞的生长。
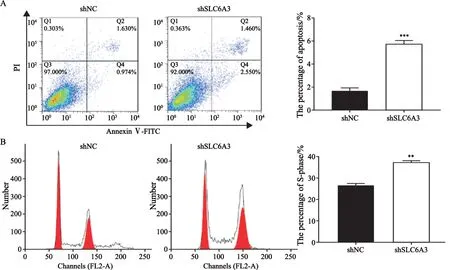
图3 下调SLC6A3对SNU-349细胞凋亡的影响Fig.3 Effects of SLC6A3 downregulation on SNU-349 cell apoptosis
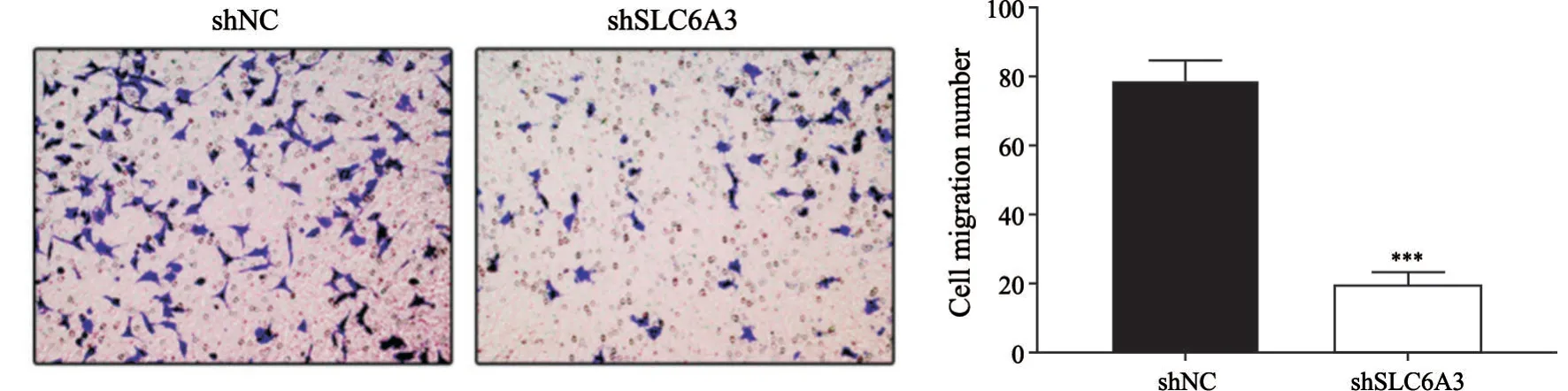
图4 下调SLC6A3对SNU-349细胞迁移能力的影响Fig.4 Effects of SLC6A3 downregulation on SNU-349 cell migration ability
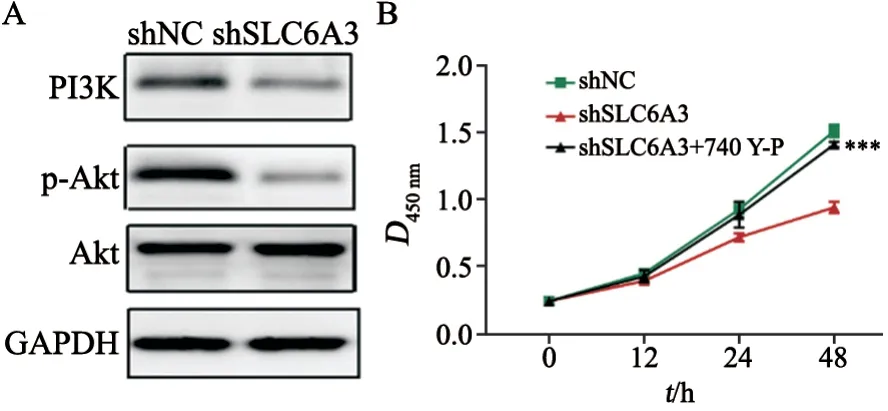
图5 SLC6A3通过调控PI3K/Akt信号通路影响SNU-349细胞的生长Fig.5 SLC6A3 affected the growth of SNU-349 cells by regulating the PI3K/Akt signaling pathway
3 讨 论
肾透明细胞癌是最致命的泌尿生殖系统癌症。据统计全球每年大约新增40万确诊病例及14万死亡病例,手术切除是目前主要的治疗方式,但是后期容易发生癌细胞转移[6]。因此,探究肾透明细胞癌的增殖、迁移机制具有重要意义。
SLC6A3作为一种转运蛋白,在机体内负责调节大脑中多巴胺的浓度,其表达异常与帕金森综合征、注意力缺陷及多动障碍等疾病相关[7]。最近研究[4]发现,SLC6A3在肾透明细胞癌中呈高表达,且其高表达预示着患者较短的生存期,表明SLC6A3可能参与调控肾透明细胞癌的进展。事实上,肿瘤细胞利用转运蛋白来维持其自身生长并不少见,如SLC2A1(编码缺氧诱导因子)在多种肿瘤细胞中表达上调从而为癌细胞快速增殖提供充足的能量[8-9],SLC2A3(编码高亲和力葡萄糖转运蛋白)同样在乳腺癌、结肠直肠癌和膀胱癌中呈高表达[10-12]。此外,肿瘤通常依赖谷氨酰胺来维持细胞内NADPH水平,因此许多具有转运谷氨酰胺功能的蛋白在癌细胞中表达上调[13],表明转运蛋白的功能与肿瘤细胞发生、发展存在着某种联系。但是关于SLC6A3如何调控肾透明细胞癌细胞生长的机制并不明确。
本研究首先证实SLC6A3在肾透明细胞癌及细胞中呈高表达,表明SLC6A3可能是肾透明细胞癌诊断的生物标志物,该结果与之前的研究[4,6]一致。进一步构建shSLC6A3细胞株,发现下调SLC6A3后,细胞增殖、迁移能力显著降低,而凋亡率显著增加。VHL基因失活,从而导致细胞内缺氧,缺氧诱导因子-1α(hypoxiainducible factor-1α,HIF-1α)增加,是肾透明细胞癌发生、发展过程中的主要特征[2]。有研究[14]发现,在人恶性胶质瘤中SLC6A3是HIF-1α的下游靶基因,具有促进癌细胞增殖与迁移的作用。所以我们推测在肾透明细胞癌中由于HIF-1α表达水平升高,从而促进了SLC6A3过表达,最终导致癌细胞增殖与迁移。
PI3K/Akt信号通路激活后能调控细胞周期相关蛋白的表达、抑制癌细胞凋亡,促进癌细胞增殖与侵袭、血管生成等,因此PI3K/Akt信号通路激活与多种肿瘤的发生密切相关[15]。有研究[16]表明,抑制PI3K/Akt信号的激活可以显著抑制肾透明细胞癌的增殖。本研究发现,与对照组比较,下调SLC6A3后细胞内PI3K及Akt磷酸化水平显著下降,表明SLC6A3可能通过调控PI3K/Akt信号通路参与肾透明细胞癌的进展。进一步采用PI3K激动剂处理shSLC6A3细胞,发现与shSLC6A3组比较,细胞增殖能力显著提高,表明SLC6A3通过调控PI3K/Akt信号通路影响肾透明细胞癌的生长。
综上,本研究发现SLC6A3在肾透明细胞癌组织中呈高表达,下调SLC6A3可抑制细胞增殖、侵袭,促进细胞凋亡。SLC6A3可能通过调控PI3K/Akt信号通路影响肾透明细胞癌的发生、发展过程。

