加味当归贝母苦参丸对慢性非细菌性前列腺炎大鼠前列腺组织炎症及脊髓氧化应激的影响
郑军状,董静波,陈 湛,张 尧,陈伟伟,裘 磊
(慈溪市中医医院·浙江 慈溪 315300)
慢性非细菌性前列腺炎(chronic nonbacterial prostatitis,CNP)是泌尿男科的常见病、多发病,多呈现慢性化,因炎症、疼痛、精神神经症状往往互为因果,形成恶性循环,致使临床治疗难以获效[1]。中医药因具有良好的抗炎镇痛作用,在治疗慢性非细菌性前列腺炎中有较大的应用空间[2],从历代古方中进一步挖掘中医药治疗本病的中医内涵是重点开发领域之一;当归贝母苦参丸即是其中较为有前景的方剂之一,有较好的抗炎效应[3]。在目前对CNP尚缺乏理想的临床药物治疗时,努力探索中医药治疗慢性前列腺炎显得十分迫切和可行。近年的研究表明氧化应激在前列腺炎引起的神经病理性疼痛中发挥重要作用[4-5]。本文以此为切入点,探究加味当归贝母苦参丸治疗CNP的可能机制。
1 材料
1.1 实验动物 SPF级2月龄雄性SD大鼠60只,体质量(240±20)g,由上海西普尔-必凯实验动物有限公司提供,动物许可证号: SCXK(沪) 2018-0008,委托浙江中医药大学实验动物中心采购并饲养,实验饲养室许可证号SYXK(浙)2018-0012。室温控制在21~25 ℃,相对湿度为40%~70%,12 h光暗循环,啮齿类动物标准颗粒饲料(由动物中心提供)喂饲,自由饮水、摄食,定期清洁和消毒。
1.2 实验药物 加味当归贝母苦参丸药由当归10 g、苦参10 g、浙贝母20 g、虎杖20 g、败酱草10 g、台乌药15 g、三七粉3 g等中药组成,均购自浙江中医药大学滨江门诊部,水煎浓缩至含生药量1.2 g/mL药液,灭菌后置4 ℃冰箱保存备用,低、中、高剂量分别临用时配制成含生药为0.3、0.6、1.2 g/mL。前列倍喜胶囊(由猪鬃草、王不留行、皂角刺、刺猬皮、蝼蛄等组成):贵州太和制药有限公司,国药准字:Z20025028,生产批号:20060203;临用时配制成0.16 g生药/mL。
1.3 实验试剂 苏木素染液:珠海贝索生物技术有限公司;伊红染液:珠海贝索生物技术有限公司;总超氧化物歧化酶(T-SOD)测试盒:南京建成生物工程研究所;8-epi PGF2a酶免试剂盒:南京建成生物工程研究所;其他试剂均为国产分析纯。百白破疫苗:武汉生物制品研究所;弗氏完全佐剂(FCA乳剂):美国 Sigma公司。
1.4 实验仪器 光学显微镜:日本Olympus optical Ltd;ASP200S全自动脱水机:德国Leica公司;RM2235石蜡切片机:德国Leica公司;G1150H加热石蜡包埋系统:德国Leica公司;HI120型摊片机:德国Leica公司;CMaxPlus酶标仪:美国MolecularDevices公司;610020-9Q化学发光仪:上海勤翔科学仪器有限公司;DS-U3数码显微成像系统:日本NIKON(尼康)公司。
2 方法
2.1 动物分组 将60只雄性SD大鼠随机数字表法分为6组,每组10只,即正常对照组,模型组,加味当归贝母苦参丸组低、中、高剂量组及前列倍喜胶囊阳性对照组。
2.2 动物模型建立 大鼠适应性饲养1 周,按相关文献及项目前期实验基础制备前列腺蛋白提纯液[6-7],建立CNP大鼠模型。采取腹腔注射10%水合氯醛麻醉大鼠后,用1‰新洁尔灭消毒下腹部皮毛,正常对照组除外,其他各组均采用下述方法造模。大鼠乙醚麻醉,腹腔注射百白破疫苗0.5 mL,多点皮内注射大鼠前列腺蛋白提纯液和FCA乳剂(比例为1:1的混悬液)1.0 mL。前列腺蛋白浓度为15 g/L。正常对照组分别行腹腔及皮内多点注射同剂量生理盐水注射液;以上各组均分别于0、30 d 2次注射,30 d后即可形成CNP模型。
2.3 给药方法及样本处理 造模后普通饲养,30 d后给药。正常对照组和模型组均予生理盐水灌胃;加味当归贝母苦参丸各组给予水煎剂,3、6、12 g/kg灌胃;阳性对照组给予前列倍喜胶囊混悬液1.6 g/kg灌胃;灌胃体积均为1 mL/100 g体重。各组均每天1次,给药时间为4周。
2.4 观察指标 给药结束后,禁食不禁水12 h,麻醉后快速取出前列腺组织及L6~S1脊髓待测,脱颈处死各组大鼠。
2.4.1 前列腺组织病理学观察 前列腺组织样本置入4%多聚甲醛溶液中,将样本和对应标签放于脱水盒内,酒精梯度脱水,蜡块包埋,切片,二甲苯脱蜡,苏木精染色,酒精分化,冲洗,无水乙醇脱水,经伊红染色,二甲苯透明,中性树脂固封,通过显微镜观察拍照(200倍和400倍镜下观察)。
2.4.2 L6-S1脊髓组织及神经节(DRG)氧化应激指标检测 将冻存的前列腺及L6-S1脊髓组织样本于37 ℃水浴解冻,称取一定量的组织,加9倍的生理盐水置入匀浆机中充分匀浆,2 500 r/min离心10 min,取上清液,ELISA检测8-epi PGF2a含量;采用黄嘌呤氧化酶法测定T-SOD活力。
3 结果
3.1 各组大鼠前列腺组织病理学观察 正常对照组可见前列腺组织腺体周围无分散淋巴细胞,细胞界限清晰,胞膜无增生;模型组前列腺组织淋巴细胞浸润严重,腺体上皮组织被破坏,胞膜簇状增生,胞浆颜色加深,细胞界限不清;给药组前列腺组织,有不同程度的淋巴细胞增多聚集,腺体上皮组织破坏,胞膜增生,细胞形态损伤,其中前列腺组织形态完整度由高到低为,阳性对照组>高剂量组>中剂量组>低剂量组。见图1。
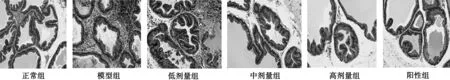
图1 各组大鼠前列腺组织病理学观察(HE,×200)
3.2 各组大鼠DRG 8-epi PGF2a含量及T-SOD活力的检测结果 见表1。
表1 各组大鼠DRG8-epi PGF2a含量及T-SOD活力比较
3.3 各组大鼠脊髓组织8-epi PGF2a含量及T-SOD活力检测结果 见表2。
表2 各组大鼠脊髓组织8-epi PGF2a含量及T-SOD活力比较
4 讨论
慢性非细菌性前列腺炎(chronic nonbacterial prostatitis,CNP)是以慢性盆腔疼痛及排尿异常为主,伴有或不伴有性功能障碍、精神神经症状的一类综合征。关于CNP的病因和发病机制,既往多认为是由未知的病原微生物所引起的感染性炎症,然而Lee等[8]2003年的一项研究并不支持感染致病的观点,国内也有研究认为前列腺组织中病原体的检出与CNP症状无病因学相关[9]。因此,近年来普遍认为,本病可能是不涉及病原微生物的非感染性炎症,包括物理因素造成的前列腺慢性长期充血、尿液返流引起的化学性炎症、氧化应激作用增强、自身免疫异常和细胞因子失调等因素,导致了前列腺组织淤血、缺氧、水肿、变性、纤维化等慢性炎症改变[10]。
在NIH制订的慢性非细菌性前列腺炎症状评分指数中,疼痛列为首要症状。CP/CPPS疼痛在神经调控方面有两个显著的特点,即疼痛的泛化性和持续性[11]。疼痛呈现出典型的内脏牵涉痛特点,即疼痛不仅仅限于前列腺所在部分,而且分布在整个膀胱尿道神经支配相关的骶神经支配区。脊髓背角是疼痛调节初级整合中枢,初级感觉传入神经位于脊髓背神经节,将外周的感觉信号传入脊髓背角的初级感觉神经元。
目前,有研究认为氧化应激可能是前列腺炎(特别是Ⅲ型)发病的因素之一[4-5],大量临床研究发现患有前列腺炎患者的前列腺液或精液中甚至血浆中的8-异前列腺素(8-epi PGF2a)、一氧化氮(NO)等高于非前列腺炎组患者,而抗氧化物质,如超氧化物歧化酶、谷光甘肽、维生素C等显著下降或活性降低[12-14]。氧化应激(OS)就是指体内产生过多的活性氧(ROS)或体内抗氧化和/或ROS清除剂水平的减退,导致二者之间的平衡被打破,从而引起炎症或组织损害[15]。进一步研究发现:ROS在神经病理性疼痛过程中发挥重要的作用,ROS清除剂如PBN、维生素E、依达拉奉等均可缓解神经病理性疼痛动物模型的行为学表现[15-16]。有研究认为前列腺内长时间的氧化应激可能诱发脊髓中枢发生继发性的氧化应激加剧,后者致敏中枢神经,从而易化疼痛的传导、维持和泛化。这可能是前列腺炎疼痛具有慢性、持续性、难治性及疼痛位置多变性等特点的根本原因[17]。一方面前列腺氧化应激可以引起脊髓中枢的氧化损伤,另一方面前列腺炎症产生的自由基及ROS,能激活脊髓中枢,引起痛觉神经元兴奋性提高。临床中CP/CPPS患者的往往存在顽固的疼痛,即使在前列腺炎其他症状消失后,疼痛仍可持续存在,推测脊髓中枢调控异常可能参与了CP/CPPS疼痛的发生、泛化及维持[18-20]。现有研究已经证实前列腺痛的相关初级神经中枢位于L5~S2脊髓节段[21]。
当归贝母苦参丸即是慢性前列腺炎中医药古方挖掘研究中较为有前景的方剂之一,当归贝母苦参丸方出自《金匮要略》“妊娠,小便难,饮食如故,当归贝母苦参丸主之。当归贝母苦参丸方:当归、贝母、苦参各四两,男子加滑石半两。上三味,末之,炼蜜丸如小豆大,饮服三丸,加至十丸”。其中,当归活血润燥;浙贝母清热散结,且能开宣肺气,寓提壶揭盖之意;苦参利湿热,除热结,与浙贝母合用,又能清肺而散膀胱瘀热。加味当归贝母苦参丸,在此基础上加虎杖、败酱草清下焦湿热,台乌药行气止痛,三七粉活血化瘀、通络止痛。合而用之,契合CNP气机不畅,湿热瘀阻的特点,使湿热去、血脉通、瘀结散。在CBP(慢性细菌性前列腺炎)大鼠实验研究发现,当归贝母苦参煎剂能显著降低CBP大鼠全血黏度;显著升高CBP大鼠前列腺组织SOD活性、降低MDA含量;显著下调ICAM-1的表达;显著升高IL-2含量和降低IL-8含量;能显著减少TNF-α、IL-1β等炎症细胞因子的产生,从而发挥抗炎效应[22]。
本研究发现CNP模型大鼠前列腺组织炎症明显,加味当归贝母苦参丸对CNP模型大鼠前列腺组织有较好的抗炎作用;进一步检测脊髓组织的氧化状态,模型组脊髓组织存在明显氧化应激状态,检测脊髓组织及DRG中8-异前列腺素(8-epiPGF2a)含量,加味当归贝母苦参丸组能明显减轻其氧化应激状态,可能是通过提高T-SOD活性而实现的。本实验结果提示加味当归贝母苦参丸能够减轻CNP模型大鼠前列腺组织组织形态学损伤,改善脊髓组织的氧化应激状态,可能是其减轻炎症及疼痛症状的作用机制之一。

