不饱和脂肪酸对人脂肪间充质干细胞生物学特性的影响
李锦灵,林立龙,李治寰
(东莞市恩联干细胞生物科技研究院,中国广东东莞523000)
人脂肪间充质干细胞(adipose-derived stem cells,ADSCs)是存在于脂肪组织中的一种多潜能干细胞,在特定条件下可诱导分化为成骨细胞、脂肪细胞、软骨细胞等多种细胞[1]。ADSCs免疫原性低,可减少同种异体间移植的排斥,且具有旁分泌功能,可分泌多种生长因子及炎性因子[2],在修复、替换、维持或增强组织和器官功能等研究领域显示出强大的再生医学功能,因此被广泛应用于临床研究[3]。据中国医药生物技术协会网站提供的信息(http://www.cmba.org.cn/common/index.aspxnodeid=281&pagesize=1&pagenum=10.htm),截至2020年11月,在国家卫生健康委员会备案的干细胞临床研究机构已增至111家,备案项目达100个,其中有5个临床研究项目使用的细胞为ADSCs,包括广东省中医院开展的ADSCs治疗中重度寻常型银屑病的试验;上海交通大学医学院附属仁济医院开展的异体ADSCs治疗膝骨关节炎的临床研究;聊城市人民医院开展的ADSCs治疗中重度溃疡性结肠炎及肺动脉高压的临床研究等。国内外多项ADSCs相关动物及临床研究证实,ADSCs具有应用于糖尿病足[4]、心肌缺血[5]、脑损伤[6]等修复治疗的潜力。
脂肪酸是生物体的供能物质和生物膜的重要组成部分,是膳食中重要的能量来源物质。脂肪酸根据饱和程度的不同可分为饱和脂肪酸(saturated fatty acid,SFA)和不饱和脂肪酸(unsaturated fatty acid,UFA),其中不饱和脂肪酸又分为单不饱和脂肪酸(monounsaturated fatty acid,MUFA)及多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)[7]。不饱和脂肪酸及其代谢产物是细胞结构和功能的重要组成部分,在干细胞命运调控方面具备特定的功能。2014年Kang等[8]在Stem Cells上发表的综述中提到,Ω-6和Ω-3族PUFA及其代谢产物与细胞结构及功能有关,它们可以通过多种作用机制,影响不同来源间充质干细胞(mesenchymal stem cells,MSCs)的生物学特性,例如促进多种干细胞的增殖及分化,继而影响干细胞的命运调控。目前,关于PUFA在干细胞分化中的作用研究主要集中在PUFA来源的代谢产物,包括花生四烯酸(arachidonic acid,AA)、二十二碳六烯酸(docosahexaenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)、前列腺素 E2(prostaglandin E2,PGE2)、白三烯 B4(leukotriene B4,LTB4)、血栓素A2(thromboxane A2,TXA2)和二十二碳五烯酸(docosapentaenoic acid,DPA),而研究的细胞模型多以神经干细胞为主,对MSCs的研究较少[8~9]。只有少量研究涉及DHA、EPA和AA等对人脐带、骨髓来源MSCs增殖或分化方面的影响[10~11]。三系分化能力是鉴定MSCs的标准之一,已有研究表明脂肪酸能影响体外培养的成肌干细胞的分化[12],但目前尚未有研究报道脂肪酸对ADSCs三系分化能力的影响。本研究旨在体外分离、培养ADSCs,并应用不饱和脂肪酸作用于ADSCs,探究MUFA中的油酸和PUFA中的亚麻酸对ADSCs形态、增殖、免疫表型及分化潜能的影响,为ADSCs提供更优化的培养体系,为脂肪酸应用于MSCs提供研究基础。
1 材料与方法
1.1 材料
脂肪组织取自东莞市第五人民医院的志愿者,使用含2%青链霉素混合液的生理盐水保存。
杜氏磷酸缓冲盐溶液(Dulbecco′s phosphatebuffered saline,DPBS)、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、α-MEM(MEM alpha basic)培养基、0.125%胰酶(Gibco公司,美国);人血小板裂解液(Helios公司,美国);Ⅷ型胶原酶(Sigma公司,美国);油酸(>85.0%,SG)、亚麻酸(>70.0%,SG)(梯希爱化成工业发展有限公司);MSC成脂诱导分化试剂盒、MSC成骨诱导分化试剂盒、MSC软骨诱导分化试剂盒、阿利新蓝、油红O、茜素红(赛业生物科技有限公司);青链霉素混合液、4%多聚甲醛(北京索莱宝科技有限公司);流式单抗PE mouse IgG1 κ isotype control(PE-ISO,同型对照)、PE mouse anti-human CD13、PE mouse anti-human CD29、PE mouse anti-human CD44、PE mouse anti-human CD73、PE mouse anti-human CD90、PE mouse antihuman CD105、PE mouse anti-human CD31、PE mouse anti-human CD45(BD 公司,美国);TriQuick Reagent(北京索莱宝科技有限公司);QIAzol Lysis Reagent(QIAGEN公司,德国);逆转录试剂盒、荧光定量PCR检测试剂盒(TaKaRa公司,日本);ultrapure distilled water(Invitrogen 公司,美国);BIOG血清血浆游离RNA提取试剂盒(常州百代生物科技股份有限公司)。
1.2 ADSCs的分离、培养与传代
取志愿者皮下脂肪组织,使用含2%青链霉素混合液的生理盐水与脂肪组织充分混匀,400g离心7 min后倒出脂肪组织,重复数次上述洗涤步骤,直至无明显血液残留。按照1︰1体积比加入0.15%Ⅷ型胶原酶溶液,充分混匀后置于37℃水浴锅中消化30 min,期间每隔5 min混匀一次。消化完成后400g离心7 min,弃上层脂肪,细胞沉淀重悬于含1%青链霉素混合液和5%人血小板裂解液的α-MEM培养基中。将细胞悬液用100 μm细胞滤网过滤后接种于T-175培养瓶,置于37℃、5% CO2培养箱中培养,培养72 h后更换不含青链霉素混合液的培养基并除去未贴壁细胞,之后每隔3 d换液,细胞融合度达80%后用0.125%胰酶消化2~3 min,加入3倍体积的生理盐水稀释消化,以1︰3比例传代,取第3~5代的细胞进行诱导增殖。
1.3 油酸或亚麻酸诱导ADSCs增殖的最佳浓度筛选
油酸、亚麻酸分别使用含5%人血小板裂解液的 α-MEM 培养基稀释成 20 μmol/L、40 μmol/L、100 μmol/L、200 μmol/L、300 μmol/L 的浓度梯度。将P5代ADSCs以每孔5×104个细胞的密度接种于6孔板,细胞过夜贴壁后将培养基换成2 mL含不同浓度脂肪酸的培养基,以不加脂肪酸的培养基为空白对照组,置于37℃、5% CO2的细胞培养箱中继续培养48 h,吸弃旧培养液并用生理盐水清洗,随后用0.125%胰酶消化细胞,终止消化后,制备单细胞悬液。使用Counstar IM 1200自动细胞计数仪(上海睿钰生物科技有限公司)检测细胞数量及细胞活率。
为优选最佳的使用浓度,首先设置大范围的浓度梯度,得出合适的浓度范围,再设置小范围的浓度梯度来测定具体的数值。因此,将油酸、亚麻酸使用含5%人血小板裂解液的α-MEM培养基继续稀释成 10 μmol/L、15 μmol/L、20 μmol/L、25 μmol/L、30 μmol/L 的浓度梯度。将 P4 代 ADSCs以每孔2×104个细胞的密度接种于6孔板,细胞过夜贴壁后将培养基换成2 mL含不同浓度脂肪酸的培养基,以不加脂肪酸的培养基为空白对照组,置于37℃、5% CO2的细胞培养箱中继续培养72 h,吸弃旧培养液并用生理盐水清洗,随后用0.125%胰酶消化细胞,终止消化后制备单细胞悬液并进行计数,比较各组的细胞数量及细胞活率。
1.4 油酸或亚麻酸对ADSCs形态的影响及生长曲线绘制
取5×104个ADSCs(P3代)接种于10 cm的培养皿中,细胞过夜贴壁后将培养基换成10 mL含20 μmol/L油酸或亚麻酸的完全培养基(含5%人血小板裂解液的α-MEM培养基),以不加脂肪酸为空白对照组,置于37℃、5% CO2培养箱中培养。每隔24 h在各组中随机选择3个培养皿,吸弃旧培养液并用生理盐水清洗1次,吸弃生理盐水后再加1 mL的0.125%胰酶消化细胞,终止消化后,制备单细胞悬液,吹打混匀,取20 μL细胞悬液与20 μL 0.2%台盼蓝溶液混匀后加样到细胞计数板上,使用细胞计数仪检测细胞数量及细胞活率(每孔取3个视野计数后取平均值进行统计分析),以时间为横轴,总细胞个数为纵轴绘制细胞生长曲线。各组细胞培养48 h后,在显微镜下观察并记录其形态是否有差异。
1.5 流式细胞术检测细胞免疫表型
取P3代细胞以4 500 cm-2的密度接种于T-175培养瓶,细胞过夜贴壁后将培养基换成含20 μmol/L油酸或亚麻酸的完全培养基继续培养,以不加脂肪酸为空白对照组,细胞融合度达90%后,取各组细胞进行流式细胞术分析。流式细胞术检测的具体步骤如下:收集各组ADSCs并使用1 mL PBS重悬细胞后计数,将1 mL细胞悬液均分至11个EP管中,每个EP管中的细胞数量为2.2×105个,3 000 r/min 离心 6 min,小心弃上清后再加入25 μL的PBS重悬细胞沉淀,将流式单抗PE-ISO(同型对照)及 CD13、CD29、CD31、CD44、CD45、CD73、CD90、CD105 对应的抗体各取 5 μL加入相应的EP管中,阴性对照组加入5 μL的DPBS(未染色的细胞即为阴性对照),混匀后4℃冰箱避光孵育30 min。孵育终止后,每管加入500 μL的PBS洗涤样品,3 000 r/min离心6 min,小心弃上清。洗涤两次后加入200 μL的PBS重悬,将细胞悬液转移到流式管中,采用流式细胞术分析细胞表面抗原的表达情况。
1.6 细胞三系分化能力检测
取P3代的ADSCs细胞以4 500 cm-2的密度接种于T-175培养瓶,细胞过夜贴壁后将培养基换成含20 μmol/L油酸或亚麻酸的完全培养基继续培养,以不加脂肪酸为空白对照组,细胞融合度达90%后,取各组细胞进行成脂、成骨、成软骨诱导培养并染色鉴定。
成脂分化能力检测:取4.5×105个ADSCs接种到装有2 mL MSC培养基的6孔板中,置于37℃、5% CO2培养箱中培养。待细胞融合度达到90%时,换成2 mL MSC成脂分化培养基A液[含10%胎牛血清(fetal bovine serum,FBS)、3-异丁基-1-甲基黄嘌呤、地塞米松、胰岛素、吲哚美辛];3 d后更换为2 mL培养基B液(含胰岛素及10% FBS);24 h后再更换成A液诱导,循环诱导7 d后使用油红O染液进行染色鉴定。
成骨分化能力检测:取4.5×105个ADSCs接种到装有1 mL MSC培养基的12孔板中,置于37℃、5% CO2培养箱中培养。待细胞长到基本融合时,更换1 mL MSC成骨分化培养基,每隔2 d更换一次MSC成骨分化培养基,培养14 d后使用茜素红进行染色鉴定。
成软骨分化能力检测:收集各组细胞并制备成单细胞悬液,计数后取出含有1.0×106个ADSCs的细胞悬液,1 200 r/min离心获得细胞沉淀,吸弃上清后加入10 μL MSC培养基重悬细胞沉淀,取5 μL细胞沉淀置于24孔板,以形成细胞微团。将细胞置于培养箱中培养,2 h后向24孔板中加入1 mL MSC成软骨诱导分化培养基,每隔2 d换一次MSC成软骨诱导分化培养基,培养14 d后使用阿利新蓝染液进行染色鉴定。
1.7 Q-PCR检测成骨、成软骨及成脂分化相关标志基因的表达水平
取P3代细胞以4 500 cm-2的密度接种于T-175培养瓶,细胞过夜贴壁后将培养基换成含20 μmol/L油酸或亚麻酸的培养基继续培养。细胞融合度达90%后,取1×106个细胞接种到装有2 mL完全培养基的6孔板中,每组重复2个孔,培养24 h后更换特定的诱导培养基进行成脂、成骨、成软骨诱导培养。诱导9 d后根据QIAzol Lysis Reagent说明书分别提取各组ADSCs的总RNA,并用微量分光光度仪检测RNA的浓度和纯度,随后根据逆转录试剂盒将RNA逆转录成cDNA。以cDNA作为模板,以GAPDH为内参,采用Q-PCR检测成脂标志基因PPAR-γ (peroxisome proliferator-activated receptor-γ)、成软骨标志基因SOX9(SRY-related protein 9)和COL2A1(typeⅡ collagen-A1)以及成骨标志基因ALP(alkaline phosphatase)、OCN(osteocalcin)、RUNX2(runt-related transcription factor 2)的mRNA表达水平。上下游引物均是根据NCBI提供的mRNA序列,使用Primer 3 Plus软件设计,由上海生工生物工程股份有限公司最终合成。PCR引物序列见表1。

表1 实时荧光定量PCR引物序列Table 1 Primers used for real-time quantitative PCR analysis
1.8 统计学分析
2 结果
2.1 不同浓度的油酸或亚麻酸对ADSCs增殖的影响
为了得出油酸或亚麻酸诱导ADSCs增殖的最佳浓度,我们开展了浓度梯度实验。首先,设置油酸或亚麻酸的浓度梯度为 20 μmol/L、40 μmol/L、100 μmol/L、200 μmol/L、300 μmol/L,结果如图 1所示。当油酸或亚麻酸浓度为20 μmol/L时,总细胞个数与对照组相比明显升高(P<0.05),细胞活率无显著变化(P>0.05);当浓度达到 40 μmol/L 时,总细胞个数有降低的趋势,而当浓度达到100 μmol/L时,细胞活率明显降低(P<0.05)(图 1A~D)。从上述实验结果可初步得出,油酸或亚麻酸的适用浓度应低于40 μmol/L。因此,我们进一步开展了小范围的浓度梯度实验,设置油酸或亚麻酸的浓度梯度为 10 μmol/L、15 μmol/L、20 μmol/L、25 μmol/L、30 μmol/L。结果显示:与对照组相比,当油酸或亚麻酸浓度达到20 μmol/L时,总细胞个数有明显的上升(P<0.01)(图 1E,G),而当浓度达到 25 μmol/L时,细胞的活率出现下降的趋势(图1F)。综上可知,油酸或亚麻酸诱导ADSCs增殖的最佳浓度为20 μmol/L。
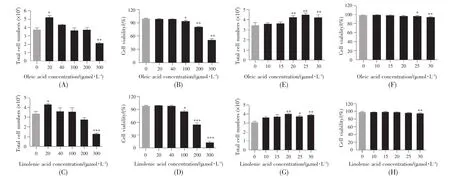
图1 不同浓度的油酸或亚麻酸对ADSCs增殖的影响与空白对照组比较:*P<0.05,**P<0.01,***P<0.001。Fig.1 Effects of different concentrations of oleic acid or linolenic acid on proliferation of ADSCs*P<0.05,**P<0.01,***P<0.001,compared with the control group.
2.2 油酸或亚麻酸对ADSCs生长曲线及细胞形态的影响
通过浓度梯度实验结果得出油酸或亚麻酸诱导ADSCs增殖的最佳浓度为20 μmol/L。因此,我们绘制了20 μmol/L油酸或亚麻酸培养的ADSCs的生长曲线,并通过重复实验验证油酸或亚麻酸是否能促进ADSCs增殖。从图2A可知,与对照组相比,20 μmol/L 亚麻酸培养 48 h、20 μmol/L油酸培养72 h后ADSCs数量显著增加(P<0.05),而培养96 h后各组细胞进入生长平台期,且总的细胞数量基本一致。从统计数量来看,与对照组相比,细胞在添加了脂肪酸的培养体系培养72 h后,其数量增加了20%左右。另外,从图2B可知,油酸或亚麻酸组在各培养时间点细胞的活率与对照组相比无显著差异(P>0.05),且都大于95%。使用油酸或亚麻酸培养48 h后的细胞形态如图3所示,细胞长梭形,较均一,呈旋涡状或编织状排列,各组细胞的形态无明显差异。以上实验结果表明,油酸或亚麻酸能够促进ADSCs增殖,且不会引起细胞形态发生改变。
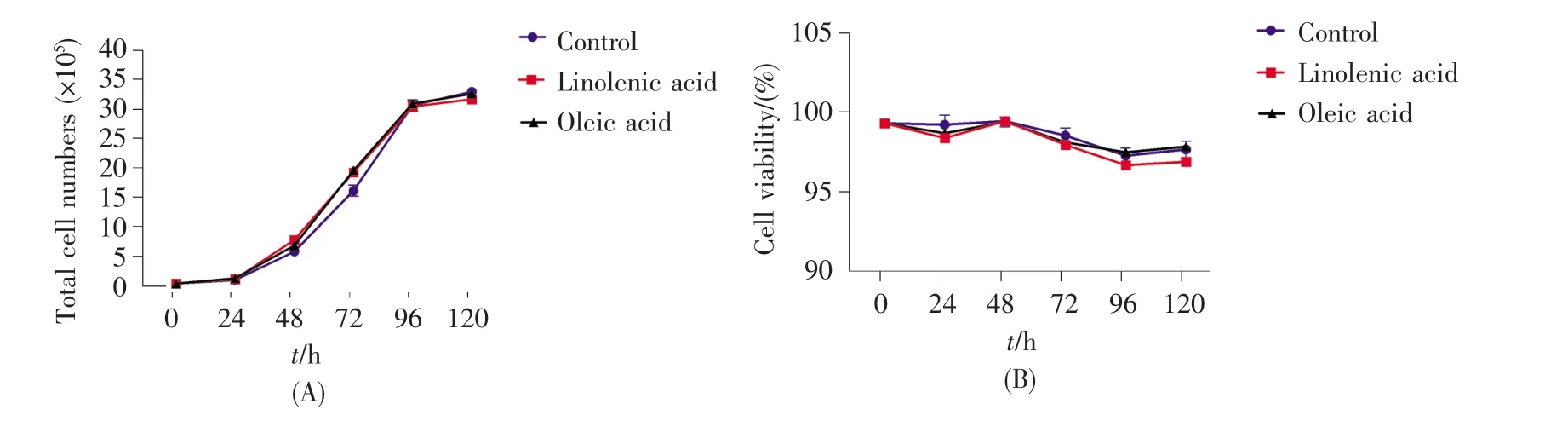
图2 油酸或亚麻酸培养ADSCs的生长曲线(A)及细胞活率(B)亚麻酸组与空白对照组比较:*P<0.05;油酸组与空白对照组比较:#P<0.05。Fig.2 The growth curve(A)and cell viability(B)of ADSCs cultured with oleic acid or linolenic acid*P<0.05,the linolenic acid group compared with the control group;#P<0.05,the oleic acid group compared with control group.

图3 油酸或亚麻酸培养48 h后ADSCs的形态(40×)Fig.3 The morphology of ADSCs cultured with oleic acid or linolenic acid for 48 hours(40×)
2.3 油酸或亚麻酸培养后ADSCs表面标志物的表达情况
油酸、亚麻酸能促进ADSCs增殖,为验证它们是否会影响ADSCs的干细胞特性,我们对其培养后的ADSCs进行了表面抗原检测。结果表明,20 μmol/L油酸或亚麻酸培养的ADSCs均表达CD13、CD29、CD44、CD73、CD90、CD105,不表达或低表达CD31及CD45,细胞表型和不添加脂肪酸的空白对照组无差异(表2、图4)。
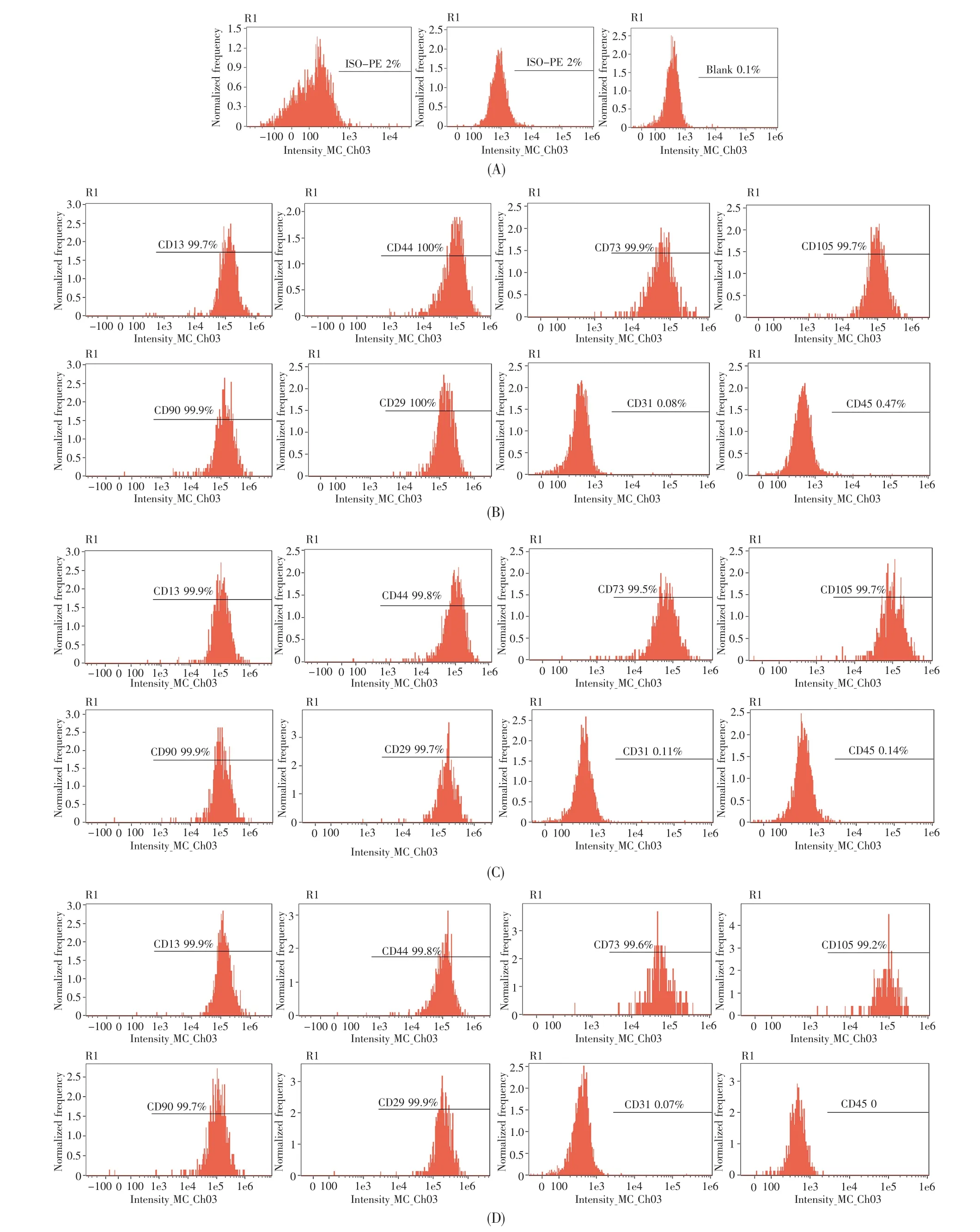
图4 不同实验组的流式细胞术分析结果(A)同型对照及阴性对照;(B)空白对照组;(C)油酸组;(D)亚麻酸组。Fig.4 The results of flow cytometry analysis in different experimental groups(A)The isotype control and negative control;(B)The control group;(C)The oleic acid group;(D)The linolenic acid group.

表2 油酸或亚麻酸培养后ADSCs表面标志物的表达情况Table 2 Expression of surface markers on ADSCs cultured with oleic acid or linolenic acid
2.4 油酸或亚麻酸培养后ADSCs的三系分化能力及分化相关基因的表达
为了进一步验证油酸或亚麻酸培养是否对细胞的分化能力产生影响,我们对各组细胞进行了成软骨、成骨及成脂诱导和染色鉴定(图5),并从分子水平检测了三系分化诱导培养9 d后相关标志基因的mRNA表达水平。ADSCs在成软骨诱导体系中诱导14 d后,细胞团逐步形成一个密实且有弹性的乳白色小球,阿利新蓝染色结果显示软骨细胞团呈蓝色。与对照组相比,油酸组及亚麻酸组诱导形成的软骨细胞团体积较大,形态较完整。Q-PCR检测结果显示,油酸组及亚麻酸组的成软骨标志基因SOX9和COL2A1的mRNA表达水平较对照组显著增高(P<0.05,图6A~B)。细胞在成骨诱导液中诱导14 d后,茜素红染色可见密集的细胞间散在大量的染为橘红色的矿化结节,说明诱导后细胞周围有明显钙沉积。其中,亚麻酸组生成的矿化结节稠密且染色最深,油酸组次之,而对照组生成的矿化结节面积较小且分散。Q-PCR检测结果显示,油酸组或亚麻酸组的成骨标志基因ALP、OCN及RUNX2的mRNA表达水平较对照组显著增高(P<0.05,图6C~E)。细胞经成脂诱导7 d后进行油红O染色,显微镜下可见细胞内脂滴呈鲜红色且边界清晰。在油酸或亚麻酸增殖培养后的ADSCs内脂滴的大小和数量均呈现增加的趋势,且成脂标志基因PPAR-γ的mRNA表达水平较对照组有显著增加(P<0.01,图6F)。实验结果表明油酸或亚麻酸能促进ADSCs的三系分化能力。此外,从表3的数据可得出,与成软骨及成脂相关基因的表达水平相比,油酸或亚麻酸对ADSCs成骨分化能力的促进更为显著。
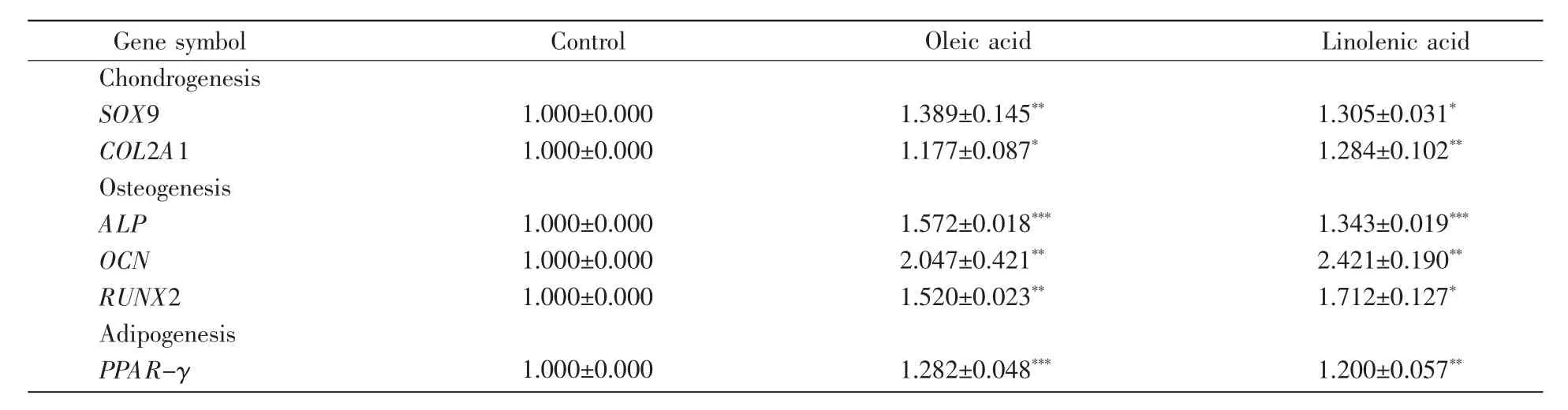
表3 各组ADSCs三系诱导分化相关基因的mRNA表达数据Table 3 The mRNA expression data of multilineage differentiation of ADSCs in each group
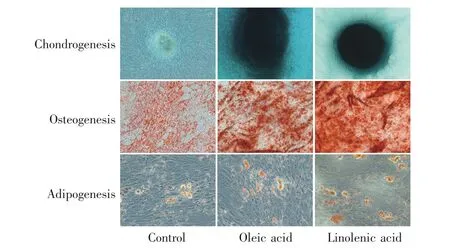
图5 各组ADSCs的成软骨分化(40×)、成骨分化(40×)和成脂分化(200×)效果Fig.5 Chondrogenesis(40×),osteogenesis(40×),and adipogenesis(200×)of ADSCs in each group
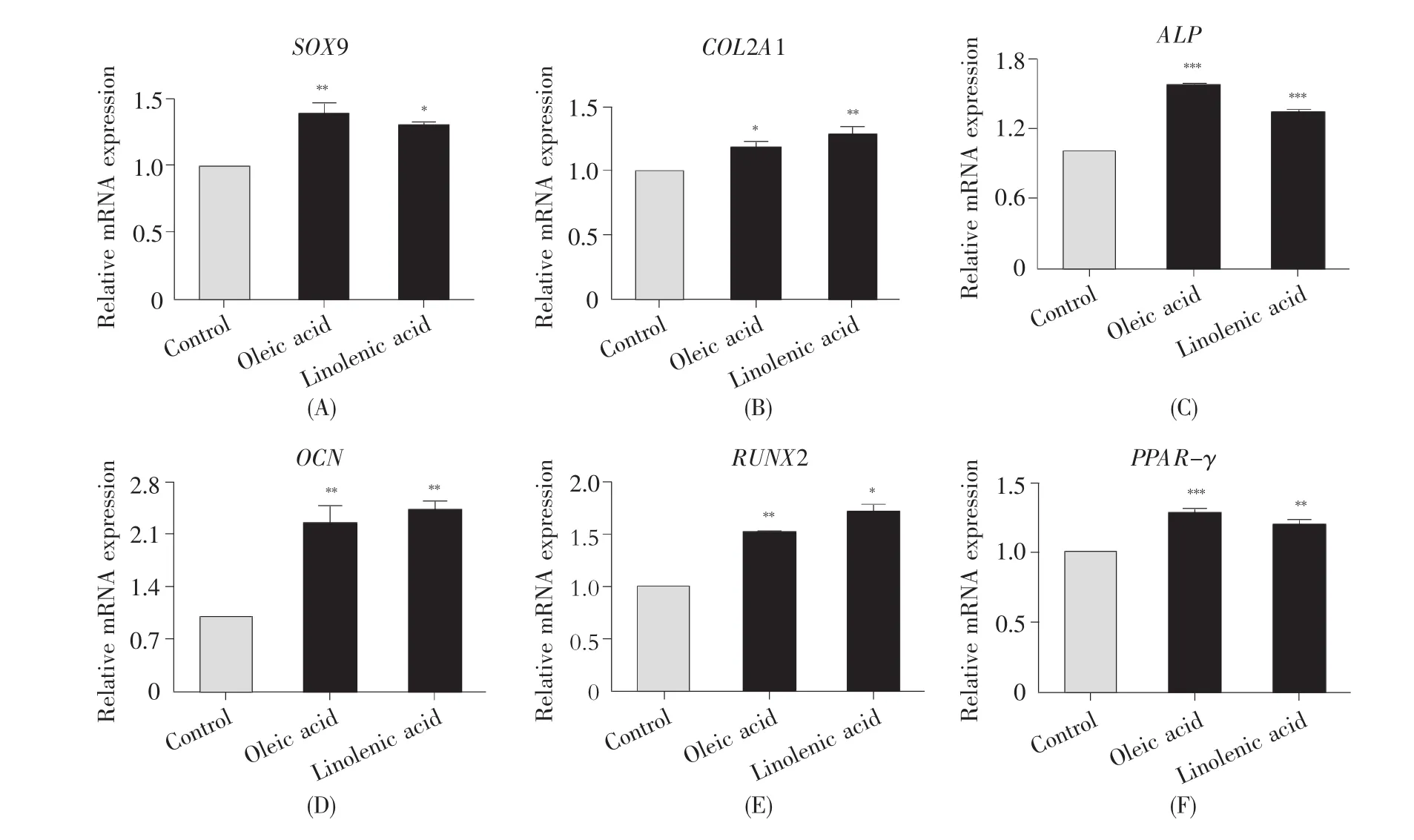
图6 各组ADSCs三系诱导分化相关基因的mRNA表达水平与空白对照组比较:*P<0.05,**P<0.01,***P<0.001。Fig.6 The mRNA expression levels of multilineage differentiation of ADSCs in each group*P<0.05,**P<0.01,***P<0.001,compared with the control group.
3 讨论
MSCs是一种多能成体干细胞,存在于胎盘、脐带、骨髓和脂肪等多种组织中,具有一定的分化潜能,可分泌多种利于组织重塑和免疫调节的细胞因子,这些特性使得MSCs成为治疗各种先天性和后天性疾病的出色候选者[14]。脂肪来源的MSCs具有来源丰富、取材方便、回植体内无需配型、免疫原性低、无肿瘤化倾向、可避免伦理法律问题等优点,在临床研究方面使用广泛[1]。国内临床研究显示,18名骨关节炎患者接受了不同剂量的自体脂肪来源的MSCs注射,96周的随访结果表明,关节内注射ADSCs可以改善患者膝关节的疼痛、功能和软骨体积[15]。另有研究表明,ADSCs移植可减轻炎症反应、促进血管新生、促进肉芽组织形成以及加速上皮化形成等,从而促进糖尿病足溃疡创面愈合[16]。在医疗美容领域,有研究表明ADSCs可用于丰胸丰唇、促进皮肤再生和伤口愈合、治疗脱发等[17~18]。临床试验和组织再生工程需要大量具有生物学活性的ADSCs,但是脂肪供体可以提供的脂肪样本量有限,且细胞在体外扩增培养的时间也有上限。为更好地满足临床需求,有必要在不降低细胞生物学活性的前提下,提高单位时间内收获的ADSCs的数量和质量。为实现这一目的,我们在细胞分离技术、培养基成分和培养条件等多方面进行技术攻关,提高ADSCs从组织中的分离效率以及在培养过程中的扩增效率。
ADSCs分离方法主要包括组织块贴壁法、胶原酶消化法、机械分离法、胶原酶结合组织块贴壁法和悬浮培养法等,其中主流的分离方法是组织块贴壁法和胶原酶消化法[19]。Ⅷ型胶原酶来源于溶组织梭菌,可产生粗胶原酶,具有梭菌蛋白酶、非特异性中性蛋白酶和胰蛋白酶活性,经测试适合脂肪细胞的消化和解离[20]。本研究采用0.15%Ⅷ型胶原酶对脂肪组织进行消化,结果显示该分离方法可获得形态均一的ADSCs。目前,MSCs的体外培养扩增体系常用基础培养基添加一定浓度的FBS,但FBS可能携带某些未确诊的动物传染病病毒或者含有致病性的朊病毒蛋白质以及针对胎牛抗原的异种蛋白质,在培养过程中动物源的蛋白质或肽段可能会污染MSCs,从而使其输入人体后发生免疫排斥反应[21]。研究发现,人血小板裂解液可以在体外扩增培养MSCs,且并不会引起MSCs生物学特性的改变[22]。另外,人血小板裂解液来源于人类,临床应用安全性高,故可作为FBS合适而安全的替代品。本研究使用0.15%Ⅷ型胶原酶进行组织消化后,使用含5%人血小板裂解液的α-MEM培养基作为基础培养体系。在此基础上,我们创新性地提出了在培养体系中加入一定浓度的油酸或亚麻酸。亚麻酸是Ω-3族PUFA中EPA及DHA的合成前体,其可能通过环氧化酶(cyclooxygenase-2,COX-2)代谢通路,产生代谢产物前列腺素(prostaglandin,PG),进而促进多种干细胞的增殖[8]。另外,有研究报道在20~60 μmol/L浓度范围内,反油酸和反异油酸能够显著促进ADSCs的成脂分化,其作用呈现剂量效应关系,其机制可能与Wnt/β-catenin信号转导通路有关[23]。
本研究将ADSCs使用20 μmol/L油酸或亚麻酸培养72 h后,与空白对照组相比,细胞数量增加了20%左右(图2A),所获得的ADSCs高表达CD13、CD29、CD44、CD73、CD90、CD105,低表达CD31、CD45,和不添加脂肪酸的培养基获得的ASDCs无显著差异(表2、图4)。在促进细胞增殖的同时,我们的培养方法也提高了细胞三系分化潜能(图5),与成软骨及成脂相关基因的表达水平相比,油酸或亚麻酸对成骨分化的影响更为显著(图6C~E)。另外,本研究发现,油酸或亚麻酸的浓度大于100 μmol/L时会产生细胞毒性,细胞出现凋亡(图 1A~D);而在 20~40 μmol/L 有效浓度范围内可促进ADSCs的增殖(图1E~F),且不会影响其干细胞特性。因此,低浓度的油酸或亚麻酸可考虑用作添加剂制备促进ADSCs增殖的培养基,在提高细胞增殖率的同时,又能提高细胞的分化潜能,从而快速获得更多稳定可靠的ADSCs,以用于各种基础研究及疾病治疗的临床试验。需要指出的是,油酸及亚麻酸促进ADSCs增殖及分化的机制仍需进一步的研究,且作为添加剂加入培养基中时,培养所得ADSCs的安全性有待进一步验证。