ST段抬高型心肌梗死患者微血管阻塞对左室功能及预后的影响
胡培堃,何 杰,吴连明,葛 恒,许建荣,卜 军
上海交通大学医学院附属仁济医院心内科,上海200127
随着经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)技术的进步,ST 段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI) 患者的总体预后趋于改善[1],但仍有部分患者在术中出现“无复流”现象[2],继而导致围术期不良结局及远期不良事件的发生[3],其主要病理生理基础是心肌微血管阻塞(microvascular obstruction,MVO)[4]。我 们 在 既 往 研究[5-6]中观察到STEMI患者再灌注后发生MVO 的比例高达60%~70%,且在PCI 或溶栓等再灌注方式之间差异不明显。
心脏磁共振(cardiac magnetic resonance,CMR)技术能够有效识别MVO 并依赖于钆对比剂(钆剂)增强对其进行定量分析。根据钆剂注入后采集图像时间的早晚,可将MVO 分为早期MVO 和晚期MVO。研究[7-8]表明,早期MVO 与晚期MVO 均与左室不良重构及患者不良事件有关,且晚期MVO 的预测价值较早期MVO 更高。目前,MVO对STEMI患者左室功能及预后的具体影响尚不十分清楚。本研究利用CMR技术识别STEMI患者的心肌微循环障碍,量化评估晚期MVO 与心功能及预后的关系,以期为STEMI 患者再灌注治疗后的临床干预提供更多依据。
1 对象与方法
1.1 研究对象
选择2016 年1 月—2017 年12 月期间于上海交通大学医学院附属仁济医院心内科就诊的STEMI 患者124 例。纳入标准:①符合STEMI 诊断标准[9]。②为首次发作,起病12 h 内成功行再灌注治疗。③成功行CMR 检查,且临床资料完整。排除标准:①存在血压、心率等血流动力学指标异常。②合并心房颤动等心律失常。③CMR 图像质量不佳。④不配合随访。
本研究已经过上海交通大学医学院附属仁济医院伦理委员会审查(批件号:仁济伦审[2020]006 号),并于临床实验数据库注册(注册号:NCT03768453)。所有入组对象均知情同意。
1.2 临床资料收集
患者的基线特征数据由接诊医师询问、检查和记录,包括:年龄、性别、吸烟史、饮酒史、高血压、糖尿病、高血脂、胸痛史、肾功能不全、卒中史、发病至再灌注治疗时间、再灌注治疗方式、犯罪血管、Killip 分级、发病至CMR检查时间等。
所有患者在首次医疗接触时由急诊护士完成采血,即刻检测的血生化指标包括:C 反应蛋白(C reactive protein,CRP)、白 细 胞 计 数(white blood cell count,WBC)、血红蛋白(hemoglobin,Hb)、血小板计数(platelet count,PLT)、纤维蛋白原(fibrinogen,FBG)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、国际标准化比率(international normalized ratio,INR)、血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)等。于收治入院次日清晨早饭前采血,检测的血生化指标包括:空腹血糖(glucose,Glu)、三酰 甘 油(triacylglycerol, TAG)、 总 胆 固 醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-Ch)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-Ch) 等。在住院期间,血清磷酸肌酸激酶(creatine phosphokinase,CPK)、肌酸激酶同工酶(creatine kinase MB,CK-MB)、心肌肌钙蛋白I(cardiac troponin I,cTnI)、B 型脑钠肽(type B brain natriuretic peptide,BNP)等血生化指标每24 h复测1次,取其住院期间的峰值进行记录。
记录患者再灌注治疗后30 d 内的不良事件,包括全因死亡、心肌梗死复发(患者需再次行PCI并开通犯罪血管)、胸痛复发(患者出现与术前类似的胸痛症状,但无需再次行PCI)、心力衰竭发作等。患者住院期间发生的不良事件由临床医师记录,出院后的不良事件通过电话随访和门诊随访采集并记录。
1.3 影像学检查、后处理及患者分组
在入组患者再灌注治疗后的(7±4)d 内,评估患者风险并予以知情同意后,行CMR 检查。采用3.0T 磁共振仪(Philips,荷兰),视野为350 mm×350 mm。在定位后,进行稳态自由进动序列(steady state free precession,SSFP)扫描,以获得左室短轴无间隔切面与长轴两腔心、三腔心、四腔心切面的电影图像用于评估左室功能。随后采用马根维显(Bayer HealthCare Pharmaceuticals,德国)作为对比剂,以0.15 mmol/kg 的剂量进行静脉注射,完毕后延迟约10 min以相位敏感的反转恢复序列(phasesensitive inversion recovery,PSIR)采集左室短轴切面图像8~10 层, 以获得延迟钆增强(late gadoliniumenhancement,LGE)图像用于评估患者晚期MVO。主要扫描参数为:回波时间(echo time,TE)1.7 ms,重复时间(repetition time,TR)3.3 ms,翻转角25°,扫描前采用Look-Locker序列选定合适的反转时间(inversion time,TI)抑制正常心肌信号。
采用CVI 42 软件(Circle Cardiovascular Imaging,加拿大)对CMR图像进行后处理,由2名对患者情况不知情的影像科或心内科医师分别独立完成。后处理获得的CMR 指标包括左室射血分数(left ventricular ejection fraction,LVEF)、心肌梗死百分比、心肌MVO 百分比。具体操作过程为:在左室电影图像中,利用软件测量左室舒 张 末 容 积 (left ventricular end diastolic volume,LVEDV)和左室收缩末容积(left ventricular end systolic volume,LVESV),以获得LVEF。心肌梗死区在LGE 图像中表现为高信号区,梗死区中心的低信号区为心肌MVO 区。利用软件对左室短轴切面图像的心内膜及心外膜进行描记,软件识别描记点到与内膜、外膜重合的轮廓线。随后软件自动识别心肌梗死区和心肌MVO区(图1),必要时需手动调整识别区域。完成描记和识别后,软件即可计算出心肌梗死百分比(即心肌梗死区体积在左室心肌体积中所占百分比)和心肌MVO 百分比(即心肌MVO 体积在左室心肌体积中所占百分比)。根据患者心肌MVO 情况,当心肌MVO 百分比>0.01%时划分为MVO(+) 组,反之则划分为MVO(-) 组。其中,MVO(+)组依据心肌梗死百分比的四分位数进一步分为4个亚组,依次为Q1组、Q2组、Q3组、Q4组。
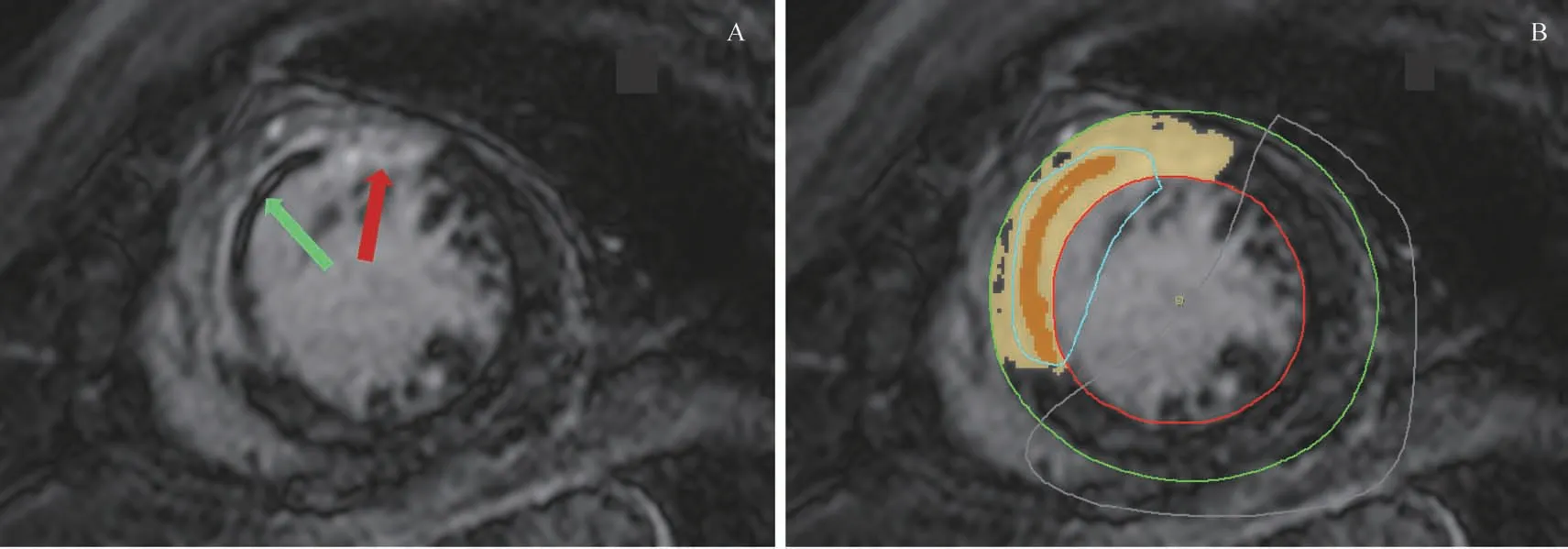
图1 CVI 42软件识别心肌梗死区和心肌MVO区Fig 1 Identification of myocardial infarction region and myocardial MVO region by CVI 42 software
1.4 统计学方法
所有研究数据均采用SPSS 24.0 软件进行统计分析。定性资料以频数(百分比)表示,根据检验方法的适用条件选择使用χ2检验或Fisher确切概率法进行比较。采用Shapiro-Wilk 检验对定量资料进行正态性检验,若符合正态分布则以x±s 表示,并采用t 检验进行比较;若符合偏态分布则以M(Q1,Q3)表示,并采用Wilcoxon ranksum 检验进行比较。在MVO(+)组中,采用Pearson 相关分析对心肌MVO百分比与LVEF之间的关系进行分析。采用受试者操作特征曲线(receiver operator characteristic curve,ROC curve,ROC 曲线)分析心肌MVO 百分比对MVO(+)患者30 d 内不良事件的预测价值。以P<0.05表示差异具有统计学意义。
2 结果
2.1 2组患者的基线特征比较
根据心肌MVO 百分比的计算结果,本研究中MVO(+)组患者为82 例(占66.1%),MVO(-)组患者为42 例(占33.9%)。对患者的基线特征数据进行统计分析,结果(表1)显示2 组患者的所有指标间差异均无统计学意义。
2.2 2组患者的血生化指标及CMR指标比较
对2 组患者的血生化指标进行统计分析,结果(表2)显示CPK 峰值(P=0.000)、CK-MB 峰值(P=0.000)、cTnI 峰值(P=0.022)、WBC(P=0.016)、TC(P=0.039)间差异均具有统计学意义,且上述指标均在MVO(+)组患者中更高。对2 组患者的CMR 指标分析,结果(表2)显示,与MVO(-)组相比,MVO(+)组患者的LVEF 更低(P=0.000),心肌梗死百分比更高(P=0.000)。
2.3 心肌MVO与左室功能的关系
采用Pearson 相关分析对MVO(+)组亚组的心肌MVO百分比与LVEF的相关性进行研究,结果(图2)显示,所有亚组的心肌MVO 百分比与LVEF 均呈负相关(均P<0.05)。
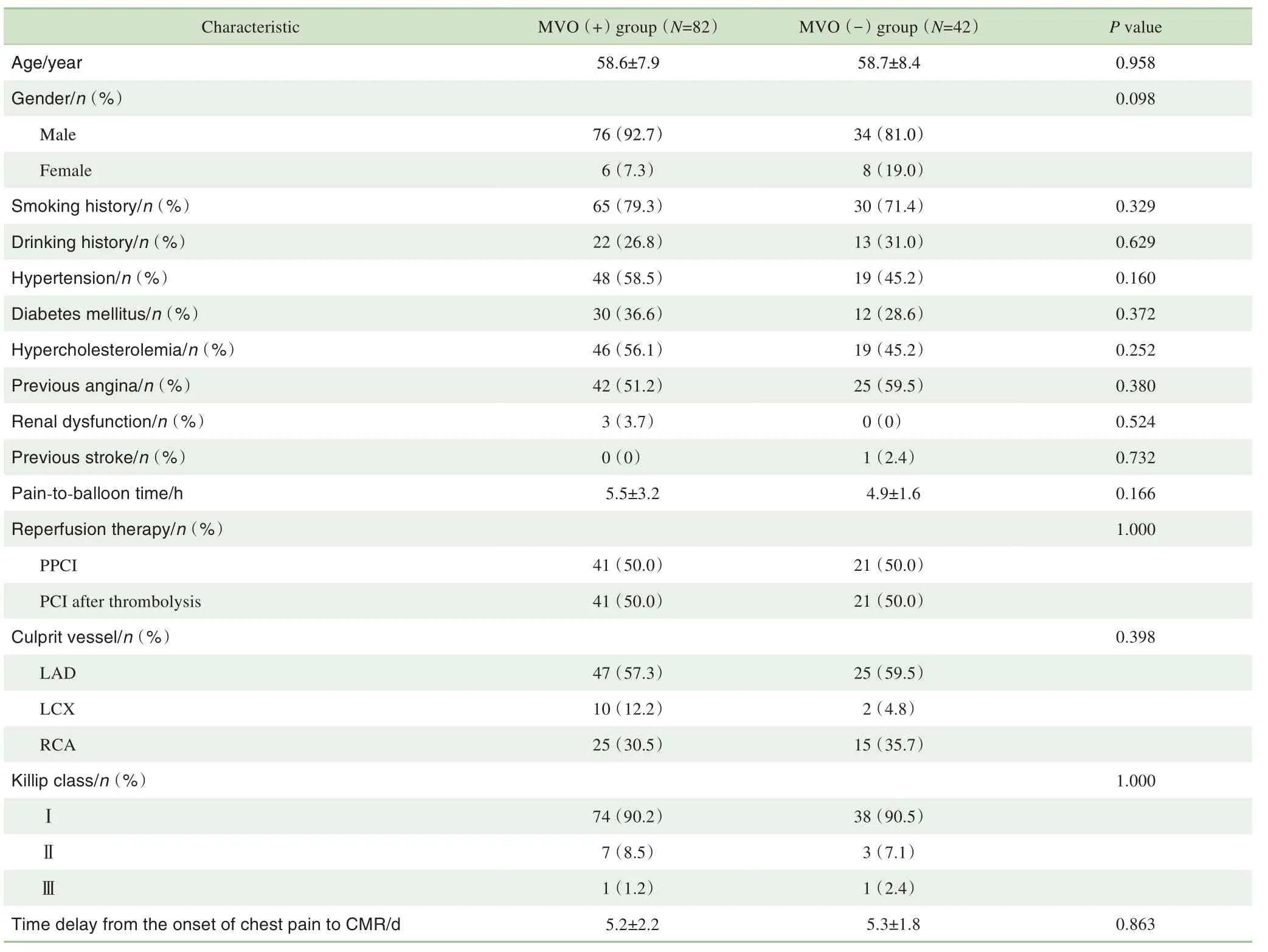
表1 2组患者的基线特征比较Tab 1 Comparison of baseline characteristics between the two groups
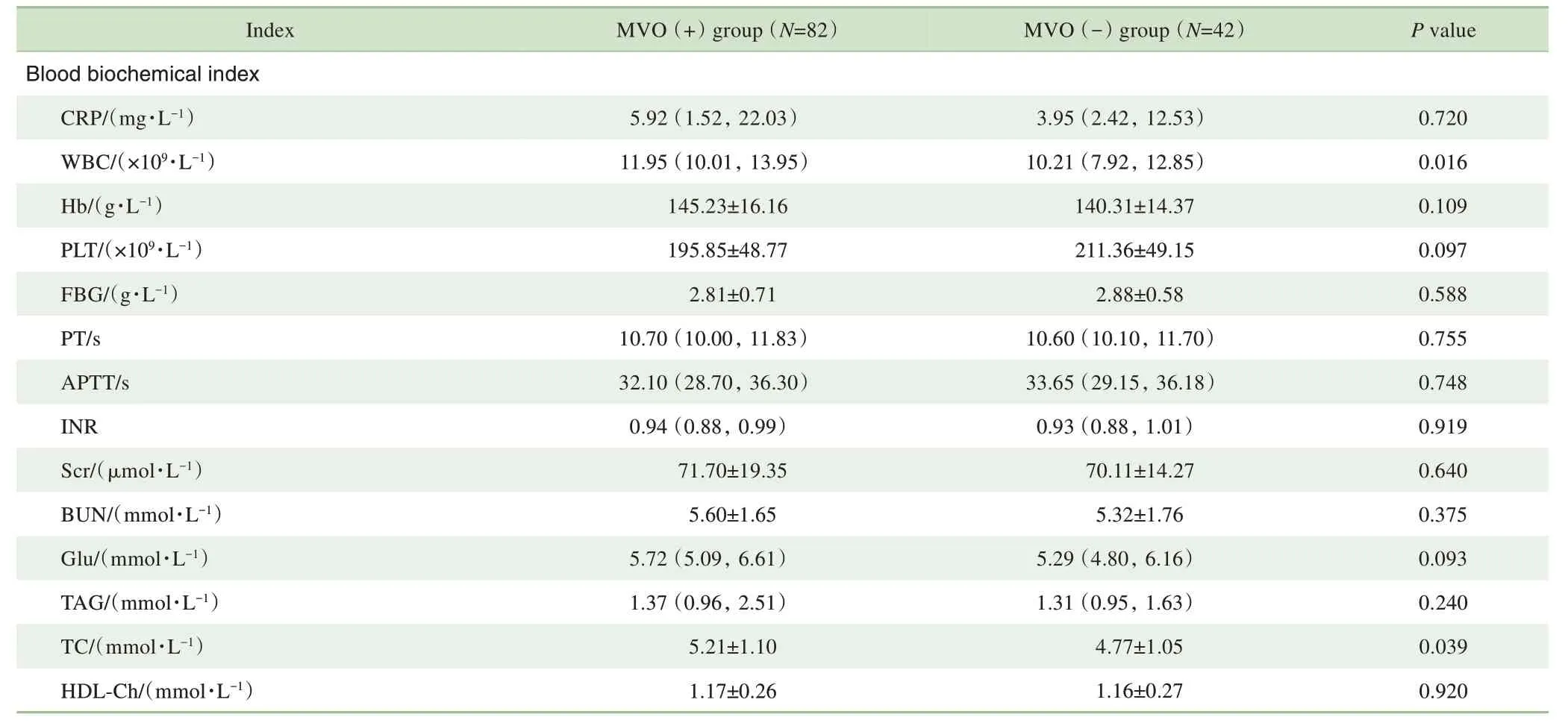
表2 2组患者的血生化指标及CMR指标比较Tab 2 Comparison of blood biochemical indexes and CMR indexes between the two groups
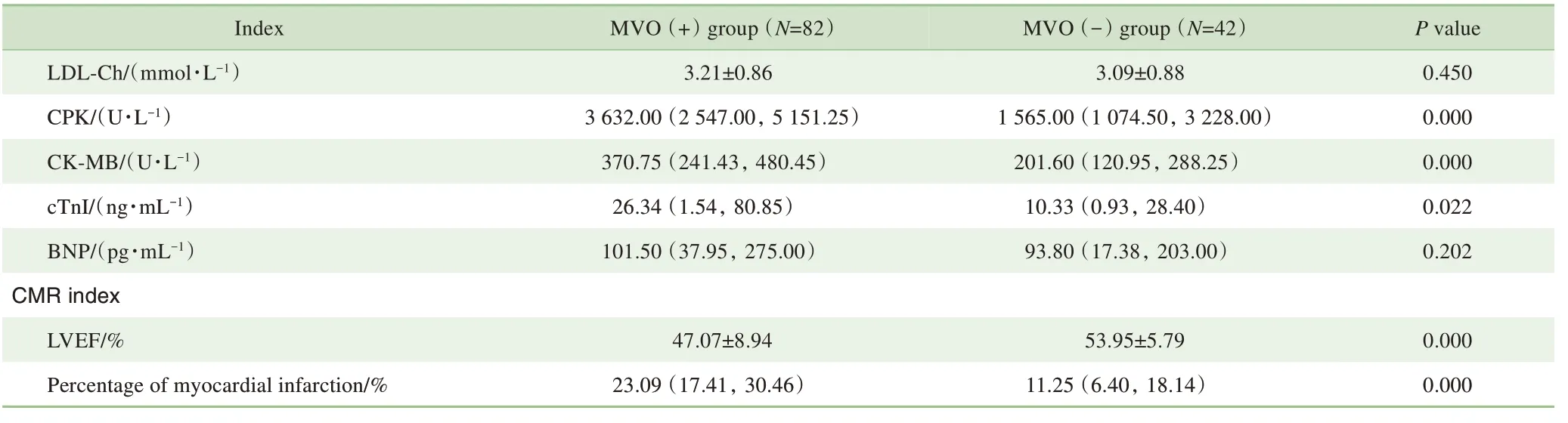
Continued Tab
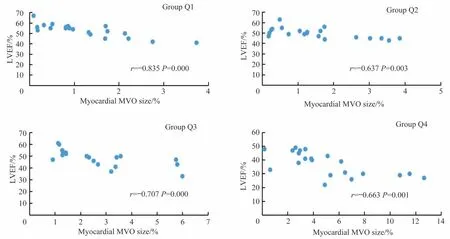
图2 MVO(+)亚组的心肌MVO百分比与LVEF的相关性Fig 2 Correlation between the percentage of myocardial MVO size and LVEF in the MVO(+)subgroup
2.4 2组患者的不良事件分析
对所有患者再灌注治疗后30 d 内发生的不良事件进行记录,结果(表3)显示MVO(+)组患者心力衰竭发作的比例高于MVO(-)组(P=0.018)。采用ROC 曲线分析心肌MVO 百分比与心肌梗死百分比对MVO(+)患者30 d 内不良事件的预测价值,结果(图3)显示心肌MVO 百分比的曲线下面积为0.889 (95%CI 0.823~0.975),心肌梗死百分比的曲线下面积为0.785(95%CI 0.660~0.911);且根据ROC 曲线比较二者的预测价值发现,心肌MVO 百分比的敏感度和特异度都高于心肌梗死百分比(表4)。
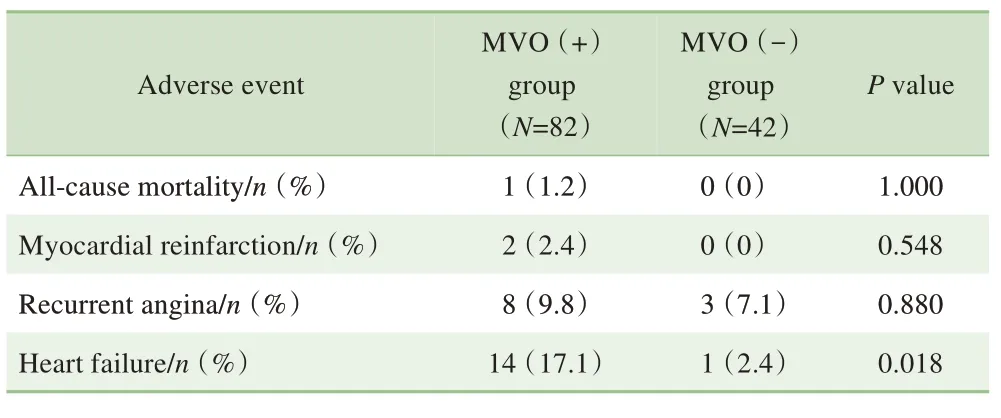
表3 2组患者30 d内不良事件比较Tab 3 Comparison of adverse events within 30 days between the two groups
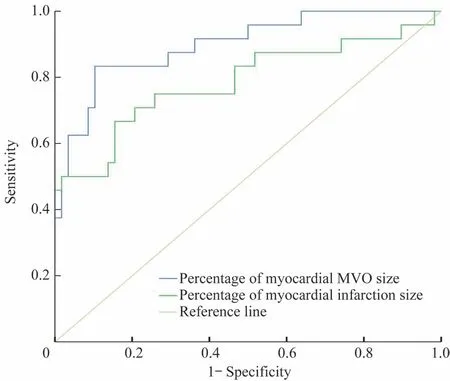
图3 心肌MVO 百分比与心肌梗死百分比对MVO(+)患者30 d内不良事件预测价值的ROC曲线Fig 3 ROC curve of predictive value of the percentage of myocardial MVO size and myocardial infarction size for adverse events within 30 days in the MVO(+)patients

表4 心肌MVO百分比与心肌梗死百分比预测价值的比较分析Tab 4 Comparative analysis of predictive value of the percentage of myocardial MVO size and the percentage of myocardial infarction size
3 讨论
近年来,随着再灌注治疗技术的进步,STEMI 患者的住院死亡率不断下降,但心力衰竭的发生并无明显改善[10];且有研究[11]提示,MVO 可能在其中发挥了重要作用。因此,如何准确评估MVO对进一步改善STEMI患者的预后十分重要。在目前的诊疗工作中,STEMI 患者的冠状动脉主干及主要分支狭窄已被及时开通,但其心肌微循环障碍仍不易被评估和干预。CMR 技术的出现,因其无创、相对易行、空间分辨率较好等优势成为了临床上用于评估MVO 的主要方法。研究显示该技术可分析早期MVO 及晚期MVO,前者是在钆对比剂注入2~5 min后采集图像,以获得早期钆增强(early gadoliniumenhancement,EGE)图像[12];后者则是在钆对比剂注入10~15 min 后采集图像,以获得LGE 图像[13]。本研究即利用LGE图像对STEMI患者的晚期MVO进行分析。
本研究在比较了MVO(+)组与MVO(-)组患者的基线特征后,对其血生化指标和CMR 指标进行比较分析,并进一步对MVO(+)亚组患者的心肌MVO 百分比与LVEF的相关性进行分析。结果显示,在所有纳入的患者中,MVO(+) 组患者占比66.1%,这与既往的报道[14]相接近;在2 组患者的基线特征无显著差异的前提下,MVO(+)组患者的心肌酶相关指标(包括CPK、CK-MB、cTnI)、TC 均显著高于MVO(-)组,且CMR指标检测也表明MVO(+)组心肌梗死百分比显著高于MVO(-)组,进一步提示MVO 的形成伴随着更严重的心肌损伤及微血管损伤,这与已有的病理生理学研究及临床实践经验相一致[15]。此外,WBC亦在MVO(+)组中表现出了更高的水平,这可能与MVO 形成过程中的细胞聚集有关,其相关机制可能包括:①血管内皮损伤后可暴露内皮下组织,引起血小板的黏附、聚集等反应[16]。②因局部炎症反应的存在,中性粒细胞等炎症细胞也被募集[17]。但由于WBC 指标易受其他因素干扰,且同一患者的WBC 可能存在较大变化,故仍需进一步研究加以验证。
在分析MVO 对左室功能的影响时,本研究将所有MVO(+)组患者按照心肌梗死百分比的四分位数依次分为4 个亚组,Pearson 相关分析显示在各亚组中心肌MVO 百分比与LVEF 均呈显著的负相关;继而提示,MVO 的严重程度与左室功能的损害程度密切相关。根据相关报道[18-19]显示,MVO对左室功能的影响可能存在如下原因:一方面,MVO 的严重程度与心肌梗死的严重程度密切相关,更大范围的MVO 通常伴随着更大范围的心肌梗死,而后者则可加重左室结构和功能的损害;另一方面,MVO 的形成与再灌注后心肌的不可逆损伤有关。此外有研究[20]发现,在对心肌梗死范围控制变量的情况下,MVO 仍可独立预测LVEF 的下降,其预测价值可能与MVO对左室功能的影响有关。
本研究随访了患者30 d 内不良事件的发生情况,并利用ROC 曲线对MVO(+)组的相关数据进行分析,结果显示心肌MVO 百分比对MVO(+)组患者30 d 内发生不良事件的预测价值较好,且优于心肌梗死百分比。既往已有大量证据表明LVEF与STEMI患者的预后相关[21],且LVEF 可通过心脏彩色多普勒超声进行测量,简便易行,因此已广泛应用于对患者预后的评估。然而,与LVEF 检测相比,MVO 测量过程相对复杂,但仍存在如下优势:①MVO可作为STEMI患者发生不良事件的预测因素[22],与左室不良重构关系更为密切[23]。②MVO 可反映患者术后心肌修复情况[24],故用于评估预后时更为有利。③MVO 测量不易受到血流动力学等因素的干扰[25],以及由人为主观因素带来的误差影响。因此,采用MVO 评估STEMI 患者预后有望获得更为准确的结论,从而更易于患者收益。
本研究尚存在一定的局限性:①为单中心研究,且样本量相对较小。②研究纳入的均为KillipⅠ~Ⅲ级的患者,部分基础心功能更差的患者未能行CMR 检查和纳入研究。③随访时间较短,尚缺乏中长期的预后趋势。
STEMI 患者的左室功能对患者的预后及生活质量至关重要,因此在诊治过程中调整有关用药时需要慎重考虑。综上,本研究发现了STEMI患者在合并MVO时的左室功能更差,倾向于更差的临床结局,因此临床实践中对相应患者的治疗应更为积极。

