中国对虾NAGase 基因SNP 标记的筛选及与耐高pH 性状的关联分析*
韩 旭 何玉英 李 健 张海恩 周雨欣
(1. 上海海洋大学水产科学国家级实验教学示范中心 上海 201306;2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;3. 中国水产科学研究院黄海水产研究所农业农村部海水养殖病害防治重点实验室 青岛 266071)
pH 是反映水体水质状况的一个重要指标,正常海水pH 值一般维持在7.8~8.5,养殖过程产生的残饵及粪便会增加水体的氮磷营养盐含量,使养殖水体富营养化,藻类随之会产生过度的光合作用,水污染、极端天气等都会造成海水pH 值升高(Herbeck et al,2013; 李瑞萍等, 2015; Li et al, 2019)。pH 是养殖过程中主要的非生物胁迫因子之一,当水体pH 偏离水生生物生存的适宜范围,会引起水生生物的应激反应,特别是持续较高pH 刺激会增加水生生物的抗氧化酶活性(王芸等, 2011),引起严重的细胞凋亡(Li et al,2019)和生物DNA 损伤(Wang et al, 2009),生物体内的Na+/H+交换体(NHE) (李政道等, 2018)、质子泵(H+-ATPase) (胡硕等, 2019)、碳酸酐酶(Carbonic anhydrase,CA) (Liu et al, 2015)等相关离子调控酶的活性发生改变,进而导致对虾生长缓慢、免疫力降低,感染疾病的几率增加(Li et al, 2008)。
N-乙酰-β-D-氨基葡萄糖苷酶(NAGase)又称壳二糖酶,是几丁质酶系的一种(Broadway et al, 1995),在免疫、蜕皮和消化几丁质食物中发挥重要作用(Xie et al, 2010),经常作为氧化应激反应的指示酶(Gabai et al, 2004; Corsi et al, 2010)。吕艳杰等(2018)研究表明,1-苯甲基-5-[(E)-2,6-二甲基-1,5-庚二烯](KK-42)处理会加速日本沼虾(Macrobrachium nipponense)NAGase 酶活力的表达,加快旧表皮的降解,从而缩短对虾蜕皮周期;Sun 等(2018)研究发现,脊尾白虾(Exopalaemon carinicauda) NAGase 主要在表皮和肝胰腺中表达,且在蜕皮期表达量最高。在高pH 环境下,水体中的金属离子的溶解会受到影响(Tucker et al,2008)。Xie 等(2009)研究发现,Zn2+通过与组氨酸或半胱氨酸残基结合,会改变凡纳滨对虾(Litopenaeus vannamei)NAGase 酶的活性和构象。Mesquita 等(2015)研究镉处理的青蟹(Carcinus maenas),其能够通过NAGase 酶的螯合作用增强其耐受性。Latif 等(1994)和刘金生等(2016)研究表明,在高碱环境下,甲壳动物蜕皮更频繁。由此推测,在高pH 胁迫下,中国对虾NAGase 也参与一定的免疫调控作用。
单核苷酸多态性位点(Single nucleotide polymorphisms,SNPs)是指在基因组水平上由于单个核苷酸突变使得DNA 序列的多态性增加(Wang et al, 1998)。SNPs 作为遗传标记有位点数量多、多态性丰富(Kwok et al,1996)、能稳定遗传、能联合GWAS 进行分析及检测方法简单、快速的优势(Yang et al, 2012)。SNP 作为DNA 分子标记在很多水产动物研究中得到应用,如海湾扇贝(Argopecten irradians) (Meng et al, 2017)和文蛤(Meretrix meretrix) (Dai et al, 2017)的生长性状,斑马鱼(Danio rerio)的低温耐受性(王倩等, 2015)、凡纳滨对虾的繁育性状(王冉等, 2018)、罗氏沼虾的免疫力(唐修阳等, 2019),中国对虾抗WSSV 能力(逄锦菲等, 2013)等性状相关SNP 标记的筛选,但有关中国对虾耐高pH 胁迫的SNP 标记筛选未见报道。
本研究基于高pH 胁迫中国对虾的转录组数据库筛选出响应高pH 胁迫的基因——NAGase,对该基因预测的52 个SNP 位点进行筛选、验证及与耐高pH性状的关联分析,以期获得与耐高pH 性状相关的SNP 标记,为中国对虾耐高pH 性状新品种(系)的培育提供技术支撑。
1 材料与方法
1.1 实验材料
本实验所用中国对虾“黄海3 号”来自山东省潍坊昌邑市海丰水产养殖有限责任公司,体长为(7.25±1.32) cm,体重为(4.75±2.42) g,约400 尾,置于室内养殖池暂养7 d,暂养期间连续充气,每天按时换水清污,换水量约为总体积的1/3;每天按照中国对虾体重的5%投喂配合饲料,定时投喂2 次。实验期间,海水温度为27℃~30℃,盐度为32~35,pH 8.14~8.22。
在4 m×2 m 的水泥池中,使用1 mol/L 的NaOH调节海水pH。整个实验期间,每日定时采用YSI 水质分析仪测定并及时校正海水pH 至9.3,变化幅度不超过0.05。当海水的pH 相对稳定时开始实验。实验期间,将400 尾对虾放入实验池中,观测对虾存活、摄食及活动情况,发现身体侧躺、对外界刺激没有反应时,及时捞出。胁迫实验早期死亡的48 尾和后期死亡的48 尾对虾分别作为敏感组和抗性组。
1.2 实验方法
1.2.1 基因组DNA 的提取 采用传统的酚–氯仿法提取中国对虾肌肉基因组DNA,用超微量紫外可见分光分析仪与1%琼脂糖凝胶电泳检测DNA 质量,稀释至30 ng/μl,置于–20℃冰箱中备用。
1.2.2 直接测序法筛选中国对虾NAGase 基因SNP位点 在NCBI 库中查找中国对虾NAGase 基因登录号为DQ280379.1,总长为2197 bp,其中,ORF为1902 bp,5ʹ非编码区(5ʹ-UTR)为70 bp,3ʹ非编码区(3ʹ-UTR)为225 bp,编码633 个氨基酸。利用Primer 5.0 软件设计扩增FcNAGase 序列全长的引物,要求扩增的相邻PCR 产物有重叠的部分,以确保内含子部分的有效扩增,进而筛选到FcNAGase 上全部的SNP 位点。共设计11 对引物,由生工生物工程(上海)股份有限公司合成,扩增成功引物信息见表1。
1.2.3 PCR 扩增和产物检测 随机选取高pH 胁迫敏感组和抗性组各6 个样品DNA 进行混合,作为PCR 反应的模板,用2×Taq Plus Master Mix Ⅱ(Dye Plus)酶(南京诺唯赞)进行扩增。PCR 体系总体积20 μl,酶10 μl,上下游引物各1 μl (10 μmol/L),混合模板2 μl,去离子水6 μl。反应程序:94℃预变性4 min;94℃变性30 s,退火1 min,72℃延伸40 s,共30 个循环;72℃终延伸10 min。PCR 产物用1%琼脂糖凝胶电泳检测,挑选明亮且单一的条带送生工生物工程(上海)测序。
1.2.4 测序结果及SNP 位点的初步确定 测序结果使用软件ContigExpress 进行拼接,确定是否有内含子存在,是否符合GT-AG 原则;根据测序结果的峰图,清晰且有明显双峰的位点,即为潜在的SNP 位点。
1.2.5 荧光定量PCR 法(qPCR)验证及位点分型
通过qPCR 生长曲线和熔解曲线的结果进行SNP分型,参考单志新等(2005)基于荧光定量PCR 扩增反应的SNP 测定方法,在2 条特异性引物的3ʹ端倒数第3 位引入错配的碱基。根据潜在的SNP 位点设计特异性引物,随机抽取的12 个DNA 样品作为模板进行定量PCR 反应,验证特异性引物是否有效扩增,可以用于分型的特异性引物见表2。

表1 普通PCR 引物设计Tab.1 List of common PCR primers
PCR 体系总体积10 μl:酶5 μl,Dye2 为0.2 μl,模板 DNA 4 μl (30 ng/μl),上下游引物各 0.4 μl(10 μmol/L)。反应程序:95℃ 30 s;95℃ 5 s,60℃35 s,72℃ 40 s,共40 个循环;95℃ 15 min,60℃ 1 h,95℃ 15 min。qPCR 引物验证,以P2 (T206G)点为例,由熔解曲线(图1)可知峰图单一,没有其他杂峰,可判定P2 的特异性引物组可以进行有效扩增。用此标准验证其余组特异性引物。由产物的Ct值大小(图2)来判断位点的基因型,当二者Ct差值大时,Ct小的即为SNP 特异性引物对应碱基的纯合,当二者Ct接近或差值小于3 时即为杂合子。红色和黄色的生长曲线分别为特异性引物P2m、P2w 分别与P2r 组合的结果见图2,对应基因型分别为TT、GG 和GT。成功分型的特异性引物组信息见表2。用敏感组和抗性组各48 个样品进行SNP 位点的定量分型。
1.2.6 SNPs 位点的多样性分析及与耐高pH 性状的关联分析 根据SNPs 位点的分型结果,统计各基因型频率和基因频率,以PopGene 32(Ver 1.31)和PIC-Calc 0.6 软件计算观测杂合度(Ho)、期望杂合度(He)、最小等位基因频率(MAF)、有效等位基因数(Ne)和哈迪–温伯格平衡(Hardy-Weinberg equilibrium,HWE)等遗传多样性的指标,根据Botstein 等(1980)划分的原则,低度多态性 PIC<0.25,中度多态性0.25<PIC<0.50,高度多态性PIC>0.50。利用SPSS 17.0对分型结果进行卡方检验,P<0.05 为差异显著,P<0.01 为差异极显著。
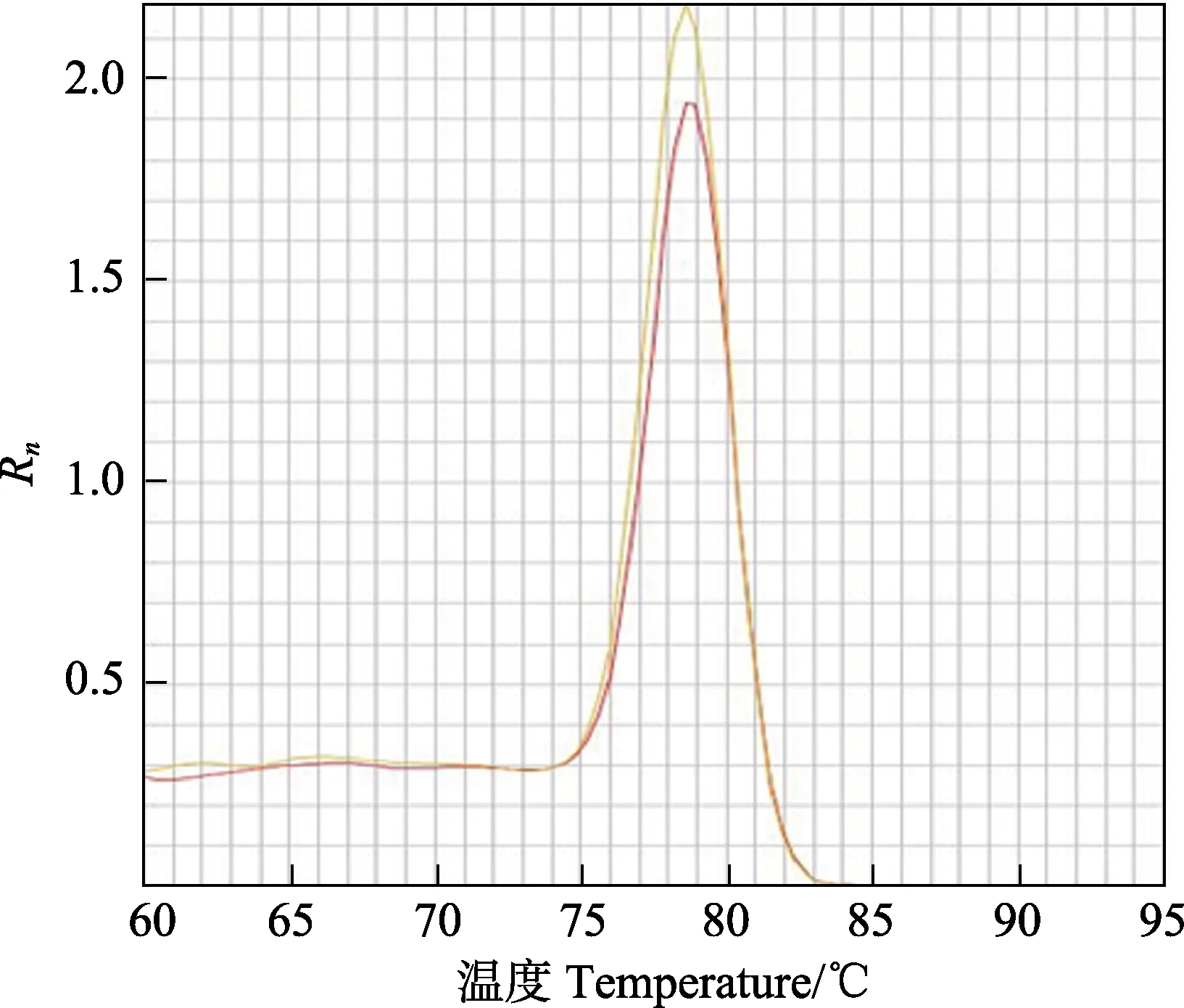
图1 FcNAGase 的P2(T206G)位点的熔解曲线Fig.1 Melting curve plots of FcNAGase P2(T206G)
2 结果
2.1 基因组DNA 提取结果
敏感组和抗性组各48 个样品提取DNA,电泳结果如图3 所示,主带清晰、完整,无杂带及拖带现象,满足后续实验要求。
2.2 SNP 位点的初步筛选
利用混合模板进行普通PCR 扩增,共扩增出6条条带(图4),条带明亮,其中,条带2 与预期产物长度相同,其余5 个扩增产物均超出预期的产物长度。将PCR 产物及所对应的引物送生工生物工程(上海)测序。

表2 荧光定量PCR 引物设计(特异性引物)Tab.2 Primers for real-time PCR (specific primer)
图3 中国对虾基因组DNA 电泳图谱Fig.3 Gel electrophoresis of F. chinensis genome DNA
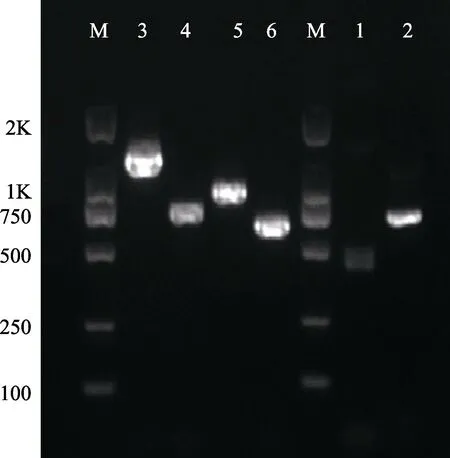
图4 PCR 产物的电泳图谱Fig.4 Gel electrophoresis of PCR products
将测序结果利用ContigExpress 软件进行拼接,FcNAGase 的开放阅读框(ORF)的DNA 序列全长为2544 bp,包含5 个外显子和4 个内含子。且外显子和内含子边界都符合GT-AG 原则。由Gene Structure Display Server 2.0 (http://gsds.cbi.pku.edu.cn/)绘制关于外显子–内含子的具体位置(图5)。
根据测序结果的峰图,将出现双峰的位点作为初步筛选SNP 位点的依据,共筛到29 个潜在的SNP位点。以No.2 引物的产物为例,截取反向测序结果的峰图,图中箭头标出的对应位点是P2,从测序结果看出,峰图清晰,无杂峰(图6)。
根据测序峰图及拼接结果可知,共筛选到29 个潜在的SNP 位点,其中,20 个为外显子突变,9 个为内含子突变,SNP 位点分布频率为1.13/100 bp,其中,内含子的突变频率为0.35/100 bp,外显子的突变频率为0.78/100 bp。
2.3 qPCR 分型结果
对29 个潜在的SNP 位点用特异性引物进行荧光定量PCR 分型,有14 个SNP 位点分型成功,具体信息见表3。外显子区域中的突变存在2 个错义突变,分别为P2 位点由Ser(丝氨酸)突变为Ala(丙氨酸),P9 位点由Phe(苯丙氨酸)突变为Leu(亮氨酸),其余外显子上的位点均为同义突变。
2.4 FcNAGase 的SNP 位点多态性分析
FcNAGase 的14 个SNP 标记的多态性分析结果见表4。观测杂合度(Ho)为0.1981~0.939,期望杂合度(He)为 0.0595~0.499,多态信息含量(PIC)为0.0574~0.3731;哈迪–温伯格平衡检验(HWE)结果表明,P21、P27 和P29 位点极显著(P<0.01)偏离哈迪–温伯格平衡,其余11 个SNP 位点均符合哈迪–温伯格平衡。其中,P9、P14 和P18 位点为低度多态性,其余11 个SNP 位点为中度多态性,从多态性参数上能够看出,选用的中国对虾人工选育群体“黄海3 号”的遗传多样性较为丰富,可进行后续的关联性分析。

图5 FcNAGase 基因全长Fig.5 Nucleotide sequence of FcNAGase
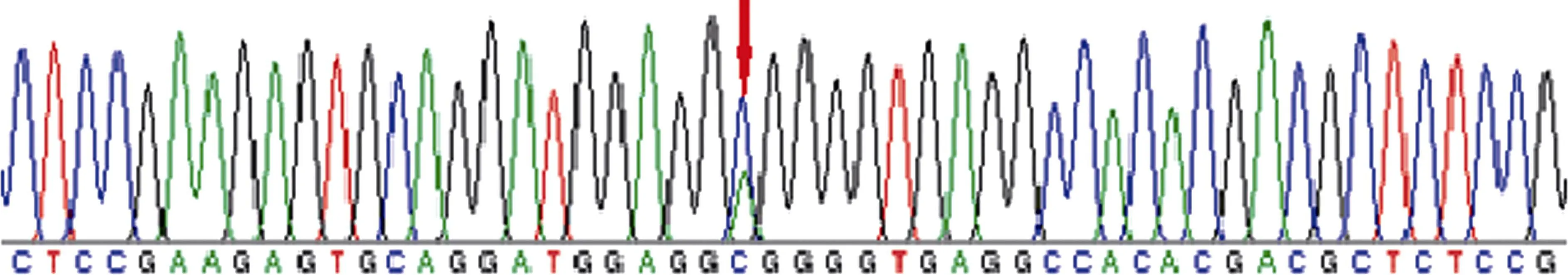
图6 引物No.2 反向测序结果(部分)Fig.6 Primer No.2 reverse sequencing results (partial)
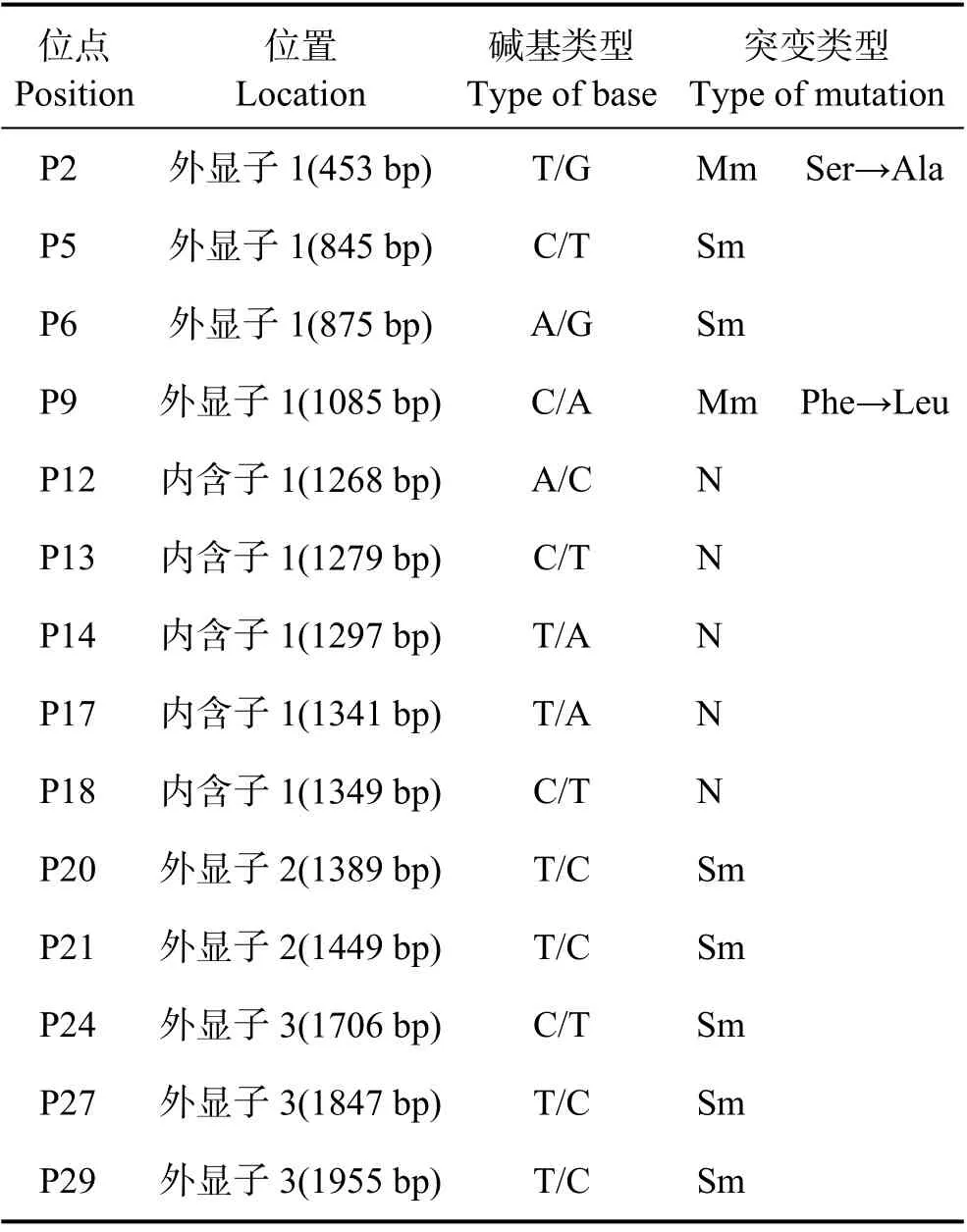
表3 SNP 位点的具体信息Tab.3 SNP site specific information
2.5 FcNAGase 的SNP 位点与耐高pH 性状的关联分析
利用SPSS 进行卡方检验,分析14 个SNP 位点的基因分型结果与耐高pH 性状之间的关联性,结果见表5。有的样品数少于48 个,由实验误差引起,在众多样品中所占比例较小,不影响数据分析。卡方检验结果表明,P12 和P27 位点与中国对虾耐高pH 性状相关(P<0.05);P21 和P29 位点与中国对虾耐高pH 性状无显著关系,但这2 个位点偏离哈迪–温伯格平衡,表明在中国对虾“黄海3 号”选育群体中受到了选择。
3 讨论
本研究基于高pH 胁迫的中国对虾的转录组数据库,筛选出响应高pH 胁迫的NAGase 基因,通过直接测序法获得了FcNAGase 的开放阅读框(ORF),全长为2544 bp,由5 个外显子和4 个内含子组成,与脊尾白虾EcNAG (Sun et al, 2018) 5 个外显子和4 个内含子的结果一致。本研究首次在中国对虾中应用荧光定量法进行位点分型的方法,成功得到14 个SNP位点的基因型,约占潜在位点的50%,推测剩余位点未分型成功的原因:一是相邻2 个SNP 位点位置距离近,影响特异性引物的设计;二是人为引入的错配碱基,提高了引物的特异性,可降低SNP 位点分型的假阳性,但也会因为特异性太高,使得引物不能成功扩增出特异条带,导致位点不能成功分型,所以该方法并不是对所有的SNP 位点都能适用。但是,该方法简单快速,约1 h 即可完成48 个DNA 样品的分型,仅需要根据Ct值的大小即可判断分型结果。
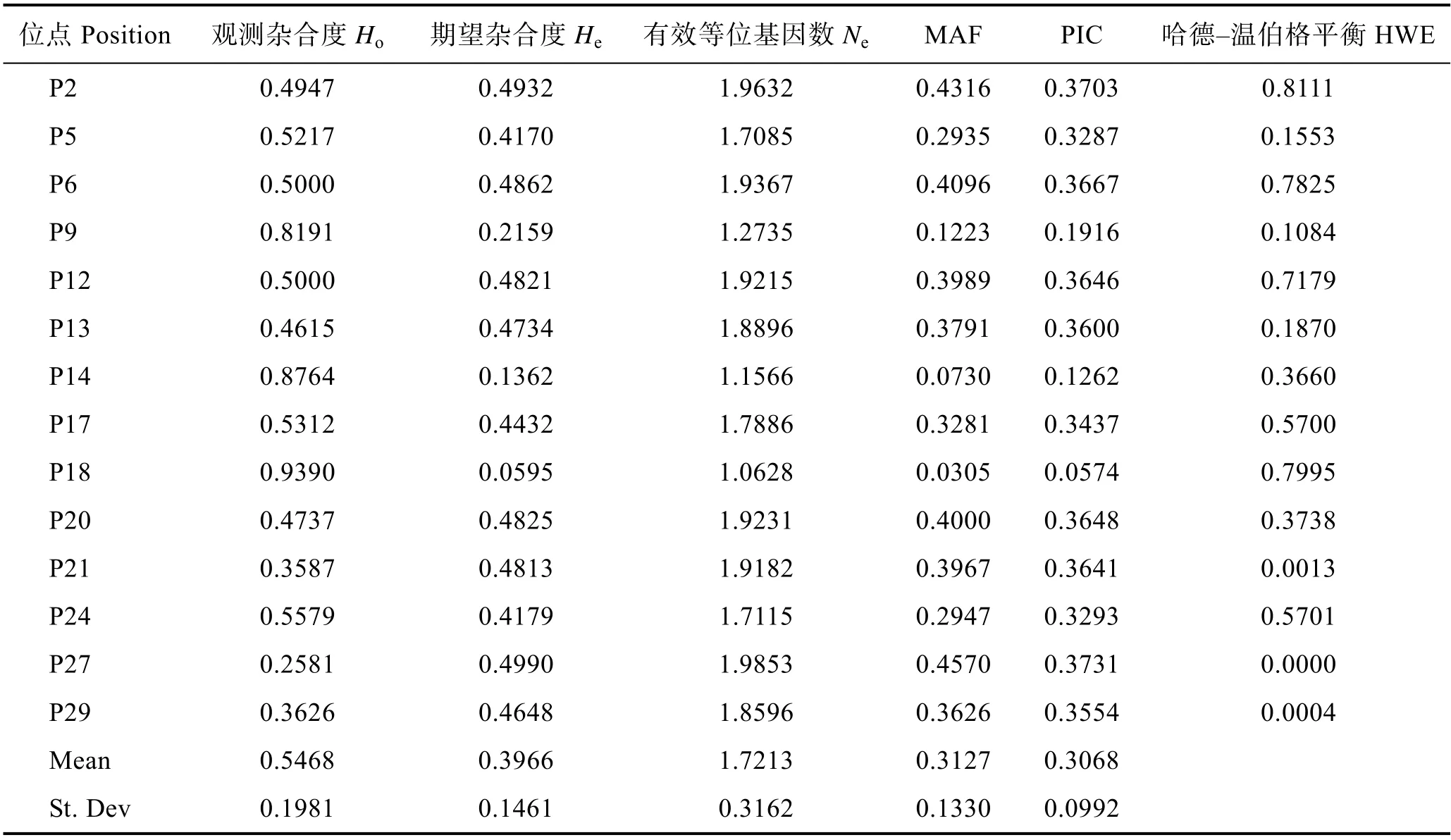
表4 SNP 位点基因多态性分析Tab.4 The analysis of gene polymorphism of SNPs
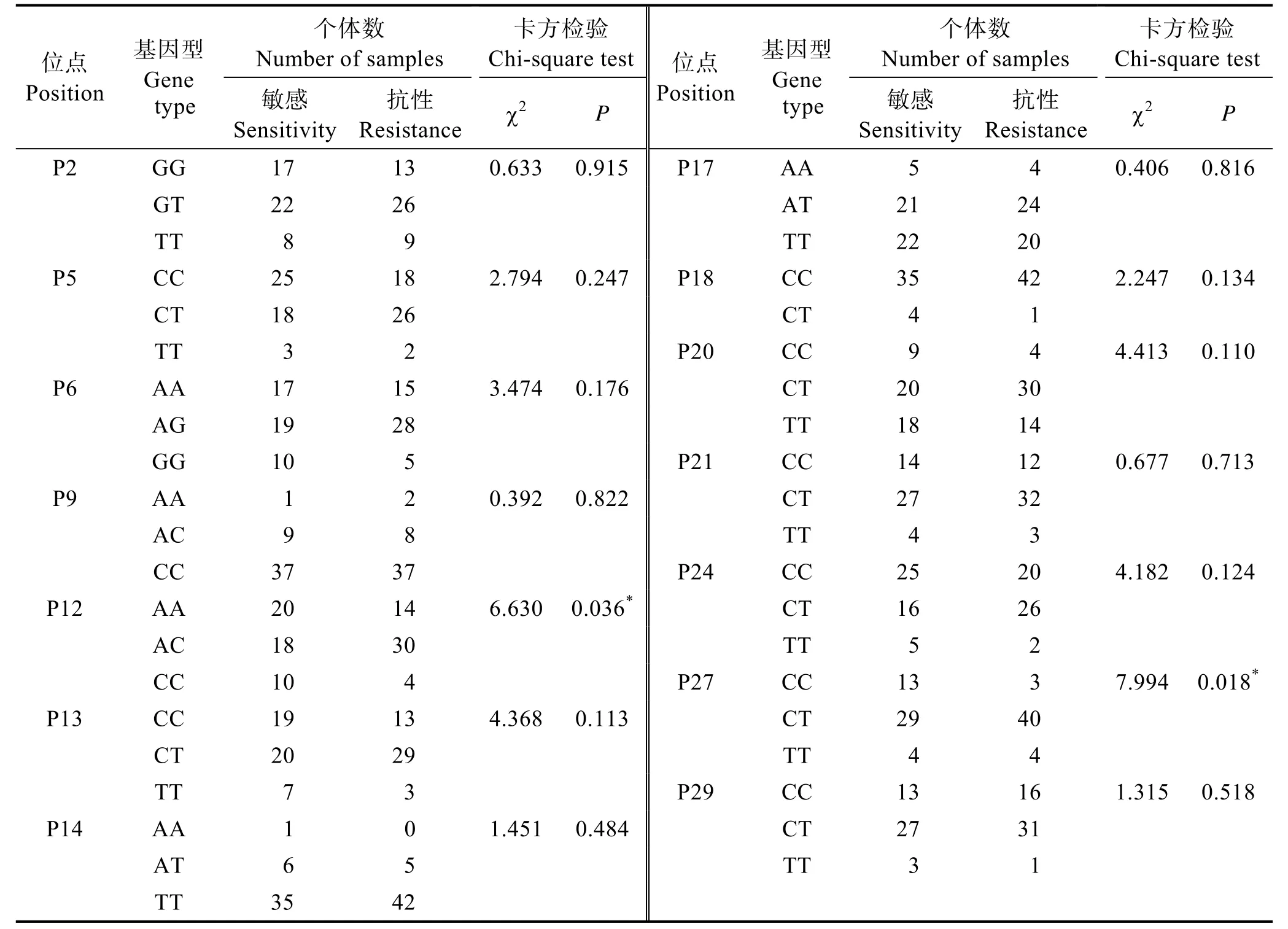
表5 SNP 位点与耐高pH 性状的关联分析Tab.5 The correlation analysis of SNP loci with anti-high pH traits
分型成功的14 个SNP 位点与耐高pH 性状的关联性分析显示,位点P12 与P27 存在显著相关性(P<0.05)。P21 和P29 极显著偏离哈迪–温伯格平衡(P<0.01)。可能的原因,一是中国对虾“黄海3 号”是经过人工多代选育的品种,会影响碱基频率;二是进行高pH 胁迫实验的400 尾对虾,根据死亡时间划分敏感组和抗性组,提取DNA 的样品是分层的,因此不符合哈迪–温伯格平衡。P21 位于外显子2,P27 和P29 位于外显子3,均属于同义突变。同义突变并没有在翻译过程中改变氨基酸的种类,但会以其他方式影响蛋白质的翻译过程,如:在mRNA 的水平上影响增强子的功能,引起周边外显子剪切出现跳跃或者移码,使得蛋白质序列缩短(杨军等, 2017),以及蛋白质二级结构的改变(Shen et al, 1999),mRNA 翻译速度的调整(Komar, 2007)等。P2 位点是丝氨酸(Ser)与丙氨酸(Ala) 2 种氨基酸的改变,Ser 是极性不带电荷的氨基酸,Ala 是非极性氨基酸,会影响亲水性,导致蛋白质水溶性发生改变,具体对中国对虾耐高pH 性状的影响还需要进一步研究;P9 位点是苯丙氨酸(Phe)与亮氨酸(Leu) 2 种氨基酸的改变,Phe 与Leu均为非极性氨基酸,对NAGase 蛋白的三维构造不会产生很大影响,从而不会对蛋白相应功能产生很大改变。
pH 作为影响对虾生长的重要非生物因子之一,pH 值异常会严重影响对虾的体内细胞及整体水平上的pH 平衡和相关离子的稳态(胡硕等, 2019),培育高pH 耐受性的对虾新品种是解决这一问题最直接的手段。陈华增等(2011)筛选得到中国对虾耐高pH 负相关2 个SRAP 标记,正相关5 个SRAP 标记。SRAP是将序列特征性片段进行扩增,SNP 标记与SRAP 标记相比,出现频率高,多态性丰富,操作流程简单,可进行大批量样品的筛选。可以利用SNP 位点的多态性,筛选与抗逆性状关联的SNP 标记:李西雷等(2012)研究三角帆蚌(Hyriousis cumingii)的GPX基因筛选得到8 个SNP 位点与抗病性状存在显著性差异;薛宝宝等(2019)研究缢蛏(Sinonovacula constricta)的HSP70 基因,3 个SNP 位点可作为耐高温遗传育种的候选分子标记。本研究获得2 个耐高pH 性状的分子标记。
耐高pH 性状是由多基因调控的数量性状,可以结合中国对虾高pH 转录组中其余组分的数据结果,如:差异表达量、GO 分类、COG 分类注释和代谢通路注释(KEGG pathway)等(周贺等, 2014),继续进行耐高pH 性状的SNP 位点标记的筛选工作。本研究中,与中国对虾耐高pH 的显著相关的P12 和P27 标记需要在不同遗传背景群体中验证;有关FcNAGase 的启动子区也可以再进一步扩增加以研究,例如甲基化、SNP 位点的筛选等,以期作为重要的分子标记在中国对虾耐高pH 性状分子标记辅助育种中发挥作用,结果有助于中国对虾耐高pH 育种提供理论依据和资料。

