饲料用玉米和小麦麸皮中伏马毒素含量的测定
杨亚琴 冯慧慧 刘进玺 马 莹 董小海 曹 秀 钟红舰
(河南省农业科学院农业质量标准与检测技术研究所,农业农村部农产品质量安全风险评估实验室(郑州),河南郑州450002)
伏马毒素(Fumonisin)是20 世纪80 年代末发现的一类主要由串珠镰刀菌、多育镰刀菌和轮状镰刀菌在一定温度和湿度条件下产生的水溶性次级代谢物,是由不同多氢醇和丙三羧酸组成的结构类似的双酯化合物[1-2]。已发现的28种伏马毒素类似物中,B族伏马毒素是野生型菌株产量最丰富的,主要以伏马毒素B1(FB1)、伏马毒素B2(FB2)、伏马毒素B3(FB3)形式存在。研究表明,伏马毒素具有很强的神经毒性、肺毒性、免疫毒性和致癌性等[3~5],世界卫生组织(WHO)癌症研究机构(IARC)于1993 年就已将其划为2B 类致癌物。伏马毒素普遍存在于玉米、小麦、水稻等谷类作物中,而谷类作物及其制品作为饲料的重要来源,致使伏马毒素成为污染饲料的主要真菌毒素之一,对动物和人类健康均产生潜在危害[6-8]。目前,我国对饲料原料玉米及其加工产品中FB1 和FB2 总量的限量值为60 mg/kg;饲料产品猪、兔、马配合饲料中FB1 和FB2总量的限量值为5 mg/kg,家禽配合饲料限量值为20 mg/kg,鱼配合饲料限量值为10 mg/kg;而小麦及其制品中伏马毒素的限量则未做明确规定[9]。
伏马毒素的常用分析方法有酶联免疫法[10]、气相色谱法[11]、液相色谱法[12~14]、液相色谱-串联质谱法[15-16]等。其中,酶联免疫法操作简单、快速,但其准确度较低;气相色谱法一般需要前处理过程中对目标化合物进行衍生化反应,方法稳定性较差;液相色谱法通常采用柱前或柱后衍生的方法进行测定,样品提取液多采用免疫亲和柱进行净化,分析成本偏高;而液相色谱-串联质谱法因其选择性好、抗干扰能力强、灵敏度高等特点,已成为近年来谷类作物中真菌毒素测定的主要研究方法[17-19]。本研究选取饲料用玉米和小麦麸皮为对象,针对样品基质的特点,采用分散固相萃取净化管和PRIME HLB固相萃取柱有效去除玉米和小麦麸皮样品中碳水化合物、蛋白质、磷脂、植物纤维等干扰物,用液相色谱-串联质谱仪准确进行FB1、FB2和FB3的定性定量分析。该方法操作便捷,净化效果好,回收率和灵敏度高,适用于玉米和小麦麸皮样品中伏马毒素的批量检测分析,易于在农产品和饲料分析检测领域推广应用。
1 材料与方法
1.1 仪器与试剂
Shimadzu LCMS-8050 型液相色谱-串联质谱仪(日本岛津公司);PGC 4502i电子天平[精确至0.01 g,英国艾德姆衡器(武汉)有限公司];HY-6型双层摇瓶机(金坛市医疗仪器厂);飞鸽GL-21B型高速冷冻离心机(上海安亭科学仪器厂);QGC-36T氮气吹干仪(上海泉岛公司);SKQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);SK-1快速混匀器(金坛市白塔新宝仪器厂);Milli-Q超纯水发生器(美国Millipore公司)。
伏马毒素(FB1、FB2、FB3)标准溶液(50 μg/mL)(青岛普瑞邦生物工程有限公司);甲醇、乙腈:色谱纯(德国默克股份两合公司);甲酸:分析纯(国药集团化学试剂有限公司);分散固相萃取净化管(含500 mg五水硫酸镁、250 mg 氯化钠、250 mg 柠檬酸三钠和250 mg C18)(吴桥津杨过滤器材厂);PRIME HLB 固相萃取柱(60 mg/3 mL)(美国Waters公司);实验室用水为Milli-Q超纯水;玉米与小麦麸皮样品,市售。
1.2 样品前处理
称取5 g粉碎后的样品,放入50 mL具塞塑料离心管中,加入15 mL水浸泡1 h,加入15 mL 2%甲酸乙腈溶液,充分混匀1 min,室温下超声提取10 min、振荡提取30 min,然后于5 000 r/min离心5 min。
取5 mL提取液至分散固相萃取净化管,涡旋2 min,于5 000 r/min离心5 min,准确吸取上层清液2 mL,40 ℃氮吹至干,用1 mL甲醇超声复溶,过经0.5 mL甲醇润湿后的PRIME HLB固相萃取柱净化,收集流出液,相同体积加水混匀后,过0.22 μm微孔滤膜待上机测定。
1.3 液相色谱-串联质谱条件
色谱柱,Waters CORTECS UPLC C18柱(50 mm×2.1 mm, 1.6 μm);柱温:40 ℃;进样体积:1 μL;流动相A:甲醇;流动相B:含5 mmol/L乙酸铵的0.1%甲酸水溶液,梯度洗脱程序:0~1 min,10% A;1~2 min,10%~38% A;2~5 min,38%~45% A;5~10 min,45%~90% A;10~11 min,90% A;11~11.5 min,90%~10%A;11.5~16 min,10% A;流速为0.3 mL/min。
电喷雾离子源,正离子模式(ESI+);扫描方式:多反应监测(MRM);离子化电压:4 kV;雾化气流速3 L/min;干燥气流速10 L/min;加热气流速10 L/min;脱溶剂管温度250 ℃;接口温度300 ℃;加热模块温度400 ℃;碰撞诱导电离气体压力270 kPa;质谱采集参数见表1。
2 结果与分析
2.1 质谱条件优化(见表1)
试验采用电喷雾离子源正离子模式(ESI+)扫描分析3种伏马毒素化合物。通过对质量浓度为500 ng/mL的3种化合物标准溶液分别进行全扫描得到[M+H]+前体离子,再对前体离子进行二级质谱扫描,通过优化条件得到产物离子及相应的电压、碰撞能量等参数,使每种化合物的前体离子与特征产物离子产生的离子对强度达到最大,选择其中相对丰度最强的产物离子作为定量离子,优化后的参数见表1。
2.2 色谱条件优化(见图1)
采用质量浓度为50 ng/mL的溶剂混合标准溶液,保持其他仪器条件不变,比较了甲醇-水、甲醇-0.1%甲酸水溶液、甲醇-含5 mmol/L乙酸铵的0.1%甲酸水溶液3种流动相体系在相同液相分离程序下,目标化合物的出峰情况。通过对比,使用甲醇-含5 mmol/L乙酸铵的0.1%甲酸水溶液流动相体系产生的峰形要优于使用甲醇-水、甲醇-0.1%甲酸水溶液流动相体系产生的峰形。伏马毒素在电喷雾离子源正离子模式(ESI+)下产生的是[M+H]+离子,在甲醇和水体系中添加容易挥发的甲酸有助于伏马毒素的离子化,适量乙酸铵的加入能有效地改善伏马毒素的峰形。因此,试验最终采用甲醇-含5 mmol/L 乙酸铵的0.1%甲酸水溶液作为流动相,在1.3 试验梯度洗脱程序条件下,3 种伏马毒素化合物的分离效果良好,色谱图峰形对称且灵敏度高,如图1所示。
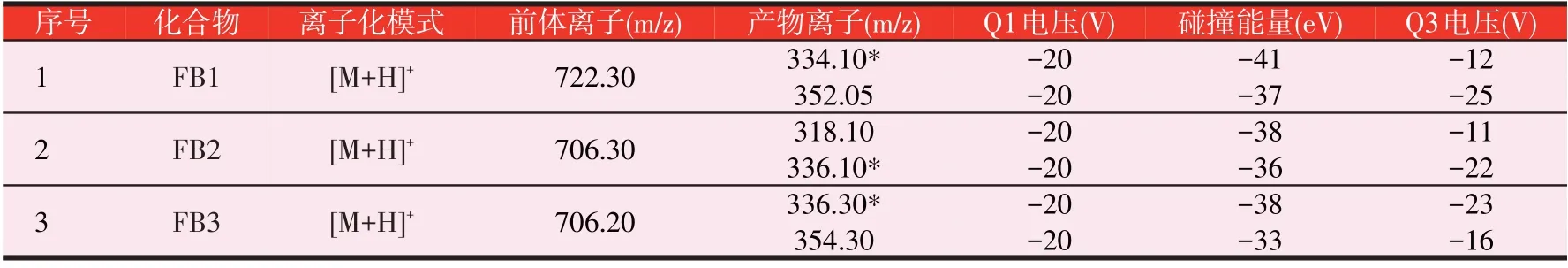
表1 FB1、FB2、FB3的质谱参数
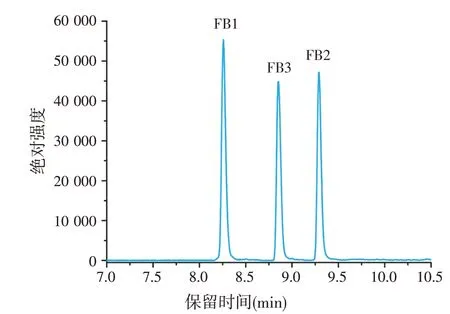
图1 FB1、FB2、FB3混合标准溶液(50 ng/mL)色谱
2.3 提取溶剂的选择(见图2)
乙腈-水混合提取液在过量氯化钠等无机盐存在时,根据盐析效应乙腈和水发生两相分离,水溶性杂质溶于水相、目标化合物溶于乙腈相,以达到初步分离净化的目的。本试验在相同空白基质样品中添加3 种伏马毒素(添加浓度为100 μg/kg),考察了经水浸泡后,相同体积乙腈、0.5%甲酸乙腈、2%甲酸乙腈3种提取溶剂对玉米和小麦麸皮样品中的伏马毒素目标化合物的提取效果。按照1.2 前处理步骤,样品提取液经分散固相萃取净化管净化后,吸取上层乙腈相吹干,甲醇复溶直接过PRIME HLB固相萃取柱,去除玉米和小麦麸皮样品中的蛋白质、磷脂等干扰物,相同体积加水混匀后上机。测定结果表明,随着水-乙腈溶液中甲酸含量的增加,玉米和小麦麸皮样品中伏马毒素的回收率均呈现上升趋势,如图2。因此,本试验最终选择水-2%甲酸乙腈(50∶50,V/V)作为样品中伏马毒素测定的提取溶剂。

图2 不同提取溶剂对玉米(上)和小麦麸皮(下)中3种伏马毒素(添加浓度100 μg/kg)回收率的影响
2.4 线性范围、检出限及定量限(见图3、表2)
取适量的伏马毒素(FB1、FB2、FB3)标准溶液,分别用空白玉米和小麦麸皮样品基质溶液配制成质量浓度分别为1.0、2.5、5.0、10、25、50、100、250 ng/mL的系列混合标准工作溶液。以质量浓度为横坐标(X,ng/mL),目标物定量离子对的峰面积为纵坐标(Y)绘制基质标准曲线(见图3)。结果表明,玉米基质溶液中,3 种伏马毒素目标物在1.0~250 ng/mL 浓度范围内呈现良好的线性,FB1、FB2、FB3 的相关系数(R2)分别为0.999 2、0.999 3、0.999 2;小麦麸皮基质溶液中,3种伏马毒素目标物在1.0~250 ng/mL浓度范围内,线性关系亦表现良好,FB1、FB2、FB3 的相关系数(R2)分别为0.999 6、0.999 1、0.999 3(见表2)。由于不同基质溶液中,3 种伏马毒素在相同浓度下的信号响应差异明显,在进行实际样品含量测定时,要选择相同基质的基质标准曲线准确定量评价。当阳性样品中目标物的上机浓度大于此线性范围上限时,应采取减小称样量或对目标分析物进行稀释处理后重新进行测定。
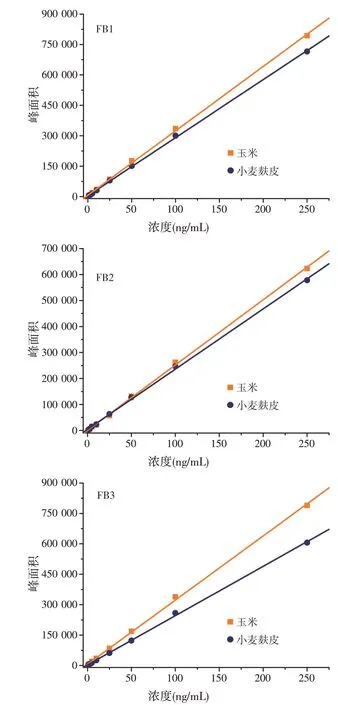
图3 3种伏马毒素的玉米和小麦麸皮基质溶液标准曲线
采用向空白玉米和小麦麸皮样品中逐级降低加入标液浓度的方法来确定检出限(LOD)和定量限(LOQ)。以3 倍信噪比(S/N=3)对应的目标物浓度作为检出限,以10倍信噪比(S/N=10)对应的目标物浓度作为定量限,3种伏马毒素在玉米和小麦麸皮样品中的方法检出限均为1.0 μg/kg,方法定量限均为3.0 μg/kg,满足饲料中伏马毒素的分析要求[20]。
2.5 方法回收率与精密度(见表3)
在确定的试验条件下,分别向空白玉米和小麦麸皮样品中添加FB1、FB2、FB3混合标准溶液至3.0、20、100 μg/kg 3个浓度水平,每个添加浓度水平重复3次,进行方法回收率与精密度测定(表3)。3种伏马毒素在玉米基质中3 个添加浓度水平的回收率范围在83.65%~107.3%,相对标准偏差RSD 范围在2.03%~7.00%;在小麦麸皮基质中3 个添加浓度水平的回收率范围在88.79%~103.5%,RSD范围在1.41%~8.98%,表明方法准确可靠,重复性良好。
2.6 实际样品检测
应用本研究所建立的测定方法对当地市场上购买的15个玉米、15个小麦麸皮样品中FB1、FB2和FB3进行了检测。结果显示,玉米样品中3种伏马毒素均全部检出,以总量计,其含量水平范围在266~5 830 μg/kg。小麦麸皮样品中FB1 检出7 个、FB2 检出4 个、FB3 检出5 个,伏马毒素总检出率为46.67%,检出样品中伏马毒素总量的污染水平范围在13.9~170 μg/kg。参考我国饲料产品中FB1 和FB2 总量的限量值范围(5~60 mg/kg)[9],除1 个玉米样品伏马毒素总量5.83 mg/kg超出饲料产品最低限量值外,其余29 个检测样品均满足饲料标准的限量要求。
3 讨论
本研究在参考文献的基础上,通过对仪器条件、提取溶剂的选择与优化,确定了饲料用玉米和小麦麸皮中伏马毒素的液相色谱-串联质谱检测方法。样品经水-2%甲酸乙腈(50∶50,V/V)提取,分散固相萃取净化管盐析效应下去除提取液中的水溶性杂质,上层乙腈提取液用甲醇进行溶剂转换后,过PRIME HLB固相萃取柱以除去蛋白质、磷脂等干扰物,流出液同体积加水混匀后采用液相色谱-串联质谱仪进行分析,基质标准曲线外标法定量。相较于国家标准的检测方法[15,20],该方法减少了操作步骤和有机溶剂的使用,重现性好、灵敏度高,完全符合我国对饲料中伏马毒素含量的检测要求,且方法检测效率高,适合批量样品的处理与分析。
4 结论
本研究采用液相色谱-串联质谱仪建立了饲料用玉米和小麦麸皮中3种伏马毒素的测定方法。结果显示,该方法中伏马毒素(FB1、FB2 和FB3)的检出限均为1.0 μg/kg,定量限均为3.0 μg/kg,在3.0、20、100 μg/kg 3个添加浓度水平下,玉米和小麦麸皮样品平均回收率在83.65%~107.3%之间,RSD在1.41%~8.98%之间,能够满足饲料用玉米和小麦麸皮中伏马毒素的检测要求,亦可为其他饲料基质中伏马毒素含量的测定提供参考。
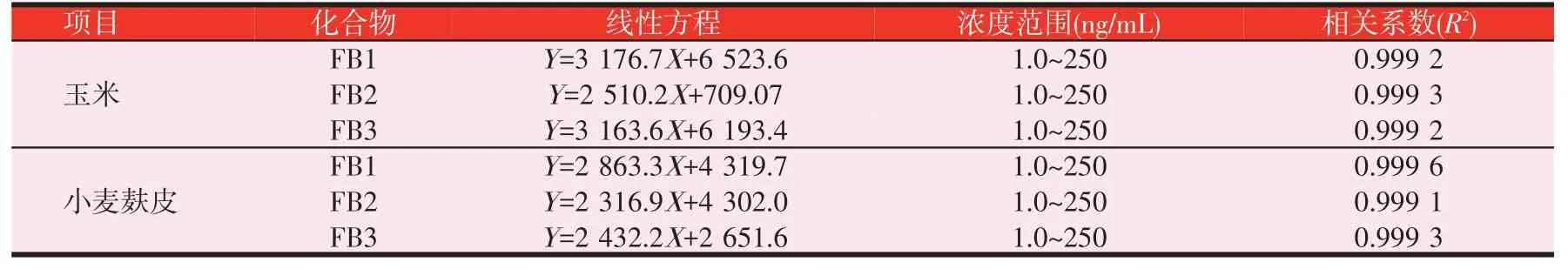
表2 玉米和小麦麸皮基质溶液中3种伏马毒素的线性方程、浓度范围及相关系数

表3 玉米和小麦麸皮中3种伏马毒素的回收率和相对标准偏差(n=3)

