黄绵马酸BB对皮肤软组织感染致病菌的抗菌活性及机制研究
殷川平,陈文浩,莫梓童,吴小诗,唐春萍, 2,沈志滨, 2, 3*
黄绵马酸BB对皮肤软组织感染致病菌的抗菌活性及机制研究
殷川平1,陈文浩1,莫梓童1,吴小诗1,唐春萍1, 2,沈志滨1, 2, 3*
1. 广东药科大学中药学院,广东 广州 511400 2. 广东省局部精准药物递药制剂工程技术研究中心,广东 广州 510006 3. 广东省化妆品工程技术研究中心,广东 广州 510006
研究黄绵马酸BB对皮肤软组织感染致病菌的抗菌活性,并探讨其对金黄色葡萄球菌的抗菌机制。采用微量稀释法测定黄绵马酸BB对皮肤软组织感染相关致病菌的最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC);以对黄绵马酸BB敏感的耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)临床分离株和金黄色葡萄球菌标准株ATCC29213为受试菌,考察黄绵马酸BB对其生长活力和菌体形态结构的影响,采用酶标仪考察黄绵马酸BB对其细胞壁通透性的影响,采用荧光分光光度计考察黄绵马酸BB对细胞膜电位的影响,采用qRT-PCR法考察黄绵马酸BB对青霉素结合蛋白1(penicillin-binding protein 1,)mRNA表达的影响。黄绵马酸BB对ATCC29213的MIC为10.0~20.0 µg/mL,MBC为10.0~40.0 µg/mL,且对MRSA临床分离株的MIC小于头孢唑啉;与对照组比较,黄绵马酸BB组ATCC29213和MRSA生长受到抑制,菌体细胞形态结构改变,细胞膜电位显著降低(<0.05),1/2MIC黄绵马酸BB可显著下调mRNA表达水平(<0.01),2MIC黄绵马酸BB可显著上调mRNA表达水平(<0.01)。黄绵马酸BB对MRSA临床分离株表现出良好的抗菌活性,且其抗菌作用与破坏菌体细胞结构、降低细胞膜电位、影响mRNA表达有关。
黄绵马酸BB;耐甲氧西林金黄色葡萄球菌;细胞膜电位;抗菌;青霉素结合蛋白1
皮肤软组织感染(skin and soft tissue infection,SSTI)是由病原菌侵犯皮肤表皮、真皮及皮下组织等引起的常见感染性疾病,可诱发菌血症、败血症,危及患者生命[1-2]。金黄色葡萄球菌和大肠埃希菌为引起SSTI的主要致病菌[3]。在金黄色葡萄球菌引起的SSTI患者中,耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)的检出率高达73.21%[4]。随着抗生素的广泛应用,SSTI致病菌对临床中的常用药物如头孢唑林、达托霉素均出现了不同程度的耐药性[5-6],且万古霉素对MRSA的敏感性逐渐降低[7],万古霉素中介耐药的金黄色葡萄球菌检出率逐渐升高[8]。因此,从传统中药中寻找对耐药菌株具有较好抗菌活性的化合物迫在眉睫。
香鳞毛蕨(L.) Schott为鳞毛蕨科鳞毛蕨属植物,主要分布于黑龙江省五大连池等地区,常用于治疗牛皮癣、痤疮等病菌感染性皮肤病[9-10]。香鳞毛蕨中的间苯三酚类化合物具有良好的抗菌活性[11],黄绵马酸BB作为其中的典型间苯三酚类化合物,其抗菌活性及机制尚未明确。本研究探究黄绵马酸BB对SSTI相关致病菌的抗菌活性及机制,为抗SSTI药物开发提供依据。
1 材料
1.1 菌株
金黄色葡萄球菌标准株ATCC29213购自广东省菌种保存中心;大肠埃希菌标准株ATCC8739由广东药科大学基础学院提供;3株MRSA(MRSA1~3)临床分离株及3株大肠埃希菌临床分离株由广州医科大学呼吸病研究所提供。
1.2 药品与试剂
黄绵马酸BB(质量分数>95%)由课题组自制;头孢唑啉(批号N0825A)购自深圳华润九新药业有限公司;万古霉素(质量分数>97%)购自美国Sigma公司;达托霉素、尼生素(质量分数>97%)购自大连美仑生物技术有限公司;PBS缓冲液(批号AXH44026)购自HyClone公司;二甲基亚砜(DMSO,批号DH105-2)购自鼎国昌盛生物技术有限公司;Gluta固定液(批号L17D11G134782)购自源叶生物科技有限公司;CAMHB营养肉汤培养基(批号3302092)、营养琼脂培养基(批号1067752)购自广东环凯微生物科技有限公司;细胞膜荧光探针DiSC3-5购自阿拉丁生化科技股份有限公司;碱性磷酸酶(alkaline phosphatase,AKP)测试盒购自南京建成生物工程有限公司;RNA提取试剂盒购自北京天恩泽基因科技有限公司;PrimeScript™RT reagent Kit with gDNA Eraser、SYBR®Premix Ex Taq™II(Tli RNaseH Plus)购自宝生物工程(大连)有限公司。
1.3 仪器
iMark酶标仪、IQ5荧光定量PCR仪(美国BIO-RAD公司);SW-CJ-1F超净工作台(苏净集团安泰公司);Memmert恒温培养箱(上海一恒科学仪器有限公司);H-7500透射电子显微镜(TEM,日本Hitachi公司);RF-5301PC荧光分光光度计(日本岛津公司)。
2 方法
2.1 菌液制备
将上述菌株用营养琼脂培养基培养至对数生长期,根据美国临床实验室标准协会(clinical and laboratory standards institute,CLSI)制定的M07-A9方案中微量稀释法,将对数生长期的菌落用生理盐水稀释,调节至0.5个麦氏浊度(1×108CFU/mL),用CAMHB营养肉汤培养基稀释100倍(1×106CFU/mL)作为接种菌液。
2.2 药液制备
黄绵马酸BB溶于DMSO配制成质量浓度为16 mg/mL的贮备液;头孢唑林、万古霉素和达托霉素分别溶于超纯水配制成质量浓度为256 mg/mL的贮备液,于4 ℃避光保存。
2.3 黄绵马酸BB对SSTI相关致病菌的抗菌活性测定
根据CLSI的M07-A9方案,采用微量稀释法测定黄绵马酸BB和阳性对照药物(头孢唑林、万古霉素、达托霉素)的最小抑菌浓度(minimum inhibitory concentration,MIC)。用CAMHB营养肉汤培养基将药物贮备液进行稀释,取100 μL药物贮备液加入96孔板中,再加入100 μL菌液,使黄绵马酸BB的终质量浓度为2.5~1 280.0 μg/mL,头孢唑林的终质量浓度为0.625~5 120.000 μg/mL,万古霉素和达托霉素的终质量浓度为0.25~32.00 μg/mL,对照组只加入菌液不加入药液。测定MIC后,选择质量浓度≥MIC的菌悬液,吸取20 µL涂于固体培养基上,于37 ℃恒温培养箱中培养18~24 h后肉眼观察,以无细菌生长的最低药物浓度作为最低杀菌浓度(minimum bactericidal concentration,MBC)。
2.4 黄绵马酸BB对ATCC29213和MRSA1的时间-杀菌曲线的测定
根据抗菌活性结果,选用对黄绵马酸BB敏感的ATCC29213和MRSA1作为受试菌,测定黄绵马酸BB对其生长的影响。设置对照组及黄绵马酸BB(1/2MIC、MIC、2MIC)组,各给药组加入含相应药物的菌液,对照组只加入菌液不加入药液,于37 ℃振荡培养,每2小时采用酶标仪测定24 h内600 nm处的吸光度()值。以时间为横坐标,以值为纵坐标,绘制时间-杀菌曲线。
2.5 TEM观察黄绵马酸BB对ATCC29213和MRSA1细胞形态的影响
设置对照组及黄绵马酸BB(1/2MIC、MIC、2MIC)组,各给药组加入含相应药物的菌液,对照组只加入菌液不加入药液,于37 ℃振荡培养,分别在菌种对数生长期(4 h)和生长稳定期(18 h)取出菌悬液,4 ℃、4000 r/min离心15 min,收集菌体,PBS缓冲液漂洗3次,弃去上清液,菌体加入2.5% Gluta固定液,于4 ℃固定10 h,制成TEM样品,于TEM下观察[12]。
2.6 黄绵马酸BB对ATCC29213和MRSA1细胞壁通透性的影响
设置对照组及黄绵马酸BB(1/2MIC、MIC、2MIC)组,各给药组加入含相应药物的菌液,对照组只加入菌液不加入药液,于37 ℃振荡培养4 h,经0.22 µm滤膜滤过,按照试剂盒说明书测定上清液中AKP活性。
2.7 黄绵马酸BB对ATCC29213和MRSA1细胞膜电位的影响
课题组前期研究中尼生素对ATCC29213和MRSA1的MIC均为25 μg/mL,设置对照组、黄绵马酸BB(MIC)组、尼生素(MIC)组,各给药组加入含相应药物的菌液,对照组只加入菌液不加入药液,于37 ℃振荡培养1 h,加入0.4 µmol/L DiSC3-5,培养30 min。激发波长为622 nm,发射波长为670 nm,用荧光分光光度计测定荧光强度。
2.8 黄绵马酸BB对MRSA1中青霉素结合蛋白1(penicillin-binding protein 1,PBP1)mRNA表达的影响
是金黄色葡萄球菌细胞分裂的关键基因,按照文献报道方法[13],设置对照组及黄绵马酸BB(1/2MIC、MIC、2MIC)组,各给药组加入含相应药物的菌液,对照组只加入菌液不加入药液,于37 ℃培养4 h,收集菌体,按照试剂盒说明书提取RNA并合成cDNA,进行qRT-PCR分析。引物序列:16S rRNA上游引物5’-GAGAGAAGGTGGGGATGACGT-3’,下游引物5’-AGGCCCGGGAACGTATTCAC-3’,产物大小为217 bp;上游引物5’-AGAGTCGGTTGGG- GTGAAAT-3’,下游引物5’-ACCAGGTGCTTCTCC- ATCAA-3’,产物大小为178 bp。qRT-PCR程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环;55 ℃升温至95 ℃,每升温0.5 ℃进行1次读数。
2.9 数据统计与分析

3 结果
3.1 黄绵马酸BB对SSTI相关致病菌抗菌活性
如表1所示,头孢唑啉对3株MRSA临床分离株的MIC为320.000~640.000 µg/mL,对3株大肠埃希菌临床分离株的MIC为80.000~1 280.000 µg/mL,CLSI头孢唑林对葡萄球菌属和肠杆菌科的耐药标准分别为MIC≥32.000 µg/mL及MIC≥8.000 µg/mL,表明头孢唑林对MRSA和大肠埃希菌表现为高度耐药。万古霉素对3株MRSA临床株的MIC为3.54~10.00 µg/mL,对3株大肠埃希菌临床分离株的MIC>32.00 µg/mL;达托霉素对3株MRSA临床株的MIC均为2.00 µg/mL;黄绵马酸BB对3株MRSA临床分离株的MIC小于阳性对照药物头孢唑啉,均为20.0 µg/mL,其MBC与MIC相近,为20.0~40.0 µg/mL,表明黄绵马酸BB对MRSA临床株具有较好的抑菌和杀菌作用;3株大肠埃希菌临床株对黄绵马酸BB的敏感性较差,MIC和MBC均大于1 280.0 µg/mL,与文献报道[14]一致。
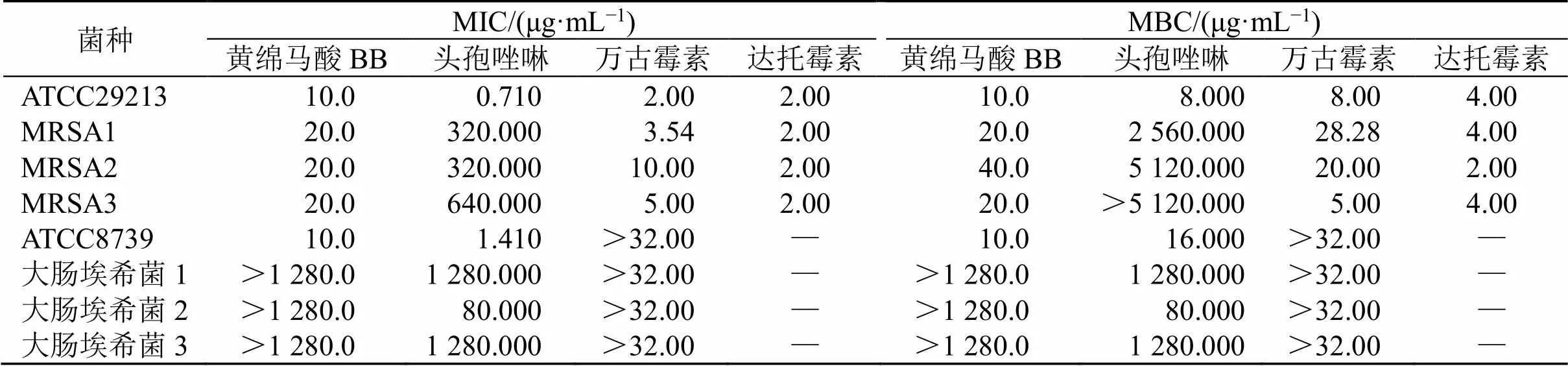
表1 黄绵马酸BB对受试菌株的MIC和MBC
3.2 黄绵马酸BB对ATCC29213和MRSA1的时间-杀菌曲线
如图1所示,对照组菌株接种2 h后开始出现对数生长,1/2MIC、MIC黄绵马酸BB组菌株对数生长期为第6小时和第14小时,2MIC黄绵马酸BB组菌株24 h内未见生长。表明黄绵马酸BB抑制ATCC29213和MRSA1生长,呈剂量相关性。
3.3 黄绵马酸BB对ATCC29213和MRSA1细胞形态的影响
如图2所示,对照组ATCC29213和MRSA1细胞形态结构完好,壁-膜结构完整,原生质体分布均匀;与对照组比较,MIC黄绵马酸BB处理至对数生长期(4 h),细菌形态皱缩,细胞质不均匀,部分壁-膜区域变得模糊;MIC黄绵马酸BB处理至生长稳定期(18 h),细胞内部结构异常化,染色体固缩,细胞内出现大面积的低电子密度空白区。
3.4 黄绵马酸BB对ATCC29213和MRSA1细胞壁通透性的影响
如图3所示,与对照组比较,黄绵马酸BB组细菌培养液中AKP活性无明显变化,表明黄绵马酸BB对ATCC29213和MRSA1细胞壁的通透性无明显影响。
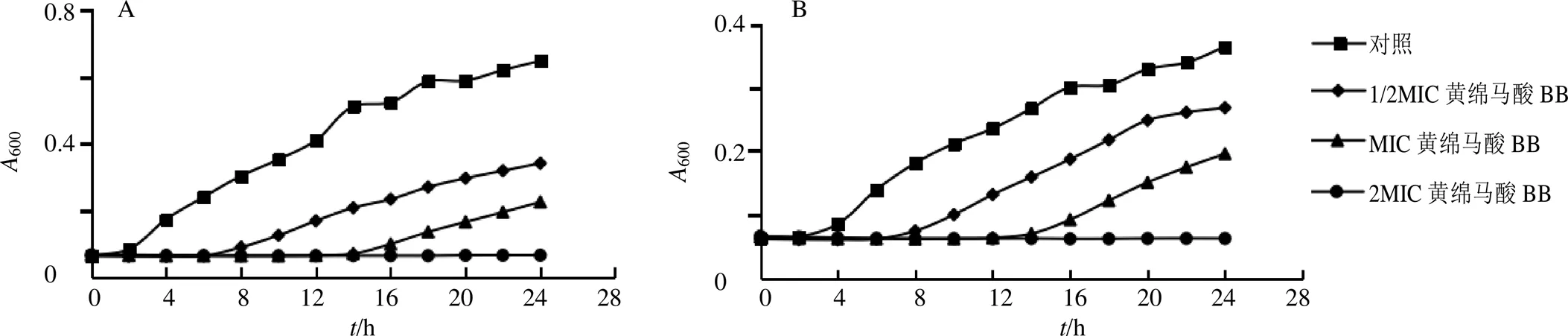
图1 黄绵马酸BB对ATCC29213 (A) 和MRSA1 (B) 的时间-杀菌曲线

图2 黄绵马酸BB对ATCC29213和MRSA1细胞形态的影响(×150 000)
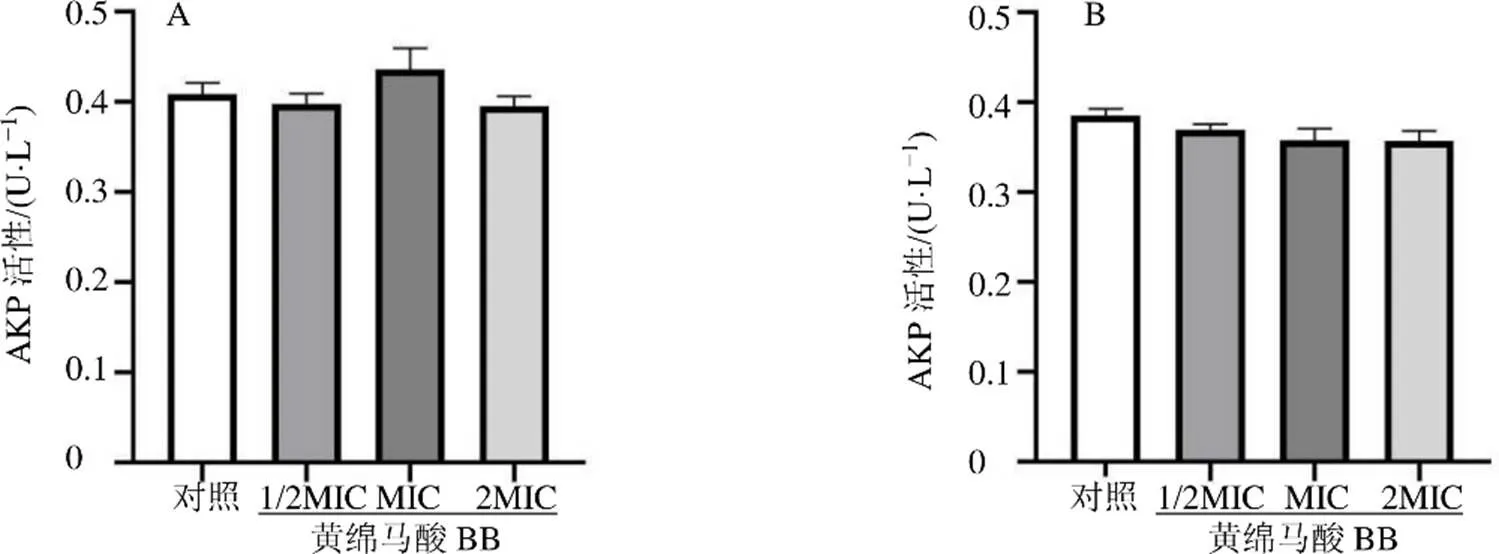
图3 黄绵马酸BB对ATCC29213 (A) 和MRSA1 (B) 细胞壁通透性的影响
3.5 黄绵马酸BB对ATCC29213和MRSA1细胞膜电位的影响
当细胞膜电位降低时,DiSC3-5荧光染料释放到胞外,荧光强度上升。如表2所示,与对照组比较,MIC黄绵马酸BB组ATCC29213和MRSA1的DiSC3-5荧光强度明显提高(<0.05),表明黄绵马酸BB能够引起ATCC29213和MRSA1细胞膜电位的降低。

表2 黄绵马酸BB对ATCC29213和MRSA1细胞膜电位的影响
与对照组比较:*<0.05***<0.001
*< 0.05***< 0.001control group
3.6 黄绵马酸BB对MRSA1中PBP1 mRNA表达的影响
如图4所示,与对照组比较,1/2MIC黄绵马酸BB组MRSA1中mRNA表达水平显著降低(<0.01),2MIC黄绵马酸BB组MRSA1中mRNA表达水平显著升高(<0.01)。
4 讨论
SSTI为局限性感染疾病,随着抗菌药物的滥用,致病菌产生耐药性,临床常用的抗菌药物治疗效果降低[15-16]。黄绵马酸BB抗菌活性良好[16],对皮肤癣菌有较好的抑制作用[17],但对SSTI致病菌的抗菌活性尚不明确。CLSI规定金黄色葡萄球菌对万古霉素的MIC≤2 µg/mL即为敏感,MIC 4~8 µg/mL即为中介,本研究结果显示,3株MRSA临床分离株对万古霉素的敏感性均下降,呈中介耐药性。当药物对微生物的MBC/MIC≥32时,可判定微生物对受试药产生了耐受性[18],本研究结果显示,黄绵马酸BB对3株MRSA临床分离株的MBC/MIC≤2,表明黄绵马酸BB对万古霉素中介耐药的MRSA临床分离株具有显著的敏感性。
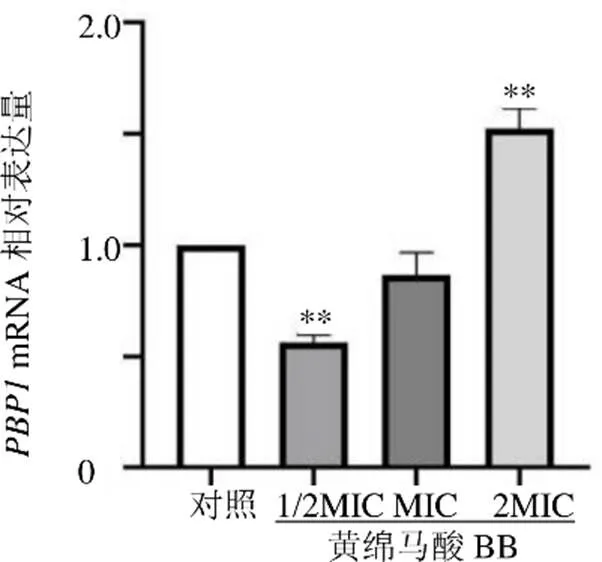
与对照组比较:**P<0.01
完整的菌体细胞结构是维持生命的必要条件,MIC黄绵马酸BB能够破坏菌体细胞壁-膜结构的完整性,造成染色体固缩、细胞空化。细胞膜电位对三磷酸腺苷(adenosine triphosphate,ATP)的产生和细胞功能具有重要意义[19],MIC黄绵马酸BB可显著降低ATCC29213和MRSA1临床分离株细胞膜电位,从而影响ATP生成、干扰细菌的正常代谢。PBP1是MRSA细胞分裂的关键基因,敲除PBP1后,菌株停止分裂[20],本研究发现,1/2MIC黄绵马酸BB能显著下调mRNA表达水平,从而抑制菌体的分裂,阻碍细菌的正常繁殖。2MIC黄绵马酸BB能显著上调mRNA表达水平,黄绵马酸BB能使MRSA的染色体发生固缩。研究发现,MRSA的DNA受损引发的反应会使PBP1表达代偿性增加[21],表明2MIC黄绵马酸BB能够造成MRSA的DNA的损伤,从而上调mRNA表达水平。
综上所述,本研究以造成SSTI的主要病原菌金黄色葡萄球菌和大肠埃希菌为研究对象,阐述了黄绵马酸BB抗菌活性及机制,为抗SSTI新药开发提供理论基础。细菌的耐药性与其生物被膜的形成密切相关[22],课题组后续将对黄绵马酸BB抑制生物被膜的作用及机制进行深入探究。
利益冲突 所有作者均声明不存在利益冲突
[1] Salatin S, Lotfipour F, Jelvehgari M. A brief overview on nano-sized materials used in the topical treatment of skin and soft tissue bacterial infections [J]., 2019, 16(12): 1313-1331.
[2] 刘韬滔, 刘亚林, 何清, 等. 软组织感染致脓毒性休克的早期诊断与治疗 [J]. 中华急诊医学杂志, 2020, 29(1): 76-81.
[3] 柯晓苹, 蔡良奇, 林维嘉. 皮肤软组织感染人群病原菌分布与其耐药性分析 [J]. 中国医院药学杂志, 2019, 39(20): 2073-2076.
[4] 万东芳, 万永山, 朱红军, 等. 皮肤软组织感染患者金黄色葡萄球菌感染状况研究 [J]. 中华医院感染学杂志, 2019, 29(1): 32-35.
[5] 陈雪琴. 589株社区获得性皮肤软组织感染病原菌分布及耐药性分析 [D]. 遵义: 遵义医科大学, 2019.
[6] 廖国建, 彭希希, 田俊, 等. 达托霉素耐药分子机制研究进展 [J]. 生物工程学报, 2018, 34(6): 832-838.
[7] Hu H C, Kao K C, Chiu L C,. Clinical outcomes and molecular typing of heterogenous vancomycin- intermediatebacteremia in patients in intensive care units [J]., 2015, 15: 444.
[8] Chung D R, Lee C, Kang Y R,. Genotype-specific prevalence of heterogeneous vancomycin-intermediatein Asian countries [J]., 2015, 46(3): 338-341.
[9] 陈玲玲, 梁彦涛, 卜志刚, 等. 黑龙江省香鳞毛蕨六个天然分布地种群结构分析 [J]. 北方园艺, 2016, 40(24): 70-76.
[10] 朱冲冲, 彭冰, 曾祖平, 等. 香鳞毛蕨的化学成分及药理作用研究进展 [J]. 中国药房, 2017, 28(10): 1418-1423.
[11] 康廷国. 中药鉴定学 [M]. 北京: 中国中医药出版社, 2003: 115.
[12] 谢强, 林玉桓, 苗淑萍, 等. 香芹酚对大肠杆菌和金黄色葡萄球菌细胞膜的影响 [J]. 食品工业科技, 2014, 35(23): 54-58.
[13] 樊莉, 孙凤军, 枉前, 等. 亚抑菌浓度抗菌药物对多重耐药鲍曼不动杆菌生物膜形成的影响 [J]. 中国药房, 2018, 29(22): 3129-3134.
[14] 李晓娟. 香鳞毛蕨精油和间苯三酚类成分提取分离及其抑菌活性研究 [D]. 哈尔滨: 东北林业大学, 2012.
[15] 郑跃, 席云, 赖维, 等. 皮肤软组织感染致病菌的菌种构成和药敏变化趋势分析 [J]. 皮肤性病诊疗学杂志, 2014, 21(1): 29-33.
[16] 王敏, 原明明, 李树君, 等. 成人细菌性皮肤病的病原菌分布与耐药性研究 [J]. 中国病原生物学杂志, 2020, 15(7): 846-849.
[17] 梁玉婷, 宋国强, 林楚怡, 等. 香鳞毛蕨化学成分及其体外抗浅部真菌活性研究 [J]. 天然产物研究与开发, 2019, 31(10): 1758-1763.
[18] 周本宏, 李妍, 周梦宇, 等. 消炎抗菌片的抗菌活性及对福氏志贺氏菌的抗菌机制初步探讨 [J]. 中国医院药学杂志, 2018, 38(23): 2429-2433.
[19] 刘蓉, 唐方, 凌海慧, 等. 紫苏叶油对结肠平滑肌细胞钙离子和膜电位的作用 [J]. 时珍国医国药, 2019, 30(6): 1302-1304.
[20] Pereira S F, Henriques A O, Pinho M G,. Evidence for a dual role of PBP1in the cell division and cell separation of[J]., 2009, 72(4): 895-904.
[21] Plata K B, Riosa S, Singh C R,. Targeting of PBP1by β-lactams determines recA/SOS response activation in heterogeneous MRSA clinical strains [J]., 2013, 8(4): e61083.
[22] 王洪彬, 朱利霞, 于秀剑, 等. 细菌生物被膜研究进展 [J]. 动物医学进展, 2019, 40(9): 74-79.
Antibacterial activity and mechanism of flavaspidic acid BB on pathogenic bacteria of skin and soft tissue infection
YIN Chuan-ping1, CHEN Wen-hao1, MO Zi-tong1, WU Xiao-shi1, TANG Chun-ping1, 2, SHEN Zhi-bin1, 2, 3
1. School of Traditional Chinese Medicines, Guangdong Pharmaceutical University, Guangzhou 511400, China 2. Guangdong Provincial Engineering Center of Topical Precise Drug Delivery System, Guangzhou 510006, China 3. Guangdong Provincial Cosmetics Engineering Technology Research Center, Guangzhou 510006, China
To study the antibacterial activity of flavaspidic acid BB on pathogenic bacteria related to skin and soft tissue infections, and explore the antibacterial mechanism against.The microdilution method was used to determine the minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) of flavaspidic acid BB against pathogenic bacteria related to skin and soft tissue infections; Clinical strain of methicillin-resistant(MRSA) andstandard strain ATCC29213, which were sensitive to flavaspidic acid BB, were used as test bacteria to explore the influence of flavaspidic acid BB on growth vitality and the morphological structure of tested bacteria. Effect of flavaspidic acid BB on permeability of cell wall was detected by microplate reader; Effect of flavaspidic acid BB on cell membrane potential was detected by fluorescence spectrophotometer; Effect of flavaspidic acid BB on expression of penicillin-binding protein 1 () mRNA was detected by qRT-PCR.MIC of flavaspidic acid BB against ATCC29213 was 10.0—20.0 µg/mL, MBC was 10.0—40.0 µg/mL, MIC values of MRSA clinical strains were lower than cefazolin. Compared with control group, growth of ATCC29213 and MRSA in flavaspidic acid BB group were inhibited, morphological structure of bacterial cell was changed, and cell membrane potential was reduced (< 0.05), expression ofmRNA was down-regulated by 1/2MIC flavaspidic acid BB and up-regulated by 2MIC flavaspidic acid BB (< 0.01).The flavaspidic acid BB exhibits good antibacterial activity against MRSA clinical strains, of which antibacterial effect is related to the destruction of bacterial cell structure, lowering the cell membrane potential and affecting the expression ofmRNA.
flavaspidic acid BB; methicillin-resistant; cell membrane potential; antibacterial activity; penicillin-binding protein 1
R285.5
A
0253 - 2670(2021)06 - 1662 - 06
10.7501/j.issn.0253-2670.2021.06.014
2020-10-25
国家重点研发计划“中医药现代化”重点专项项目(2018YFC1707100);广东省科技厅应用型研发专项(2015B020234009)
殷川平(1995—),男,硕士研究生,研究方向为天然药物化学。E-mail: 2274609080@qq.com
沈志滨(1964—),女,教授,博士,研究方向为中药药效物质基础及新药研发。E-mail: szb8113@126.com
[责任编辑 李亚楠]

