地黄RgMATE6转运蛋白基因的克隆、亚细胞定位与表达分析
杨艳会,杨 恒,张重义,伊艳杰,李瑞芳,董 臣,张宗武,王超杰
地黄转运蛋白基因的克隆、亚细胞定位与表达分析
杨艳会1,杨 恒1,张重义2,伊艳杰1,李瑞芳1,董 臣1,张宗武1,王超杰1
1. 河南工业大学生物工程学院,河南 郑州 450001 2. 福建农林大学作物科学学院,福建 福州 350002
克隆地黄多药及有毒化合物外排(multidrug and toxic compound extrusion,MATE)转运蛋白基因,并进行亚细胞定位与时空表达分析,为深入研究其在地黄转运次生代谢产物中的分子功能奠定基础。利用地黄转录组数据库候选基因序列,利用实时荧光PCR(RT-PCR)克隆基因;利用生物信息学软件对其编码蛋白的结构、理化性质、同源性和进化树进行分析;通过与绿色荧光蛋白(GFP)融合表达进行亚细胞定位;利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)的方法测定该基因的时空表达模式。克隆获得1892 bp的基因序列,基因编码524个氨基酸、具有2个典型的MatE结构域和12个跨膜结构;RgMATE6蛋白与越橘的VcMATE6蛋白亲缘关系最近;RgMATE6-GFP载体瞬时表达的结果发现RgMATE6蛋白定位在液泡膜上;qRT-PCR分析发现基因在地黄不同时期的根中表达最高,尤其是块根膨大前期。RgMATE6蛋白定位在液泡膜上,在地黄块根膨大期的根中表达较高,初步表明RgMATE6可能参与地黄体内次生代谢产物向液泡转运的过程。
地黄;MATE转运蛋白;生物信息学;亚细胞定位;表达分析
地黄Libosch为玄参科地黄属多年生草本植物,是我国传统的四大怀药之一。地黄体内的许多次生代谢产物均具有生物活性,常见的有毛蕊花糖苷、梓醇及多糖类,具有抗炎、抗肿瘤、缓泻等作用,在临床上广泛应用[1]。目前大量的研究主要集中在地黄体内活性物质的鉴定及其药理机制上,且对毛蕊花糖苷[2]、梓醇[3]等主要活性物质的生物合成途径也已有相关研究。然而,地黄次生代谢通路下游次生代谢产物从合成部位到贮存部位的跨膜转运研究尚不清楚。
液泡是植物积累次生代谢产物的主要场所之一,而次生代谢产物从合成部位转运到液泡中储存的过程,要通过位于液泡膜上的转运蛋白的介导来完成[4]。近年来,研究者发现了一类重要的次生代谢转运通道,即多药及有毒化合物外排(multidrug and toxic compound extrusions,MATEs)转运蛋白家族。这类蛋白在植物体内广泛存在,能将自身次生代谢的产物运输到液泡内并进行贮存,从而保持这些次生代谢产物本身的生物活性[5]。植物MATEs均为膜蛋白,具有9~12个跨膜螺旋结构(transmembrane helices,TMs),由400~550个氨基酸残基组成[6],典型MATEs蛋白的二级结构的高度保守序列均位于TM1和TM7附近,MATEs蛋白的N端(TM1~TM6)和C端(TM7~TM12)之间形成1个向液泡内开放的“V”字形空腔,并依赖质子或者阳离子浓度势能差,通过其空间构象的改变,执行着特异底物转运的功能[7]。前人在许多植物的研究中已明确地鉴定了转运黄酮类、萜类、酚类等次生代谢产物的MATEs基因及其蛋白。拟南芥MATEs家族成员AtDTX1[8]、AtTT12[9]和AtFRD3[10]能把酚酸、黄酮等次生代谢产物转运到液泡内;蒺藜苜蓿MtMATE1和MtMATE2能把黄酮苷、糖苷类和丙二酸苷转运到液泡中[11];葡萄的2个MATEs成员VvAM1和VvAM3参与了花色素苷的转运与积累[12];草莓FaTT12-1(MATEs家族成员)具有转运酚类物质的功能[13]。可见,MATEs在植物体内次生代谢产物的转运过程中发挥重要作用。
在次生代谢过程中,地黄体内产生了许多重要的活性物质,并在其细胞内大量积累。植物MATEs在次生代谢产物转运与积累过程中发挥着重要作用,推测地黄体内也可能存在着转运次生代谢产物的MATEs蛋白,而地黄MATEs基因及蛋白一直未被鉴定与研究。由于地黄的基因组数据匮乏,本研究利用地黄转录组数据库候选1条MATE基因序列(命名为),利用RT-PCR方法克隆基因,利用在线软件对该基因编码的蛋白序列进行分析;利用同源重组、实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)等技术进行亚细胞定位和表达模式分析,以期初步揭示RgMATE6蛋白在地黄次生代谢产物转运中的功能。
1 材料与仪器
1.1 材料
本研究所用实验材料为地黄品种“温85-5”,由河南工业大学杨艳会副教授鉴定为地黄Libosch,种植于河南工业大学中药材生态观测站(温县基地),在苗期、拉线期、块根膨大前期、块根膨大中期、块根膨大后期和成熟期共6个不同生长时期[14],分别收集地黄根、茎和叶的新鲜样品,放入液氮速冻后,−80 ℃保存,用于基因的克隆及qRT-PCR。
总RNA提取Trizol试剂盒购自Invitrogen公司;pBI121-GFP瞬时表达载体购自BioVector公司;质粒提取试剂盒和卡那霉素购自北京索莱宝科技有限公司,Super-Fidelity DNA Polymerase高保真酶、HiScript II One Step qRT-PCR SYBR Green Kit荧光定量试剂盒购自南京诺唯赞生物科技有限公司,反转录试剂盒、胶回收试剂盒、DL 2000 DNA Marker、限制性核酸内切酶I、无缝克隆(In-fusion HD cloning kit)、大肠杆菌DH5α感受态、克隆载体pMD18购自大连宝生物(Takara)公司,所有引物由上海生工生物工程有限公司合成。
1.2 仪器
Axio Vert A1型荧光显微镜,德国蔡司公司;FV 3000型激光共聚焦扫描显微镜,日本奥林巴斯公司;StepOne Real-Time PCR System型荧光定量PCR仪,美国ABI公司。
2 方法
2.1 RNA的提取与cDNA的获得
将地黄不同时期的根、茎、叶3种组织样品分别在液氮中充分研磨成粉末,使用Trizol总RNA提取试剂盒提取各样品的总RNA,利用1%的琼脂糖凝胶进行电泳检测。取1 μg的总RNA,使用Takara公司的反转录试剂盒将总RNA反转录成cDNA,并于−20 ℃下贮存。
2.2 RgMATE6基因的克隆
基于地黄转录组数据库获得的1个基因的Unigene片段,NCBI BlastN比对发现该序列是全长序列,利用Oligo 7.0软件分别从5’和3’末端设计基因的特异引物(表1)。以所有样品的混合cDNA为模板进行PCR扩增,程序为94 ℃、3 min;98 ℃、15 s,61 ℃、30 s,72 ℃、2 min,36个循环;72 ℃、7 min,然后通过琼脂糖凝胶电泳对PCR产物进行检测。利用胶回收试剂盒回收目的片段,并将其连接到Takara公司的pMD18克隆载体上,转化至DH5α感受态。经抗性筛选后进行菌液PCR检测,将含有与目的片段大小一致的条带的菌液送至上海生工生物工程有限公司进行测序。

表1 克隆及qRT-PCR引物
2.3 生物信息学分析
利用ORF Finder工具预测基因的开放阅读框(open reading frame,ORF),利用ProtParam工具分析其蛋白的理化性质;利用TMHMM软件预测跨膜结构域;利用SMART软件分析功能结构域;利用SOPMA和SWISS-MODEL工具分别预测蛋白的二级结构和三级结构;通过DNAMAN 5.0软件对RgMATE6与其他物种的MATEs蛋白的氨基酸序列进行同源性分析;使用MEGA 7.0软件的Neighbor-Joining法构建MATEs蛋白家族进化树。
2.4 RgMATE6的亚细胞定位
为构建5’端加GFP标签的融合蛋白表达载体,利用Oligo 7.0软件设计基因的特异引物(表1)并进行克隆,用Takara公司的无缝克隆试剂盒构建35S : RgMATE6-GFP表达载体。用CaCl2法制备GV3101农杆菌化学感受态,并通过冻融法将35S : RgMATE6-GFP和35S : GFP(对照)质粒分别转入农杆菌GV3101。通过农杆菌介导的遗传转化法将2种质粒分别转入洋葱表皮细胞,25 ℃避光培养48 h,在激发光为470 nm的条件下用荧光显微镜观察GFP信号;参考制备拟南芥原生质体的酶解法制备地黄原生质体[15],通过PEG-4000介导的方法将35S : RgMATE6-GFP和35S : GFP(对照)质粒分别转入地黄原生质体,25 ℃避光培养20 h,在激发光为470 nm的条件下用激光共聚焦扫描显微镜观察GFP信号。
2.5 qRT-PCR分析
使用Beacon Designer 8.0软件设计基因和内参基因(GenBank注册号EU526396)的qRT-PCR引物(表1)。以cDNA为模板,参照荧光定量试剂盒说明书配制体系,采用标准程序进行扩增。采用2−ΔΔCt方法计算基因的相对表达量,每个样本进行3次生物学重复。
3 结果与分析
3.1 RgMATE6基因的克隆
用琼脂糖凝胶电泳检测各样品的总RNA,由图1-A可看出,28 S和18 S的条带清晰没有拖尾的现象,同时28 S比18 S的条带更亮,5 S的条带较暗,可用于下游实验。图1-B是基因的阳性克隆菌液PCR产物的检测结果,其长度约1900 bp,其测序后的序列与目的基因序列(1892 bp)一致,表明基因克隆成功。
3.2 RgMATE6蛋白的序列特征
3.2.1 RgMATE6蛋白的理化性质及其结构分析ORF Finder预测基因的ORF为1575 bp,编码524个氨基酸。ProtParam分析得到RgMATE6蛋白的相对分子质量为57 279.25,理论等电点为5.29,分子式为C2682H4100N632O709S23;该蛋白的不稳定系数为31.2,是稳定蛋白;脂肪系数为112.46,总平均亲水性为0.693,属于疏水性蛋白。SOPMA工具分析结果如图2-A所示,图2-B是SWISS-MODEL软件建立的RgMATE6蛋白的三维结构模型。RgMATE6蛋白的二级结构包含292个α螺旋(55.73%),106个无规则卷曲(20.23%)及126个折叠形态延伸链(20.05%),α螺旋是主要组成部分。TMHMM预测的跨膜结构域如图3-A所示,该蛋白有12个跨膜螺旋,符合MATEs转运蛋白家族的12个典型跨膜螺旋的结构特征。如图3-B所示,SMART软件分析发现该蛋白具有2个MATEs转运蛋白家族特有的MatE结构域,可确定基因是MATEs转运蛋白家族成员。
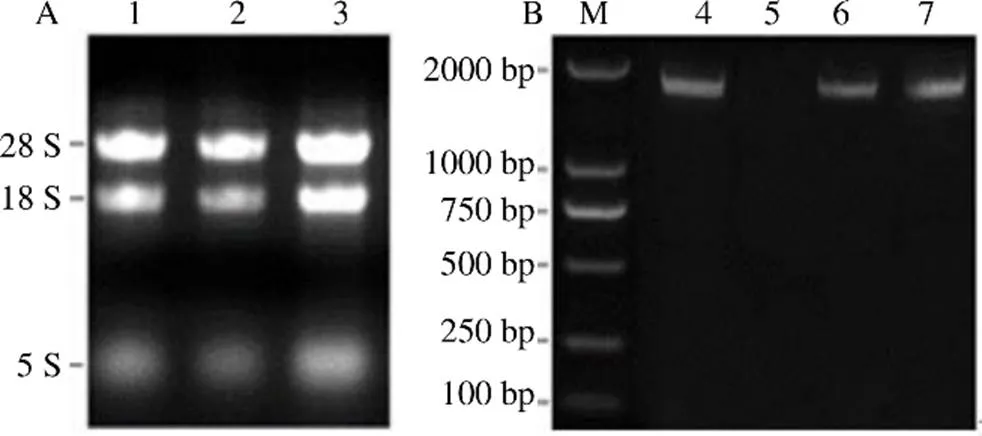
1~3-RNA M-Marker 4,6~7-RgMATE6全长片段连接 pGM-T质粒的菌液PCR 5-未检出
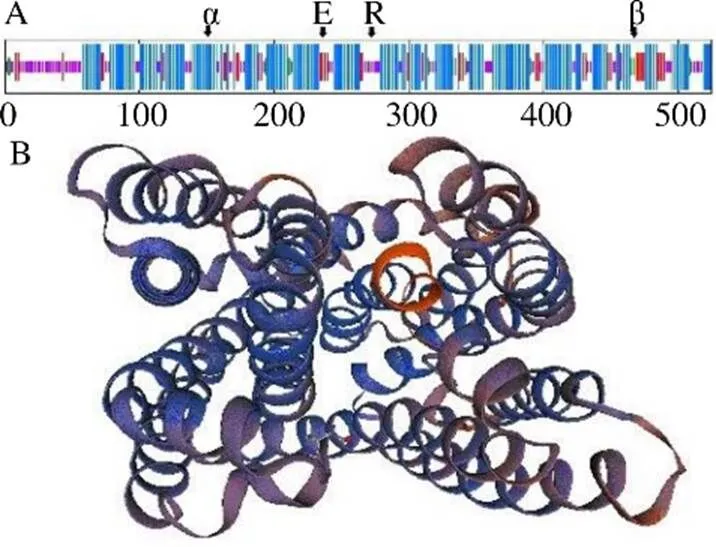
α-α-螺旋 β-β-折叠 R-随机卷曲 E-延伸链

图3 RgMATE6蛋白的跨膜结构预测(A) 和保守结构域分析(B)
3.2.2 RgMATE6蛋白的同源性及系统进化树分析 对RgMATE6蛋白序列与其他植物中MATEs的蛋白序列进行多重比对,由图4可看出,地黄RgMATE6蛋白与越橘L. VcMATE6(登录号KF875437)、芝麻L. SiDTX30(登录号XP_011086621.1)、寄生草L. SaMATE(登录号GER37032.1)、烟草L. NtDTX29(登录号XP_016515174.1)蛋白具有较高的同源性(约80%)。为明确地黄RgMATE6在植物MATEs家族中的进化位置,选取RgMATE6与其他植物功能己知的MATEs序列构建MATEs家族进化树,由图5可看出,RgMATE6与越橘VcMATE6、拟南芥AtFFT/DTX35、苜蓿MtMATE2和烟草的NtJAT2聚为一类,且与VcMATE6的亲缘关系最近。
3.3 RgMATE6蛋白的亚细胞定位
将含有35 S : RgMATE6-GFP和35 S : GFP载体的农杆菌侵染洋葱表皮细胞后观察。如图6所示,在荧光显微镜下观察到35 S : GFP载体在洋葱细胞的细胞膜、细胞质、液泡膜等部位均显示绿色荧光信号;而在35 S : RgMATE6-GFP表达的洋葱表皮细胞中,仅在液泡膜上检测到绿色荧光信号,初步表明RgMATE6蛋白定位在液泡膜上。
为进一步验证RgMATE6的亚细胞定位结果,将35 S : RgMATE6-GFP和35 S : GFP载体转化到地黄原生质体中进行瞬时表达。由图7可看出,在激光共聚焦扫描显微镜下,35 S : GFP载体的绿色荧光信号在原生质体各个部位均能检测到,无特异的荧光信号;而35 S : RgMATE6-GFP表达的原生质体仅在液泡膜上发出特异的荧光信号。以上结果表明:RgMATE6蛋白定位在液泡膜上。
3.4 RgMATE6基因的表达模式分析
为进一步分析基因的表达模式,利用qRT-PCR技术对基因在不同时期不同组织中的相对表达量进行检测。基因在地黄根、茎、叶中均有表达,但其表达量存在着明显的差异。在各组织中,除苗期以外,基因在根中均具有较高表达量,其次是茎,而叶中的表达量最低;在不同的发育时期中,基因在各组织中的表达量均呈先升后降的趋势,该基因在块根膨大前期的各组织中具有较高的表达量,其次是块根膨大中期,在苗期和成熟期时各组织的表达量较低。

黑线显示RgMATE6的跨膜结构域
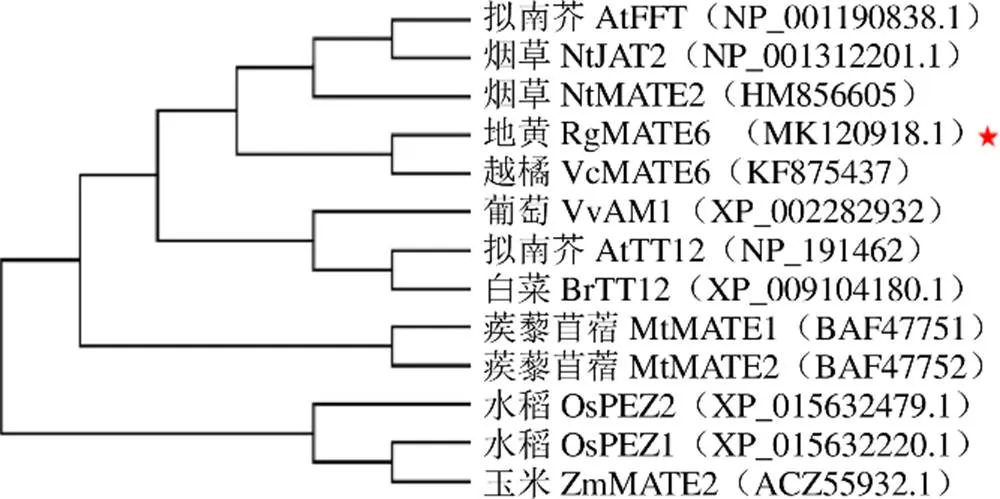
图5 RgMATE6与植物MATE家族部分蛋白的进化树分析

A-RgMATE6-GFP载体 B-GFP载体
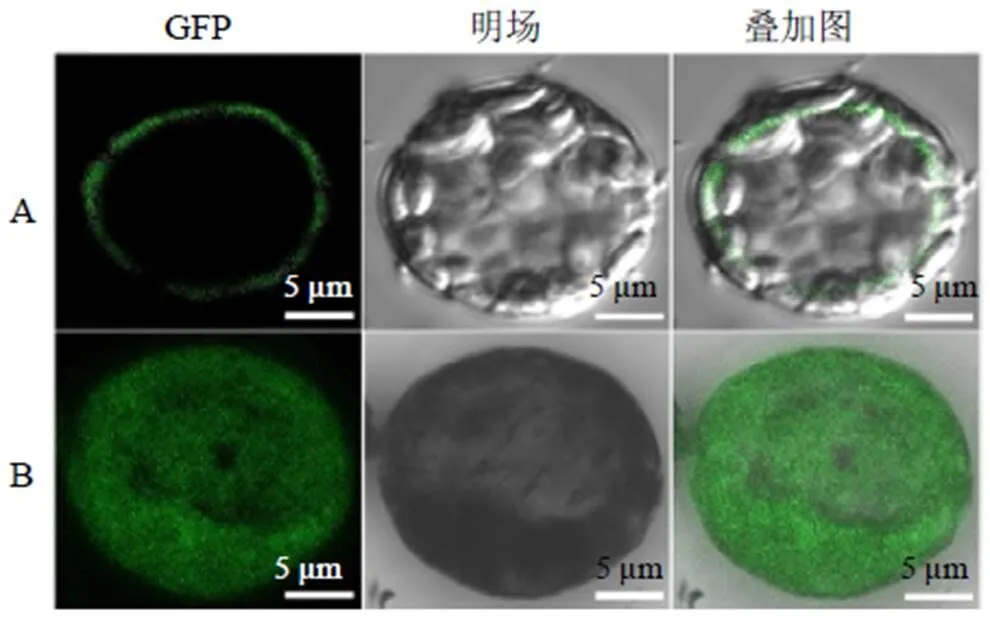
A-RgMATE6-GFP载体 B-GFP载体
4 讨论
在植物次生代谢途径中,为避免一些次生代谢产物被分解而失去生物活性,需要通过转运通道系统将次生代谢产物转运到液泡中进行屏蔽和贮存,而植物MATEs蛋白在这些活性物质转运与积累的过程中发挥重要的作用[16]。地黄体内重要的活性成分均是次生代谢产物,而目前关于地黄体内次生代谢产物转运通道的研究鲜有报道。基于此,本研究通过地黄转录组数据库和在线软件鉴定了1个MATE基因,其编码了524个氨基酸,其蛋白具有2个MATEs转运蛋白家族特有的MatE结构域和12个跨膜螺旋的基本特征。这些信息初步表明具有潜在的植物MATEs家族转运蛋白的特征。
通过RgMATE6蛋白与其他植物中功能已知的MATEs蛋白进行氨基酸序列的多重比对与进化树分析,发现地黄RgMATE6蛋白与越橘、拟南芥、苜蓿和烟草中的MATEs家族成员具有较近的进化关系。研究表明,越橘VcMATE6可能参与了次生代谢产物中类黄酮的转运及其液泡积累的过程[17]。在花器官发育过程中,拟南芥的AtFFT/DTX35是运输黄酮的1个重要通道蛋白[18]。烟草NtJAT在转运次生代谢物(烟碱)的过程中起重要调控作用[19]。由此推测,RgMATE6也可能参与了地黄体内一些次生代谢产物的转运过程。植物MATEs转运蛋白能将由次生代谢产生的生物碱、糖苷类、萜类化合物、酚类等多种活性物质运输到液泡内并大量积累,从而实现自身细胞内源性物质的解毒功能,有助于进一步调节植物体内多种活性物质的分布、积累和平衡,以维持植物正常的生长发育过程[20]。研究表明,拟南芥AtFFT/DTX35、苜蓿MtMATE2、烟草NtJAT2和越橘VcMATE6均定位在液泡膜上,这些MATEs蛋白均参与了植物体内酚类、糖苷类、生物碱等重要活性物质的转运与积累过程。RgMATE6与这些MATEs家族成员存在着较近的亲缘关系,此外,本研究的实验结果也证明了RgMATE6蛋白定位在液泡膜上。由此推测,基因可能参与了地黄体内次生代谢产物向液泡转运与积累的过程。
此外,植物中大多数的MATEs基因存在着明确的时空表达模式。和基因仅在根中表达,而烟草基因在叶、茎和根均表达[21]。拟南芥MATEs家族成员基因几乎在所有组织均有表达。在本研究中,基因在各组织均有表达,但其不同组织的表达量存在着差异,基因在根中的表达最为强烈;而且块根膨大期是地黄生长的关键期,在块根膨大前期和中期的根中表达水平较高。地黄块根是临床药用部位,贮存着大量的活性物质,基因在地黄块根中的强烈表达,表明该基因可能在地黄体内次生代谢产物向液泡内部转运与积累的过程中执行着重要的分子功能。
综上所述,本研究鉴定的RgMATE6蛋白可能是地黄体内转运一些次生代谢产物的重要通道蛋白。虽然基因的分子功能仍需进一步验证,但本研究可为深入阐明其在地黄体内次生代谢过程中活性物质转运与积累的分子机制提供重要的理论依据,且对深入揭示地黄体内药效成分积累的分子调控机制具有重要参考价值。
利益冲突 所有作者均声明不存在利益冲突
[1] 李慧芬. 地黄药理作用和临床应用概况 [J]. 药学研究, 2014, 33(6): 345-347.
[2] Wang F Q, Zhi J Y, Zhang Z Y,. Transcriptome analysis of salicylic acid treatment inhairy roots using RNA-seq technique for identification of genes involved in acteoside biosynthesis [J]., 2017, 8: 787.
[3] 詹忠根. 地黄分子鉴定及功能基因研究进展 [J]. 中草药, 2019, 50(22): 5611-5620.
[4] 谢小东, 程廷才, 王根洪, 等. 植物ABC和MATE转运蛋白与次生代谢物跨膜转运 [J]. 植物生理学报, 2011, 47(8): 752-758.
[5] 吴远双, 宋毅豪, 吴宝尧, 等. 植物多药和有毒化合物排出转运蛋白研究进展 [J]. 广西植物, 2018, 38(11): 1534-1544.
[6] Wang L H, Bei X J, Gao J S,. The similar and different evolutionary trends of MATE family occurred between rice and[J]., 2016, 16(1): 207.
[7] Krishnan S, Riedelsberger J, Miller J,. Elucidation of structural domains underlying substrate recognition in plant MATE transporters [J]., 2020, 118(3): 442a.
[8] Li L G, He Z, Pandey G K,. Functional cloning and characterization of a plant efflux carrier for multidrug and heavy metal detoxification [J]., 2002, 277(7): 5360-5368.
[9] Debeaujon I, Peeters A J, Léon-Kloosterziel K M,. The TRANSPARENT TESTA12 gene ofencodes a multidrug secondary transporter-like protein required for flavonoid sequestration in vacuoles of the seed coat endothelium [J]., 2001, 13: 853-871.
[10] Pineau C, Loubet S, Lefoulon C,. Natural variation at the FRD3 MATE transporter locus reveals cross-talk between Fe homeostasis and Zn tolerance in[J]., 2012, 8(12): e1003120.
[11] Zhao J, Dixon R A. MATE transporters facilitate vacuolar uptake of epicatechin 3'--glucoside for proanthocyanidin biosynthesis inand[J]., 2009, 21: 2323-2340.
[12] Gomez C, Terrier N, Torregrosa L,. Grapevine MATE-type proteins act as vacuolar H+-dependent acylated anthocyanin transporters [J].,2009, 150(1): 402-415.
[13] Chen S Y, Tang Y M, Hu Y Y,. FaTT12-1, a multidrug and toxin extrusion (MATE) member involved in proanthocyanidin transport in strawberry fruits [J]., 2018, 231: 158-165.
[14] 王鹏飞, 李鑫宇, 李明杰, 等. 地黄块根膨大发生和驱动的组织观察及激素相关基因的调控分析 [J]. 中国中药杂志, 2014, 39(17): 3245-3253.
[15] Hosoe N, Keima T, Fujimoto Y,. Transfection of protoplasts prepared fromleaves for plant virus research [J]., 2019, 2028: 145-151.
[16] Upadhyay N, Kar D, Deepak Mahajan B,. The multitasking abilities of MATE transporters in plants [J]., 2019, 70(18): 4643-4656.
[17] 陈丽, 耿金曼, 刘禹姗, 等. 越橘类黄酮化合物转运相关基因MATE的克隆与表达分析 [J]. 吉林农业大学学报, 2017, 39(2): 148-156.
[18] Thompson E P, Wilkins C, Demidchik V,. Anflavonoid transporter is required for anther dehiscence and pollen development [J]., 2010, 61(2): 439-451.
[19] Shitan N, Minami S, Morita M,. Involvement of the leaf-specific multidrug and toxic compound extrusion (MATE) transporter Nt-JAT2 in vacuolar sequestration of nicotine in[J]., 2014, 9(9): e108789.
[20] Weston L A, Ryan P R, Watt M. Mechanisms for cellular transport and release of allelochemicals from plant roots into the rhizosphere [J]., 2012, 63(9): 3445-3454.
[21] Morita M, Shitan N, Sawada K,. Vacuolar transport of nicotine is mediated by a multidrug and toxic compound extrusion (MATE) transporter in[J]., 2009, 106(7): 2447-2452.
Clone, subcellular localization and expression analysis oftransporter protein gene from
YANG Yan-hui1, YANG Heng1, ZHANG Zhong-yi2, YI Yan-jie1, LI Rui-fang1, DONG Chen1, ZHANG Zong-wu1, WANG Chao-jie1
1. College of Bioengineering, Henan University of Technology, Zhengzhou 450001, China 2. College of Crop Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China
To clone a multidrug and toxic compound extrusion gene () in, determine its subcellular localization and analyze its spatio-temporal expression pattern for further exploring its molecular function of secondary metabolite transports.gene, which was obtained fromtranscriptome data, was cloned by reverse transcription-polymerase chain reaction (RT-PCR) method. The structures, physicochemical properties, homology and phylogeny of RgMATE6 protein were analyzed by bioinformatic software. RgMATE6 was localized via the fusion expression system of its green fluorescence protein (GFP). The expression pattern ofgene was detected by quantitative real-time PCR (qRT-PCR) technology.The clonedgene sequence was 1892 bp in length. It encoded 524 amino acids, and its protein had two typical MatE domains and 12 transmembrane structures. Homologous and phylogenetic analysis revealed that RgMATE6 had a closed homology with VcMATE6 from. The transient expression of RgMATE6-GFP vector found that RgMATE6 localized in vacuolar membrane. The qRT-PCR analysis showed that the expression levels ofgene were higher in roots than in other tissues at various stages (especially tuberous expansion earlier stage).The RgMATE6 protein localized in vacuolar membrane, and the gene expression was higher inroots relative to stems and leaves at tuberous expansion earlier stages. The results preliminarily suggested that RgMATE6 may involve in the vacuolar transport process of secondary metabolite in.
Libosch; MATE transporter protein; bioinformatics; subcellular localization; expression analysis
R286.12
A
0253 - 2670(2021)06 - 1728 - 07
10.7501/j.issn.0253-2670.2021.06.022
2020-07-06
国家自然科学基金资助项目(81973417);河南省重点研发与推广专项(182102310606);国家重点研发计划项目(2017YFC1700705);河南工业大学科学研究基金项目(2017RCJH05)
杨艳会(1974—),女,硕士生导师,副教授,研究方向为药用植物分子生物学。Tel: (0371)67756928 E-mail: yyhui2004@126.com
[责任编辑 时圣明]

