培养基组分对水稻源Globotriose 合成酶异源表达的影响
亓 鑫,陶 璐,张芬淑,李拖平,李苏红
(沈阳农业大学 食品学院,沈阳110161)
Globotriose(Galα1-4Galβ1-4Glc)是一种具有特殊医疗用途的天然α-型低聚半乳糖,经研究发现它是SSEA4(Siaα2-3Galβ1-3GalNACβ1-3Galα1-4 Galβ1-4GlcCer)、SSEA3(Galβ1-3GalNACβ1-3Galα1-4Galβ1-4GlcCer)、GloboH(Fucα1-2GalNAcβ1-3Galα1-4Galβ1-4GlcCer) 等糖抗原的核心三糖结构, 同时也是中性鞘糖脂(globotriosylceramide,Gb3)的特异性识别域。该糖在预防治疗肿瘤、艾滋病以及抑制志贺氏毒素等方面有着显著效果,其合成与利用成为学术界研究热点之一[1-5]。 Globotriose 在自然界中以Globotriose-神经酰胺的形式存在,无法从天然产物中直接提取,难以大量合成制备,导致其价格极为昂贵,其合成方式以化学合成为主,经过加保护、脱保护、分离同分异构体等操作,过程繁琐,且易有化学残留污染。 酶法合成以其专一、高效、绿色等优点渐成主流[6-7]。 α-半乳糖苷酶(α-Galactosidase,α-Gal,EC3.2.1.22)属外切糖苷酶,能够专一性地催化半乳寡糖、半乳聚糖及含α-半乳糖苷的糖蛋白和糖脂质中α-半乳糖苷键的水解。 一些α-半乳糖苷酶在高底物浓度的条件下,还具有α-半乳糖苷转移酶活性。根据氨基酸序列的同源性,在Carbohydrate Active Enzymes Database 数据库中该酶分属于糖水解酶家族(glycoside hydrolase family,GH)的4,27,36,57,97,110[8-11]。 Globotriose 的酶法合成现有的途径正是利用GH27 族、GH36 族中具有转糖基作用的α-半乳糖苷酶,以UDP-半乳糖、2-脱氢半乳糖、4-脱氢半乳糖、6-脱氢半乳糖、对-硝基苯-α-D-吡喃半乳糖苷中的一种或几种为糖基供体,以乳糖为受体合成三糖,仍存在合成步骤多、底物成分复杂、合成效率低等瓶颈问题[12-13]。 课题组在前期研究中发现,一种水稻源GH36 族α-半乳糖苷酶具有特殊的转糖基能力,能够以肌醇半乳糖(galactinol)为供体,乳糖为受体一步合成Globotriose, 故将其命名为Globotriose 合成酶(Globotriose Synthase, GS)[14]。 糖基转移方程式为:Lactose +Galactinol⇌Globotriose+Myo-inositol+Galactose。 该方法操作方便、反应体系简单、产物易于分离纯化。 然而,GS 在重组大肠杆菌中的表达量和酶活力较低,成为该方法应用的最大限制因素。 影响重组大肠杆菌的表达的因素非常多,如细胞生长所需要的营养物质、发酵过程中生长抑制物的积累、溶氧浓度、培养温度、诱导方式、发酵液的pH 值及发酵液流变学特性等。其中,发酵液的组分、种类和浓度是影响重组菌表达的关键因素[11]。同时,基因工程菌株对不同目的蛋白的高效表达所需要的营养元素各不相同。 因此,有必要深入研究适合GS 大肠杆菌异源表达的培养基组成。本研究分别就基础发酵培养基种类、碳源、氮源、无机盐及其他辅因子的种类及浓度进行筛选,并最终确定最佳组分配比,以期为GS 的高效表达及Globotriose 酶法工业化生产提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
源于水稻的Globotriose 合成酶GS 基因的Gene Bank 序列号为No.BAD68247.1, 经PCR 扩增后该目的基因与大肠杆菌表达载体pET28a 连接构建质粒GS-pET28,并将该质粒转移至大肠杆菌表达菌株BL21 中获得基因工程菌GS-pET28/BL21。质粒GS-pET28、基因工程菌GS-pET28/BL21 菌株由沈阳农业大学食品学院实验室保存。 硫酸卡那霉素(kanamycin,Kana)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、二硫代苏糖醇(dithiothreitol,DTT)、4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES)、4-硝基苯基-β-D-吡喃半乳糖苷(p-Nitrophenyl-β-D-Galactopyranoside,pNP-G)及蛋白质marker 购于北京鼎国昌盛有限公司。 其他分析纯试剂均购于国药集团化学试剂有限公司。
1.2 仪器与设备
超声波细胞破碎仪(VCX130 型,美国Sonics 公司)和微型SDS-PAGE 电泳仪(VE-180 型,美国Bio-Rad公司)。
1.3 方法
1.3.1 基础发酵培养基的配制 LB 培养基:1%蛋白胨,0.5%酵母浸粉,1%NaCl。 SOB 培养基:2%蛋白胨,0.5%酵 母 浸 粉,10mmol·L-1NaCl,2.5mmol·L-1KCl,10mmol·L-1MgCl2。 SOC 培 养 基:2%蛋 白 胨,0.5%酵 母 浸 粉,10mmol·L-1NaCl,2.5mmol·L-1KCl,10mmol·L-1MgCl2,20mmol·L-1葡萄糖。 SB 培养基:3.2%蛋白胨,0.2%酵母浸粉,0.5%NaCl。 NB 培养基:1%蛋白胨,0.3%牛肉粉,0.5%NaCl。 将上述培养基调整pH 值至7.0 后,置于高温灭菌锅中,121℃灭菌20min。 其中,葡萄糖及后期试验的抗生素、碳源、无机盐及其他辅因子等需单独灭菌。
1.3.2 GS 粗酶液的制备 挑取冻存的基因工程菌GS-pET28/BL21,在LB 固体培养基上划线活化,并在37℃下培养。 挑单个菌落于5mL 的LB 培养基(含50μg·L-1Kana)中,37℃,180r·min-1摇瓶培养12h, 作为种子液接种于50mL 含有终浓度为50μg·L-1Kana、25μmol·L-1IPTG 及其他外源添加物的发酵培养基中。 在25℃,180r·min-1下扩大培养26h。 离心后,将湿菌体置于-20℃冷冻24h。 按照质量体积比1∶1 的比例加入pH 值7.0 的HEPESNaCl 缓冲溶液吹打悬浮,使菌体均匀分散,置于0℃冰浴中,在振幅为50%、工作3s 停歇5s 的参数下超声破碎3min。 菌体破碎后离心取上清,所得GS 粗酶液于4℃保存[15]。
1.3.3 GS 酶活力测定 GS 的本质是一种具有转糖基活性的α-半乳糖苷酶,其转糖的活性大小往往取决于其对α-半乳糖苷的水解能力,同时转糖基能力的测定较为繁琐费时,因而在监测培养过程中酶蛋白表达时通常采取更为方便快捷的pNP-G 显色法测定水解活性。 GS 酶活力测定参考LI 的[16]方法测定并略作修改。 一个酶活力单位(U)定义为每分钟分解pNP-G 释放1μmol·L-1对硝基苯酚所需的酶量。 将50μL 浓度为50mmol·L-1的pNP-G 和448μL 含有5mmol·L-1DTT pH=7.0 的McIlvaine 缓冲液混合,45°C 下预热10min, 加入2μL GS 粗酶液,45°C 下水浴10min,然后加入500μL 1mol·L-1碳酸钠终止反应。 以提前加入500mL 1mol·L-1碳酸钠终止反应后加入2μL GS 粗酶液的反应液作空白对照,在波长405nm 下测定反应液OD 值,代入公式,计算GS 酶活力(U·mL-1)。 并根据所测结果与酶液体积相乘计算GS 总酶活力(U)。

式中:OD2为实验组测得OD 值;OD1为对照组测得OD 值;V总为反应总体系;V 酶液为GS 粗酶液加入体积;t为反应时间;f 为稀释倍数。
菌体质量(g)即离心收集大肠杆菌湿菌体重量。

1.3.4 SDS 聚丙烯酰胺凝胶电泳 SDS 聚丙烯酰胺凝胶电泳参考PANWAR 等[17]的方法测定并略作修改,采用12%w/v 聚丙烯酰胺凝胶,用SDS-PAGE 法测定GS 的蛋白表达结果,电泳后凝胶用0.25%考马斯亮蓝R-250染色。 分子量Marker 为10-180 kDa。
1.3.5 基础发酵培养基种类筛选 依照1.3.1 中方法配置上述5 种细菌常规发酵培养基,以GS 酶活力、菌体质量及总酶活力为指标,筛选最佳基础发酵培养基种类[18-20]。
1.3.6 碳源筛选 在所选基础培养基中分别添加10mmol·L-1的葡萄糖、乳糖、半乳糖、蔗糖、甲醇、柠檬酸,以无外加碳源发酵培养基作为对照。考察GS 酶活力、菌体质量及总酶活力的变化。根据测定结果,选取总酶活力有提高的几种碳源,分别设置添加量为10,20,30,50,100mmol·L-1,比较不同浓度碳源对GS 酶表达的影响。
1.3.7 氮源筛选 在所选基础培养基中分别添加1mmol·L-1的硫酸铵、尿素、谷氨酸、天冬氨酸、赖氨酸、亮氨酸、精氨酸、半胱氨酸,以无外加氮源的发酵培养基作为对照。 根据GS 表达的酶活力、菌体质量及总酶活力测定结果,选取总酶活力有提高的几种氮源,分别设置添加量为1,5,10,20,50mmol·L-1,比较不同浓度氮源对GS酶表达的影响。
1.3.8 无机盐筛选在所选基础培养基中分别添加1mmol·L-1的KCl、FeCl3、FeSO4、MgSO4、MgCl2、MnCl、CoSO4、CaCl2、CuCl2和ZnSO4,以无外加无机盐的发酵培养基作为对照。 根据GS 酶活力、菌体质量及总酶活力测定结果,选取总酶活力有提高的几种无机盐,分别设置添加量为1,5,10,20,50mmol·L-1,比较不同浓度无机盐对GS 酶表达的影响。
1.3.9 其他辅因子筛选 在所选基础培养基中分别添加1mmol·L-1的维生素C、茶多酚、谷胱甘肽,以无外加其他辅因子的发酵培养基作为对照。 根据GS 酶活力、菌体质量及总酶活力测定结果,选取总酶活力有提高的几种辅因子,分别设置添加量为1,3,5,7,10mmol·L-1,比较不同浓度辅因子对GS 酶表达的影响。
1.3.10 数据处理 利用Excel 2019 和SPSS11.6 进行数据处理,利用Orgin2020 绘图。
2 结果与分析
2.1 基础培养基种类对重组GS 表达的影响
GS 由784 个氨基酸组成,推测分子量为85kDa。 由图1A 可知,在85kDa 处可见清晰的GS 条带,按蛋白表达量高低排序依次LB、NB、SOB、SOC 培养基,而在SB 培养基中未见蛋白表达。 由图1B 可知,5 种基础发酵培养基对重组大肠杆菌表达的影响各异, 其中经LB 培养基发酵制备的GS 表达量最大且总酶活力明显优于其他4种培养基。 SB 培养基几乎不表达,总酶活力最低。 综上所述,选择LB 培养基作为后续试验的基础发酵培养基。

图1 不同基础发酵培养基对GS 表达的影响Figure 1 Effect of different basal fermentation media on GS expression
2.2 碳源对重组GS 表达的影响
由图2A 可知,低浓度的葡萄糖、半乳糖、蔗糖有利于GS 的表达,且菌体质量也有着小幅度的上升,总酶活力显著增加。其他碳源对菌体质量的影响不大,但显著降低GS 的相对酶活力,从而降低GS 总酶活力。由图2B可知,随着葡萄糖浓度的提升GS 的相对酶活力、菌体质量、相对总酶活力均呈现先快速增加后快速降低的趋势。当葡萄糖添加量添加至20mmol·L-1时,相对酶活力及相对总酶活力达到最大,分别为对照组的1.5 倍及2.1倍。 随着半乳糖浓度的升高,GS 的相对酶活力、菌体质量、相对总酶活力同样呈现先快速增加后快速降低的趋势(图2C),且在添加量为10mmol·L-1时相对酶活力和总酶活力就达到最大,分别为对照组的1.4 倍及1.6 倍。蔗糖对GS 的相对酶活力、相对总酶活力的提升出现在较高浓度处,当添加量为50mmol·L-1时,相对酶活力及相对总酶活力达到最大,分别为对照组的1.6 倍及2 倍(图2D)。 当添加量过高达到100mmol·L-1时,由于过高的渗透压使得表达受到抑制。 虽然蔗糖对酶活力的提高有显著的效果,但葡萄糖组,在20mmol·L-1时,总酶活力就可以达到近似的效果,考虑经济因素,葡萄糖组要优于蔗糖组。 综上,碳源对GS 总酶活力提高的作用效果依次为:20mmol·L-1葡萄糖>50mmol·L-1蔗糖>10mmol·L-1半乳糖。 确定外加20mmol·L-1葡萄糖为最优碳源。
2.3 氮源对重组GS 表达的影响
由图3A 可知,低浓度的尿素、天冬氨酸、亮氨酸有利于GS 的酶活力性的表达,菌体质量变化不大,总酶活力明显增加。精氨酸的添加略微降低了GS 的相对酶活力,且差异不大。而其他氮源的添加显著降低了GS 的相对酶活力,对菌体质量影响不大,从而降低了GS 总酶活力。由图3B 可知,随着尿素浓度的提升GS 的相对酶活力、相对总酶活力均呈现先快速增加后快速降低的趋势,菌体质量在低浓度区变化不大,高浓度时快速降低。当尿素添加量添加至10mmol·L-1时,相对酶活力及相对总酶活力达到最大,均为对照组的1.4 倍。 低浓度的天冬氨酸对GS 的相对酶活力影响不显著,但菌体质量缓慢上升的趋势,总酶活力在添加量为5mmol·L-1时达到最大,仅为对照组的1.1 倍,差异未达到显著水平(图3C)。 由图3D 可知,亮氨酸浓度对GS 的相对酶活力及菌体质量的影响并不同步,出现双峰,在添加量为5mmol·L-1时相对酶活力和总酶活力达到最大,分别为对照组的1.4 倍及1.5 倍。 综上,能够提高GS 总酶活力的氮源排序如下:5mmol·L-1亮氨酸>10mmol·L-1尿素>5mmol·L-1天冬氨酸,外加5 mmol·L-1亮氨酸对重组GS 的表达促进效果最为显著。
2.4 无机盐对重组GS 表达的影响

图2 不同碳源对GS 表达的影响Figure 2 Effect of different carbon sources on GS expression
由图4A 可知,低浓度的KCl、FeSO4 显著提高GS 的相对酶活力、菌体质量以及总酶活力。 ZnSO4对GS 的相对酶活力、菌体质量以及总酶活力的影响不大,其他无机盐的添加均显著降低了GS 的相对酶活力,但对菌体质量的影响不大。FeCl2的添加虽然显著增加了菌体质量,但极显著地降低了GS 的相对酶活力,从而降低GS总酶活力。 由图4B 可知,当KCl 添加量添加至1mmol·L-1时,相对酶活力及相对总酶活力达到最大,分别为对照组的1.1 倍和1.3 倍,而菌体质量并无显著变化,此后虽然菌体质量持续增加,但相对酶活力降低显著。 由图4C 可知,添加FeSO4有益于菌体生长,至1mmol·L-1时,相对酶活力及相对总酶活力达到最大,分别为对照组的1.3 倍和2 倍,随后酶活力迅速降低。综上,提高GS 总酶活力的无机盐排序为:1mmol·L-1FeSO4>1mmol·L-1KCl,1mmol·L-1FeSO4对酶活力性表达促进效果最为显著。
2.5 其他辅因子对重组GS 表达的影响
由图5A 可知,低浓度的维生素C 显著提升了菌体质量进而提高总酶活力。茶多酚对GS 表达无显著影响,谷胱甘肽对菌体质量影响不大,但由于相对酶活力的降低,导致总酶活力下降。 由图5B 可知,随着维生素C 浓度的提升GS 的相对酶活力、菌体质量、相对总酶活力均呈现先增加后降低的趋势。 当维生素C 添加量添加至3mmol·L-1时,相对总酶活力达到最大,为对照组的1.6 倍。当维生素C 添加量添加至5mmol·L-1时,相对酶活力达到最大,为对照组的1.2 倍。 但此时菌体质量下降较为明显,导致总酶活力略有下降。 综合考虑选择3mmol·L-1的添加量最为合适。 综上,以LB 为基础培养基,额外添加20mmol·L-1葡萄糖、5mmol·L-1亮氨酸、1mmol·L-1FeSO4以及3mmol·L-1维生素C 可以有效提高GS 的表达,经验证利用该培养基配方在50mL 培养体系中,总酶活力提高4 倍,达到8.65U。
3 讨论与结论

图3 不同氮源对GS 表达的影响Figure 3 Effect of different nitrogen sources on GS expression
通过上述因素的分析,发现基础培养基种类、碳源、氮源、无机盐及维生素C 等均对大肠杆菌表达重组GS具有显著的影响。本研究中,5 种基础发酵培养基对GS 表达的影响各异,LB 组表达量最高,NB 组其次,SOB 和SOC 组次之且差异不大,SB 组几乎不表达。分析几种基础培养基成分发现,利用LB 和NB 组制备的GS 相对酶活力最高,比较两种培养基的组分发现NB 培养基中的牛肉膏含量与LB 培养基中的酵母粉含量几近相同,Na-Cl 含量是LB 的一半。 因此可以初步推断,牛肉膏和酵母粉对于促进GS 异源表达的功效几乎相同,而NaCl 含量的减少,降低NB 组的菌体质量,进而降低NB 组的总酶活力。 相较SOB 组与SOC 组,其相对酶活力差异不大,仅因SOC 培养基组分中比SOB 增加了20mmol·L-1的葡萄糖,从而导致其菌体质量大幅度上升,进而提升了总酶活力。同时,SB 组、SOB 组与LB 组组分比较,二者蛋白胨含量分别是LB 组的3 倍及2 倍,与GS 相对酶活力呈现显著的负相关,这可能是因为过高的蛋白胨浓度抑制GS 的活性表达,解婉莹[21]在优化水稻α-半乳糖苷酶氮源时也得到了相同的结论。 而SOB 组与LB 组还增加了一些无机盐,其菌体质量也高于LB 组,这也同样印证了在培养基中适当添加一些无机盐可以提高菌体质量。
随着葡萄糖浓度的提升GS 的相对酶活力、 菌体质量、 相对总酶活力均呈现先快速增加后快速降低的趋势。 这可能是因为添加一定量的葡萄糖可以提高菌体的代谢活性,增加目的蛋白的表达量,而葡萄糖添加过量时容易导致葡萄糖效应,使得重组大肠杆菌内部启动子lac mRNA 作用受到抑制[22],从而降低酶的表达量。随着半乳糖浓度的提升GS 的相对酶活力、菌体质量、相对总酶活力同样呈现先快速增加后快速降低的趋势。 这可能是因为半乳糖除了作为微生物发酵基本碳源外,对酶的表达也能起到一定的诱导作用,在低浓度的时候可以提高GS 的相对酶活力,但是在高浓度添加时,可能会让GS 聚合成难容的包涵体,导致酶活力的降低[23]。
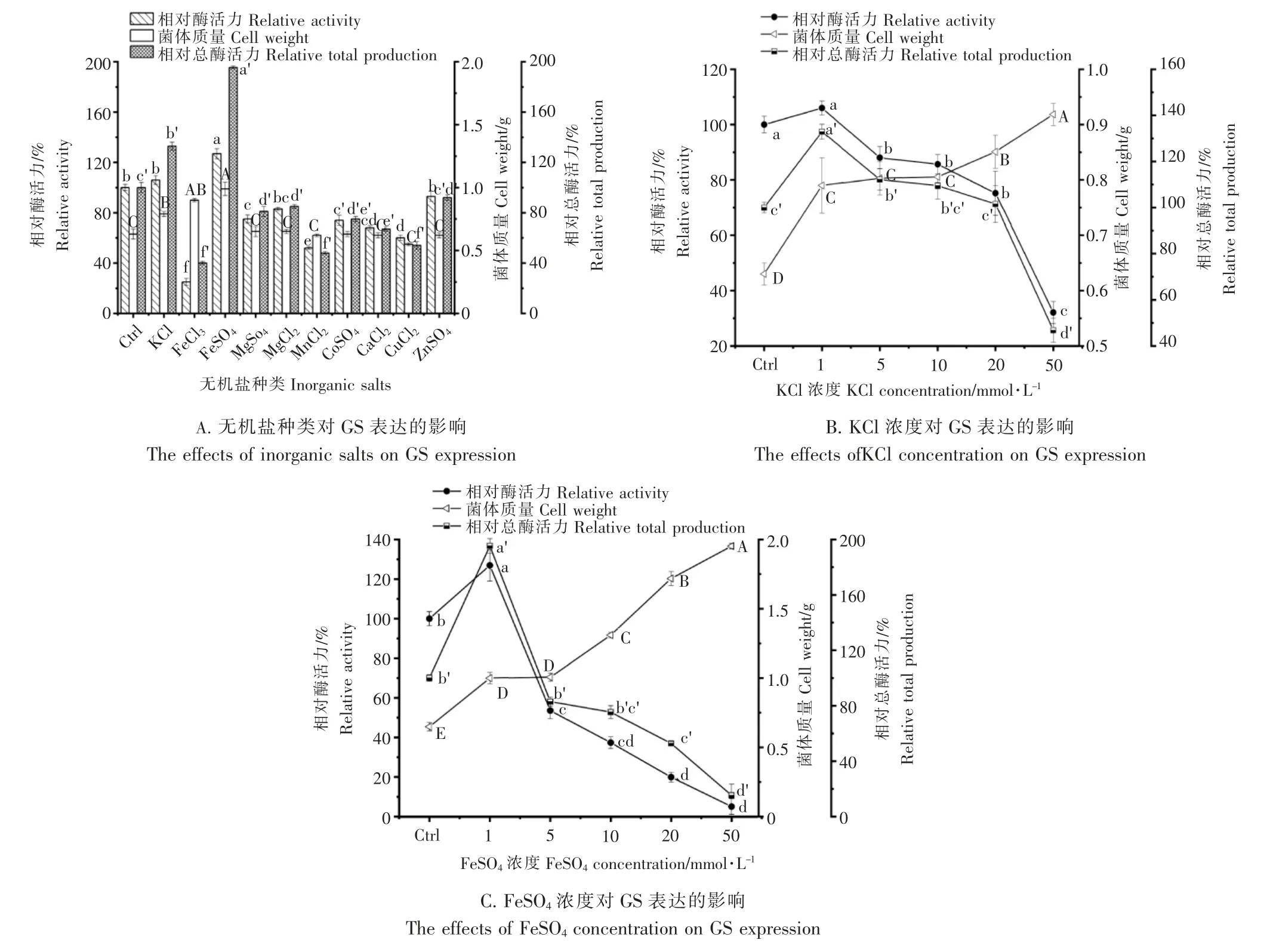
图4 不同无机盐对GS 表达的影响Figure 4 Effect of different inorganic salts on GS expression
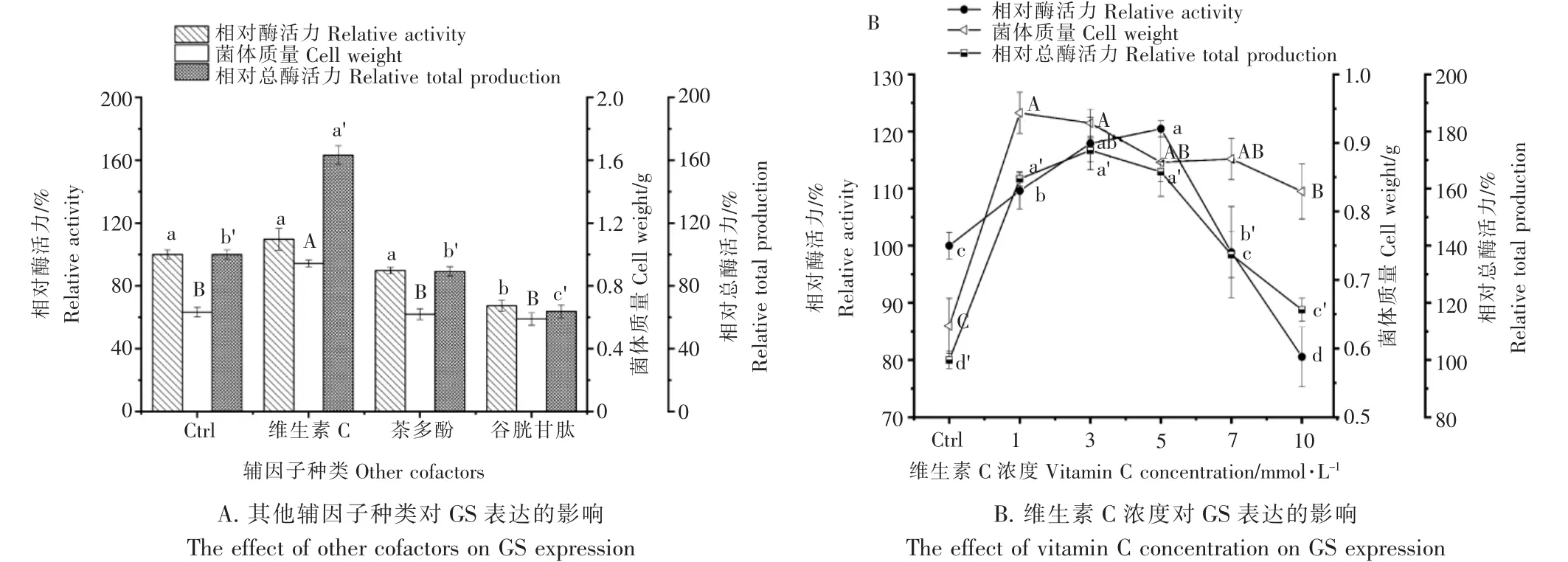
图5 不同其他辅因子对GS 表达的影响Figure 5 Effects of different cofactors on GS expression
培养基中的无机盐通常需要量少而作用显著,很多金属元素是某些酶的激活剂,在培养基中适量的添加可以提高酶的表达与活性[24-25]。 朱才庆等[26]发现,在BL21(λDE3)的培养基适量添加一些FeSO4可以促进其生长,同时也能提高乙酸的表达。但是过多的添加无机盐会增加培养体系的渗透压,从而抑制酶的表达。本研究中发现,同样是铁元素,Fe2+与Fe3+均可以促进大肠杆菌生长繁殖,从而提高菌体质量,但是Fe3+对相对酶活力的抑制作用明显,这可能是因为Fe2+比Fe3+还原性强,可以进一步的提高重组蛋白表达,在后续筛选部分水溶性抗氧化剂作为GS 表达的辅因子时发现,维生素C 对提高GS 表达具有明显的增益效果,这可能是因为维生素C 氧化还原作用,可以使得-SH 反应生成-S-S-,稳定重组蛋白结构,进而提高酶活力,这与DONG 等[27]的结论较为相似。 研究培养基组分对重组酶表达的影响,是提高酶活力及产量最为直接有效的方法之一,本研究通过对培养基成分的筛选优化,显著提高了GS 酶活力及产量,将为Globotriose 的高效生物转化研究及其在医药、食品生产领域的应用提供有效途径,同时也为同类酶的高效表达提供参考。
——化工原料、农副产品

