原发性干燥综合征患者感染相关因素的研究
杜晶晶,王桂琴
(山西医科大学基础医学院微生物免疫教研室,太原 030001)
原发性干燥综合征(primary Sjogren syndrome,pSS)是一种主要累及外分泌腺的高度异质性自身免疫性疾病,pSS患者体内免疫系统的缺陷,B细胞激活产生高滴度对抗自身抗原的抗体,其中丙型肝炎病毒(hepatitis C virus,HCV)、EB病毒(Epstein-Barr virus,EBV)、巨细胞病毒(cytomegalo virus,CMV)[1-4]等与疾病发生、发展密切相关。糖皮质激素、免疫抑制剂及生物制剂作为目前主要治疗手段,来控制和延缓自身免疫反应引起组织器官损害,但在控制病情的同时也降低了患者免疫功能,进而增加了感染风险。本文旨在通过总结pSS患者感染情况,分析感染与外周血淋巴细胞亚群及实验室指标的相关性,为临床pSS的诊治提供新的医学证据,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2019年6月山西白求恩医院风湿免疫科住院诊治的340例pSS患者为研究对象。纳入标准:(1)均符合2012欧美共识小组(AECG)诊断标准[5]的pSS患者;(2)年龄大于或等于18岁。排除标准:(1)妊娠期妇女;(2)合并其他自身免疫性疾病;(3)合并血液系统疾病、恶性肿瘤;(4)合并重要器官衰竭。间质性肺炎诊断参照2011年美国胸科学会和欧洲呼吸学会(ATS/ERS)制订的特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)诊断标准[6]。将pSS患者分为感染组与未感染组,pSS感染组133例:连续3 d出现非疾病活动所致发热(体温大于38 ℃),或存在相应感染的临床症状、体征及相关辅助检查结果,或血、尿、便及痰等标本培养出病原微生物的pSS患者。pSS未感染组207例:无感染的临床症状及未培养出病原体的pSS患者。两组一般临床资料、实验室数据及病原体检查结果比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1仪器与试剂
贝克曼库尔特公司FC500流式细胞仪及其配套的淋巴亚群检测试剂,包括四色淋巴细胞亚群试剂CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5(PN.6607013)和CD45-FITC/CD56-RD1/CD19-ECD/CD3-PC5(PN.6607073)。血常规使用贝克曼LH750全自动血细胞分析仪检测。免疫球蛋白(Ig)G、IgA、IgG、类风湿因子(RF)、补体(C)3、C4使用贝克曼奥林巴斯5800全自动生化分析仪检测,其试剂及配套校准品等购自德国DiaSys公司。
1.2.2检测方法
所有研究对象清晨空腹抽取静脉血2 mL,乙二胺四乙酸二钾(EDTA-K2)抗凝血2管,3 mL枸橼酸钠抗凝血1管,4 mL非抗凝血1管离心分离血清。外周血淋巴细胞亚群检测:取2支流式试管,分别标记为45/4/8/3FC和45/56/19/3FC,用反向加样法分别将100 μL抗凝血加入试管中,分别在管中依次加入相对应的四色抗体10 μL,将上述试管涡旋混匀,室温避光放置15~20 min取出试管,每管加入溶血素Opitilyse C,涡旋混匀,室温避光放置10 min后取出试管,每管加入500 μL磷酸盐缓冲液(PBS),室温平衡5 min,取出Flow-Count荧光微球,涡旋震荡混匀10~12 s,以反向加样法在各管中加入100 μL荧光微球,充分涡旋混匀,2 h内上机检测。免疫球蛋白、C3、C4、C反应蛋白(CRP)、RF采用免疫透射比浊法,血沉采用魏氏法,严格按照试剂说明书进行操作。
1.3 统计学处理
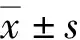
2 结 果
2.1 感染率
340例pSS患者中133例(39.1%)发生感染,其中细菌感染55例(41.3%),真菌感染30例(22.5%),病毒感染48例(36.2%),其中EBV 38例,CMV 5例,流感病毒5例。
2.2 感染部位
340例患者中141例合并间质性肺炎,按感染部位数量排序依次为:呼吸系统、泌尿系统、消化系统、血液系统、皮肤感染、腹膜炎、中枢神经系统、口眼感染,见表1。单个部位感染有72例(54.5%),2个及2个以上部位感染61例(45.5%),其中2个部位感染41例,3个部位感染20例。

表1 pSS感染部位情况分析[n(%)]
2.3 两组实验室指标比较
与未感染组比较,感染组红细胞(RBC)、血红蛋白(HB)、清蛋白(ALB)、淋巴细胞计数(LYM)、IgA、CD3+T细胞、CD4+T细胞、CD8+T细胞、B细胞降低,中性粒细胞绝对值(NEU)、红细胞沉降率(ESR)及CRP升高,差异有统计学意义(P<0.05)。感染组76例合并间质性肺炎,未感染组65例合并间质性肺炎,两组比较,差异有统计学意义(P<0.05),见表2、图1。

表2 两组实验室指标比较
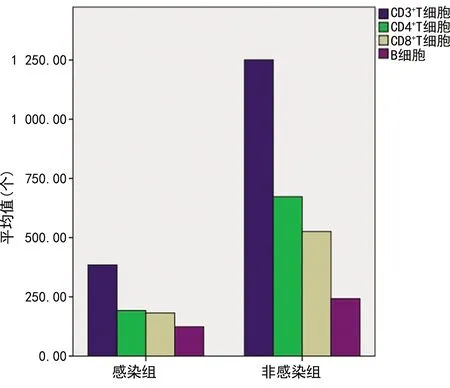
图1 感染组与非感染组淋巴细胞亚群条形图
2.4 感染与各指标相关性分析
感染与RBC、HB、ALB、CD3+T、CD4+T、CD8+细胞、B细胞及IgA呈负相关(P<0.05),与间质性肺炎、NEU和CRP呈正相关(P<0.05),见表3。

表3 感染与各指标的相关性分析
3 讨 论
目前研究证明遗传因素、环境触发、自身免疫失衡与pSS发病机制有关[7],感染已成为风湿病患者诊疗中常见和棘手的问题,患者免疫系统存在多种异常,且长期接受激素、免疫抑制剂等治疗,较易发生感染[8]。一项对重症监护室pSS患者研究发现,其进入ICU病房的主要原因是感染,然后是器官功能障碍,疾病活动度评分越高的患者预后不良,50%的死亡率归因于pSS疾病本身,25%死亡率归因于感染[9]。本组340例pSS患者中,明确感染133例,所占39.1%,感染者中病原体多为细菌,与患者免疫力降低有关,且近年来pSS合并真菌感染越来越多[10-11],糖皮质激素、免疫抑制剂的使用使患者机会性感染增多,临床医生需引起足够重视。
从感染部位来说,呼吸道感染居首位,本组63例呼吸系统感染患者中有39例为pSS合并间质性肺炎患者,占呼吸系统感染患者总数61.9%,间质性肺炎发病机制可能是自身免疫反应激发机体炎性反应,导致肺间质及肺泡炎性细胞大量聚集,引起肺泡上皮损伤,炎性细胞释放细胞因子和炎性介质,导致肺纤维化持续紧张[12],因此pSS间质性肺炎患者易合并呼吸系统感染。研究表明更易发生发热、干眼症、麻木等临床症状,间质性肺炎是影响pSS预后不良及死亡主要原因[13]。此外,泌尿系统感染也较常见,以下尿路感染居多,应引起临床医师重视。
本研究发现pSS感染患者RBC、HB、ALB降低、中性粒细胞升高、淋巴细胞减少(P<0.05),这些均使患者易发生感染。国际SS临床合作联盟(SICCA)对1 927例患者研究发现,pSS腺体外损害主要在免疫系统和血液系统[14],pSS易合并血液系统损伤,可能是免疫复合物及自身抗体吸附在血细胞表面,破坏其膜结构使其寿命缩短,且与红细胞生成过程中铁利用及铁代谢平衡紊乱有关,炎症性细胞因子如肿瘤坏死因子、白细胞介素-1及干扰素等生成增多,造成红细胞寿命缩短,红细胞集落生成受损及网状内皮系统贮存铁动员障碍[15]。感染组CRP与ESR(P<0.01)高于非感染组,CRP和ESR作为pSS疾病活动性指标与疾病活动性及感染密切相关。pSS感染患者ALB和IgA明显降低(P<0.05),ALB由肝脏合成,因此ALB降低可能与肝脏受损有关,同时ALB维持血浆渗透压,可通过影响转录因子、炎性细胞表达,发挥抗炎作用,pSS肾脏肾小球滤过膜易受损害,ALB由尿液排出,也导致ALB降低[16]。国外一项研究也指出系统性红斑狼疮(SLE)、类风湿性关节炎(RA)和pSS患者血清ALB降低[17]。作为必不可少的载体蛋白,ALB降低会打破机体微量元素稳态,使患者体内铜、铁、锌失衡。IgA分为分泌型和血清型,是呼吸道和消化道腔内主要免疫球蛋白,在黏膜免疫发挥重要作用,IgA水平降低时,易发生反复感染,IgA缺陷患者常发生复发性呼吸道感染,部分可发展为复发性下呼吸道感染或支气管扩张[18]。本研究未显示pSS患者补体与感染有相关性。
目前为止,pSS发病机制尚不明确,免疫系统紊乱在pSS发病机制中的作用已经得到证实,本研究发现pSS合并感染患者外周血CD3+T、CD4+T细胞、B细胞绝对计数明显降低,提示与感染密切相关。T、B细胞在pSS疾病发生、发展中起着重要作用,T细胞介导细胞免疫,B细胞产生抗体执行体液免疫功能,当病原体入侵时,T、B细胞可特异识别抗原,增殖分化,介导适应性免疫应答清除病原微生物。有研究显示与健康人相比,pSS患者外周血中Th细胞和杀伤性T(Tc)细胞数量减少[19],CD4+T细胞在控制自身免疫、免疫稳态及对病原体和肿瘤抗原的免疫应答等方面发挥中心作用,本研究显示感染与CD3+T、CD4+T、CD8+T细胞、B细胞呈负相关(P<0.05),与武晓燕等[20]对SLE感染患者研究结果一致,感染患者外周血淋巴细胞亚群绝对计数都是明显降低的,目前感染作为pSS发病致病因素研究颇多,而对患者患病后引发感染明显关注不足,且与SLE和RA相比,临床对pSS不够重视。一项对自身免疫性疾病患者的研究表明,年龄、糖尿病史、癌症史及利妥昔单抗治疗前CD4+T细胞水平降低是发生严重感染的危险因素[21]。秦岭等[22]对SLE患者研究显示合并机会性感染者CD3+、CD4+、CD8+T细胞均明显减少,尤其CD4+T细胞严重减少时需要高度警惕感染发生。任立敏等[23]研究表明淋巴细胞减少,特别是CD4+T细胞减少,及联合使用两种以上免疫抑制剂与CMV感染风险增加有关。WANG等[24]研究表明pSS患者发生非霍奇金淋巴瘤(NHL)风险较其他恶性肿瘤更高,B细胞和T细胞在pSS和NHL发病过程中起重要作用,免疫调节剂可能增加并发NHL风险,CD4+T细胞减少是预测NHL重要指标,因此临床应密切关注患者治疗过程中外周血淋巴细胞亚群变化,及时调整治疗方案。
综上所述,合并间质性肺炎、贫血、ALB及IgA水平降低的pSS患者易发生感染,感染者体内存在免疫抑制,CD3+T、CD4+T、CD8+T细胞、B细胞明显降低,控制原发病同时需密切关注外周血淋巴细胞亚群计数情况,以防止感染发生。

