基于化学核心素养培育的教学设计
摘 要:著名化学家傅鹰教授曾说:“化学是实验的科学,只有实验才是最高法庭。”本文以《化学反应原理》中“钢铁的吸氧腐蚀”这一教学难点为例,基于发展学生核心素养为目的确立本课时教学目标,将吸氧腐蚀原理的深度探究作为教学重点,主要从“宏观辨识与微观探析”“实验探究与创新意识”两个维度,探讨如何在教学中有效地应用探究实验,发展学生的化学核心素养。
关键词:化学核心素养;吸氧腐蚀;宏观辨识;微观分析;探究实验
一、教学主题内容与现状分析
吸氧腐蚀是苏教版化学选修1专题1第三单元《金属的腐蚀与防护》的部分内容。很多教师在“钢铁的吸氧腐蚀”教学过程中,弱化了实验的教育功能,大多依赖动画演示配合理论教学,只重视学生对原理的记忆和其在解题中的运用,很少引导学生深度探究这些原理产生的过程。这种处理方式失去了通过实验探究促进学生理论发展实验素养的教育契机,教学效果大打折扣,尤其是突破吸氧腐蚀原理这一教学难点,导致学生对吸氧腐蚀的知识仍停留在死记硬背的学习模式中,课标要求的落实也只是纸上谈兵。
《普通高中化学课程标准(2017年版)》明确指出,发展学生化学核心素养的关键,要求教师积极开展素养为本的课堂教学实践。在新课标的引领下,教师在课堂上除了要传授学生化学理论知识,还应该注重对学生实践探究能力的培养,加强化学知识与实际生活的联系。在实际教学过程中如何渗透、发展学科核心素养,教师扮演着总导演的角色。本文从“宏观辨识与微观探析”“实验探究与创新意识”两个维度出发,探讨如何在教学中有效地应用探究实验,对吸氧腐蚀原理进行深度学习,发展学生的化学核心素养。
二、教学设计思路及目标确定
(一)设计思路
很多同学对吸氧腐蚀过程中为什么正极是氧气参与反应半信半疑,只能死记硬背电极反应式等结论。帮助学生析疑解惑的有效办法是进行实验探究,验证钢铁吸氧腐蚀两极反应的产物。本节课采用宏微观结合、循序渐进的方法分析钢铁吸氧腐蚀,主要从模拟轮船在海水中的腐蚀实验、创新性的铁片实验和有效性的数字化实验,深度探究吸氧腐蚀的反应原理、能量转化、应用价值。利用原电池原理分析钢铁吸氧腐蚀,提高知识的理解和运用,符合先理论后实践的认知规律,同时也体现了化学学科学以致用的初衷。
(二)教学目标
1.通过创新实验设计,将传统实验与数字实验有效融合,从宏观、微观、符号和曲线等化学“四重表征”加深对吸氧腐蚀原理的理解,学生会书写电极反应式和总反应式。
2.通过实验探究钢铁吸氧腐蚀的反应原理和能量转化等活动,培养实验操作能力和运用所学知识分析问题、解决实际问题的能力,体會科学探究的一般过程。
3.通过自制暖宝宝和市售暖宝宝的对比分析,达到学以致用的目的,学会辩证地看待问题。
三、教学实录
(一)创设情境,宏观辨识,提出问题
[教师]为了增强实验的对比性,将课本实验稍做改进,模拟轮船在海水中的腐蚀。取两支具支试管标注1和2,设计两组对比实验。实验I用饱和食盐水润湿具支试管1内壁,将混合好的铁粉和活性炭粉均匀地撒在内壁,将导管伸入滴有红墨水的试管中。实验II用饱和食盐水润湿具支试管2内壁,只将铁粉均匀地撒在内壁,将导管伸入滴有红墨水的试管中。
[学生]实验I 试管中导管内的水柱明显上升,实验II试管中导管内的水柱短时间内无明显变化。
[教师]显然实验I发生的反应速率比实验II快。实验I导管内的水柱上升的原因是什么?实验I具支试管中有哪些物质参与反应?实验中活性炭粉有什么作用?
[学生]导管内水柱上升的原因是体系内压强减小,推测体系内有气体参加反应。
[教师]可能是什么气体参加反应呢?反应过程中有没有OH-生成?铁反应的产物是Fe2+还是Fe3+?如何验证?
[学生1]反应过程中是否有OH-生成?可以滴加酚酞试液进行检验。
[学生2]铁反应产物的检验,可转化为Fe2+和Fe3+的检验。若铁反应的产物是Fe3+,则滴加硫氰化钾溶液,溶液变成血红色;若铁反应的产物是Fe2+,则滴加铁氰化钾溶液,会生成蓝色沉淀。
(二)质疑寻证,模拟实验,深度探究
[老师]检验方法已形成,假如老师给你提供一块已经除去铁锈的不纯铁片,你会如何模拟上述腐蚀的反应环境?
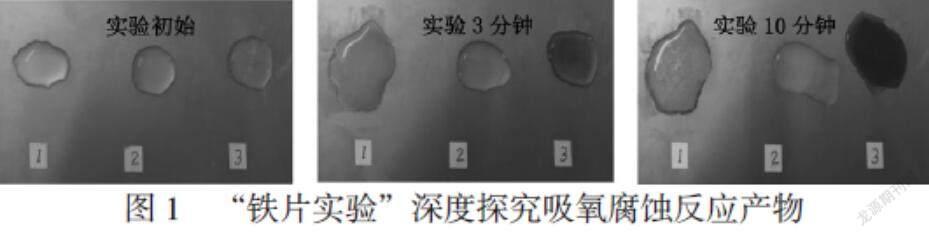
[学生]在不纯铁片上标记1,2,3三个位置,标记1位置滴加10滴饱和食盐水和3滴酚酞溶液,标记2位置滴加10滴饱和食盐水和3滴硫氰酸钾溶液,标记3位置滴加10滴饱和食盐水和3滴铁氰化钾溶液。(见图1)
[教师]这个“铁片实验”的操作方案值得推广。通过实验现象的观察,同学们得出什么结论?又有哪些疑问?
[学生结论]铁片上标记2位置无颜色变化。标记3位置有蓝色沉淀生成,说明铁发生氧化反应的产物是Fe2+。
[学生疑问]铁片上标记1位置为什么最先看到液滴边缘区域溶液变红?
[教师]说明反应后液滴边缘区域溶液显碱性使酚酞变红。液滴覆盖的铁片区域,除了铁发生反应,还有什么物质参与反应且生成OH-?
[学生1]依据元素守恒原理,只可能是O2或H2O参与反应。
[学生2]根据图1实验已做出“体系内压强减小”的推测,只可能是O2参与反应。
[学生3]根据图2实验铁发生氧化反应的产物是Fe2+,那必然有物质发生还原反应,只可能是O2得电子生成OH-。
[教师]同学们的思考推理很有逻辑性。液滴边缘区域O2浓度大易得电子,生成OH-,故最先看到液滴边缘区域溶液变红。
(三)手持技术,创新实验,突破难点
[教师]老师借助氧气传感器、温度传感器等,进一步探究钢铁在氯化钠溶液中的腐蚀情况。将滤纸用饱和氯化钠溶液润湿后,贴在广口瓶内壁,将2.0g铁粉和2.5g活性炭粉充分混合,均匀地撒在广口瓶内壁滤纸上。迅速塞上带有氧气传感器和温度传感器的橡皮塞,连接数据采集器和电脑显示器。点击数据采集器,通过显示器上的实验数据变化,直观感受装置内O2的体积分数逐渐减小和温度逐渐升高的变化情况。
[追问]物质变化的同时伴随着能量变化,请思考钢铁发生吸氧腐蚀的过程中,除了化学能转化为热能,是否存在其他形式的能量转化?吸氧腐蚀是否属于电化学腐蚀?
[学生]还存在化学能转化为电能。
[教师]如何设计实验验证吸氧腐蚀属于电化学腐蚀?
[学生1]根据原电池原理设计实验装置,用铁片、石墨棒作为电极,氯化钠溶液作为电解质溶液,连接上电流表,观察电流表指针是否发生偏转。
[学生2]我们小组除了电流表,还连接了音乐发声器,闭合开关,音乐发声器响起,电流计指针发生偏转。
[学生3]我们小组既看到电流表指针发生偏转,还检测到装置体系温度上升1~2℃,铁片、石墨棒和氯化钠溶液构成原电池,即钢铁吸氧腐蚀属于电化学腐蚀。钢铁吸氧腐蚀过程化学能转化为热能和电能。
(四)吸氧腐蚀,辩证看待,科学应用
[教师]化学是一把双刃剑,不仅要了解钢铁吸氧腐蚀造成生锈不利的一面,更要关注其可用之处。请结合生活经验想一想吸氧腐蚀在生产生活中的应用。
[学生]暖宝宝、铁系脱氧劑……
[教师]如果你是公司的一名产品研发设计师,你会如何设计暖宝宝?设计过程中需要考虑哪些问题?
[学生]需要考虑选用的试剂及装试剂的袋子。选用的试剂有还原铁粉、活性炭粉和NaCl固体,还需要透气不透水的高分子材料袋和使体系保温的物质。
[教师]这位设计师考虑得很到位!同学们会发现,市售的暖贴成分表中有两种特殊的物质:蛭石和吸水性树脂。蛭石,是一种硅酸盐矿物,是一种超级保温的材料。吸水性树脂,是为了储存足够水分,让化学反应更持久,也就是让暖宝宝持续发热的时间更长。使用过的暖贴,放置数天后的产物经检验是铁锈,所以暖宝宝的发热原理就是吸氧腐蚀的原理。
(五)思维导图,总结反思,深化理解
学生反思,回顾本节课所学内容,以小组为单位,绘制“探究钢铁吸氧腐蚀”的思维导图,归纳总结本节课所学的内容和收获。以学生绘制思维导图的方式进行课堂小结,既可以让学生回顾再现反思本节课的学习研究过程,又可以深化理解所学知识,使知识内容结构化,也发展了模型认知的核心素养。
四、教学效果与反思
本节课符合“学生为主体,教师为主导,探究过程为主线,培养学科素养为主旨”的新课程教学理念。从学情出发,找到学生的最近发展区,通过模拟轮船在海水中腐蚀的实验和铁片实验的设计,宏观辨识,质疑寻证,深度学习,明晰吸氧腐蚀的反应原理。借助“铁片实验”,采用“问题链”教学法,层层递进,引导学生观察分析实验现象,建立铁粉和活性炭粉混合在氯化钠介质中发生原电池反应的模型。将传统实验与数字实验有效融合,将吸氧腐蚀的微观反应可视化,引导学生用数字实验去解决疑难问题,感受数字实验在化学学习中的应用价值。学生以实验手段获取宏观现象,并从微观角度讨论其本质,建立起“宏观—微观—符号—曲线”化学四重表征的联系,发展了宏观辨识与微观探析、实验探究与创新意识等化学学科素养。
从本节课的课前预设和课堂实际教学完成度来看,本节课还有很多可以改进的地方。比如:(一)利用数字化的手持技术实验突破吸氧腐蚀原理的教学难点,帮助学生深入理解金属吸氧腐蚀的原理。若能让学生分组自己操作,体会实验的全过程,对理解掌握其原理更有帮助。(二)数字化实验中改进装置只使用了氧气传感器和温度传感器,若能将压强传感器一起使用其中,会使整个实验更具直观性和说服力。
参考文献
[1]王祖浩.普通高中教科书:化学反应原理(选择性必修1):1版[M].南京:江苏凤凰教育出版社,2021:29-31.
[2]马云云,吴星.提升核心素养促进自主学习[J].中学化学教学参考,2018,3:42-44.
[3]中华人民共和国教育部.普通高中化学课程标准.2017年版[M].北京:人民教育出版社,2018.
[4]徐泓,朱敏,魏明贵,吴星.铁粉吸氧腐蚀系列实验的设计及应用[J].化学教学,2015,4:63-66.
作者简介:李秀凤,(1981.09-),女,福建莆田人,汉族,莆田华侨中学一级教师,本科。研究方向:中学化学教育教学。
3631501908285

