超声造影在移植肾动脉狭窄诊断及疗效监测中的应用
杨鹏凤 梁伟翔 冯梓燕 周 苗 禄安涛,2 丁晓飞 麦舒婷 黄贵廉 蔡瑞明
移植肾动脉狭窄(transplant renal artery stenosis,TRAS)是肾移植后最常见的血管并发症之一,常见于术后3个月至2年,不同中心报道发生率为1%~23%[1]。TRAS的狭窄部位主要发生入肾前的大血管处,即髂血管与主肾动脉的吻合口处,其次是吻合口以远的主肾动脉,极少出现在移植肾内的各级动脉。难治性高血压、少尿、移植肾功能减退是TRAS主要的表现,严重者可出现移植肾失功能需要切除移植肾[2]。计算机断层扫描血管造影(computed tomography angiography,CTA)是诊断TRAS的金标准[3],但检查所需的放射性造影剂具有肾毒性[4],限制了CTA在移植肾的广泛应用。近年来介入手术的必要性成为了TRAS治疗的热点。研究显示,介入术后仍有5.5%~20%的几率出现再狭窄或其他严重并发症[5],即使采用介入术治疗6个月,再狭窄率也有4.2%[6],甚至有出现移植肾功能衰竭的报道[7]。也有学者报道部分狭窄的动脉可自行好转的案例[8-9]。因此,探索安全、有效诊断及动态评估TRAS的方法是目前的难题。
超声造影(contrast-enhanced ultrasound,CEUS)能直观显示TRAS的狭窄部位及定量微循环灌注,且造影剂声诺维微泡代谢是通过呼吸排出,无放射性污染及肾毒性,即使在肝肾功能异常时仍具有良好的安全性[10]。CEUS独特之处在于能获得时间-强度曲线(cortical time-intensity curve,TIC),通过选取测量移植肾不同感兴趣区(region of interest,ROI)定量显示移植物的血流灌注,以鉴别移植肾并发症[11]。Grzelak等[12]通过TIC得出TRAS患者造影剂到达皮质的时间更长,提示狭窄影响了移植肾内微循环灌注。然而,目前CEUS在TRAS的研究仍较少,尤其在通过定量分析指导治疗策略方面。本研究旨在通过回顾性分析TRAS患者的诊断与疗效,评估CEUS在TRAS诊断及疗效监测的临床意义。
对象与方法
研究对象选择2015年5月至2019年6月期间,在广州医科大学附属第三医院接受了肾移植的患者共376例。患者多普勒超声显示移植肾动脉吻合处或移植肾动脉主干收缩期峰值流速(peak systolic velocity,PSV)>180 cm/s,且出现以下一种或多种表现时考虑为TRAS:(1)尿量进行性减少;(2)估算肾小球滤过率(estimated glomerular filtration rate,eGFR)逐渐降低,双下肢水肿;(3)难治性高血压。最后共34名患者纳入本研究,其中男性25例,女性9例,中位年龄为37(23~63)岁。原发病:慢性肾小球肾炎20例,肾病综合征6例,IgA肾病3例,糖尿病肾病2例,多囊肾2例,海绵肾1例。均为成人尸肾供肾。根据CTA的检查结果,本研究患者分为两组:TRAS组(18例)和对照组(16例)。
诊断标准与治疗原则CTA检查使用64层螺旋CT(东芝TSX-101A,日本)。移植肾动脉狭窄率=(1-残余管腔/实际管腔)×100%。狭窄的狭窄程度的分级标准[13]:轻度为(0% <狭窄率<50%)、中度(50%≤狭窄率<75%)、重度(75%≤狭窄率≤99% )及管腔闭塞(狭窄率100%)。移植肾动脉狭窄率≥75%、eGFR持续降低、肌酐和/或血压持续升高且移植肾包膜下微循环灌注不佳者,采取介入术治疗(支架置入术+球囊扩张术)。当狭窄率<75%、移植肾功能稳定且移植肾包膜下微循环灌注良好者,采用药物控制血压、改善循环等保守治疗。
超声造影检查采用西门子公司生产的Acuson S2000彩色多普勒超声仪,配制4-C1凸阵探头(频率3.0~4.5 MHz),探头机械指数为0.08~0.13, 配有CPI +TAD造影成像软件。超声造影剂是声诺维(SonoVue,Bracco Imaging,意大利),向瓶内注入生理盐水5 ml并用力振荡至均质悬浮液,注射剂量为0.02 ml/kg。CEUS采用低机械指数下的对比谐波成像。经肘静脉团注声诺维,启动CEUS模式,记录显影时间为2 min,主要观察髂血管、吻合口、主肾动脉狭窄部位、各级肾动脉及皮质造影剂增强情况。于移植肾靠近包膜下3 mm的皮质区画ROI,体积300~500 mm2,平均420 mm2。经软件分析,自动绘制TIC。由2位专攻移植肾超声且具有5年以上经验的医师采用双盲法对图像进行定量分析,如分析结果差异超过5%,则由第3位医师测量分析,结果取平均值。
超声造影定量分析参数本研究纳入分析的TIC指标及意义如下:达峰时间(time to peak,TTP)指从时间零点到ROI内造影剂达到峰值的时间;绝对达峰时间(absolutely time to peak,ATTP)指造影剂在ROI内显影至造影强度达到峰值的时间。平均渡越时间(mean-transit time,MTT)指造影剂通过ROI的平均时间。曲线下面积(area under the curve,AUC)指ROI域内造影剂的整体灌注量。
随访包括出院后12个月内或怀疑狭窄复发时的任何时间。观察并记录患者临床表现、移植肾功能改善情况,采用CEUS监测TRAS治疗后狭窄部位及移植肾包膜下血流灌注情况。再狭窄定义为CEUS显示血管介入术后管腔狭窄>50%,狭窄加重定义为管腔较前狭窄增加15%。
统计分析采用《SPSS 20.0》软件,正态分布计量资料用均数±标准差表示,非正态分布计量资料用中位数(四分位数);计数资料以率表示。正态分布独立样本间比较用两独立样本t检验,非正态分布独立样本间比较用Mann-Whitney U检验,构成比的比较用χ2检验或fisher’s精确检验。相关性分析采用Spearman检验。研究指标各时间点变化总体比较采用单因素重复测量的方差分析,各时间点变化的两两比较采用Bonferroni法。统计检验均采用双侧检验,P<0.05为差异有统计学意义。
结 果
患者基本临床特征肾移植术与CTA检查之间的中位时间为4.5(范围3~168)个月。表1列举了两组患者在行CTA前的基本病历资料。与对照组相比,TRAS组估算的肾小球滤过率(eGFR)明显减低,血清肌酐及平均动脉压均明显升高(P<0.05)。所有患者在年龄、性别、移植次数、移植动脉吻合口类型、供肾主动脉数量、供肾侧、移植后并发症(糖尿病、急性排斥反应)及免疫抑制剂方案等方面差异无统计学意义(P>0.05)。

表1 两组患者的基本资料
CEUS诊断TRAS的效能34例患者中CTA确诊TRAS为18例,其中移植肾动脉吻合处狭窄为12例,吻合处远侧的移植肾动脉主干狭窄为6例。CEUS诊断TRAS为18例(16例经CTA确诊)(图1),其中2例为轻度狭窄而CEUS评估为管径正常。CEUS诊断TRAS的灵敏度为88.9%、特异度为87.5%。
两组患者超声检查参数比较与对照组相比,TRAS组患者主肾动脉狭窄处收缩期峰值流速明显升高(图1),TTP、ATTP及MTT较对照组相比明显延长,AUC明显增大(P<0.01,表2)。
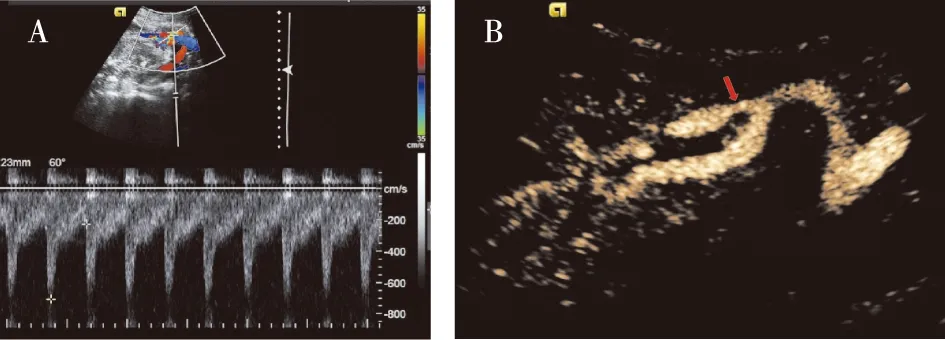
图1 多普勒超声与超声造影提示移植肾动脉狭窄34岁男性患者,同种异体肾移植术后半年,因“血清肌酐升高5d”入院;(A)多普勒超声示主肾动脉近肾门处血流变细,色彩斑斓,测得异常高速血流,其中收缩期流速Vmax约705.7 cm/s,舒张期Vmax:227.5 cm/s,RI:0.68;(B)CEUS示肾门处可见主肾动脉分为2支,其中1支动脉起始部管径狭窄(↑)
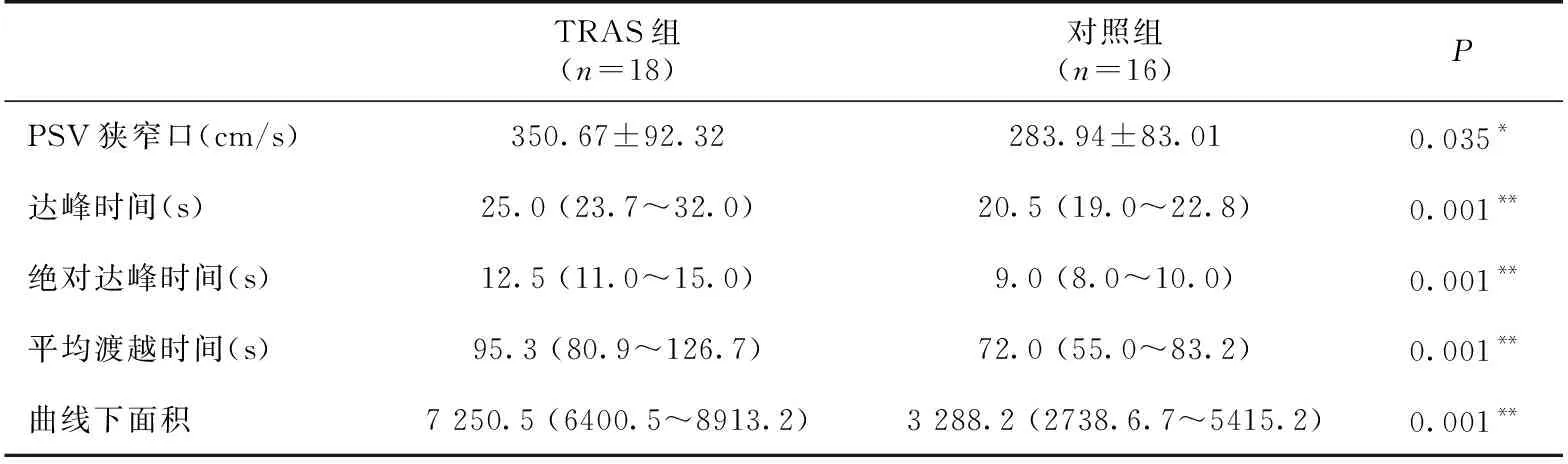
表2 两组患者超声检查参数的比较
CEUS定量指标与eGFR的相关性分析eGFR与TTP(r=- 0.72,P<0.001)、ATTP(r=-0.66,P<0.001)、MTT(r=-0.60,P<0.001)及AUC(r=-0.49,P=0.003)有显著相关性(图2)。

图2 时间-强度曲线定量参数与移植肾功能呈负相关 eGFR:估算肾小球滤过率;TTP:达峰时间; ATTP:绝对达峰时间;MTT:平均渡越时间;AUC:曲线下面积
治疗与随访TRAS组8例患者采取血管介入术治疗(支架置入术+球囊扩张术),该部分患者中位狭窄率为87.5%(81.2%~93.8%)、eGFR持续降低和/或血压持续升高,且移植肾包膜下微循环灌注不佳(TTP、ATTP、MTT及AUC明显异常)。TRAS组其他10例患者中位狭窄率为65.0%(60.0%~70.0%),CEUS示移植肾微循环灌注好,采用保守治疗,如药物控制血压、改善循环及移植肾功能等。所有患者采用多普勒超声与CEUS随访。介入术组术后第3个月eGFR、TTP及ATTP较术前明显好转(P<0.01),至术后1年上述指标仍趋于稳定;保守治疗组eGFR及TTP无明显波动(P>0.05),ATTP较前改善(P<0.05)(图3)。在狭窄部位的监测上,介入术的患者无发生再狭窄,保守治疗的患者无发生狭窄加重。中位随访时间21.5(12~61)月,所有患者均无移植物丢失。
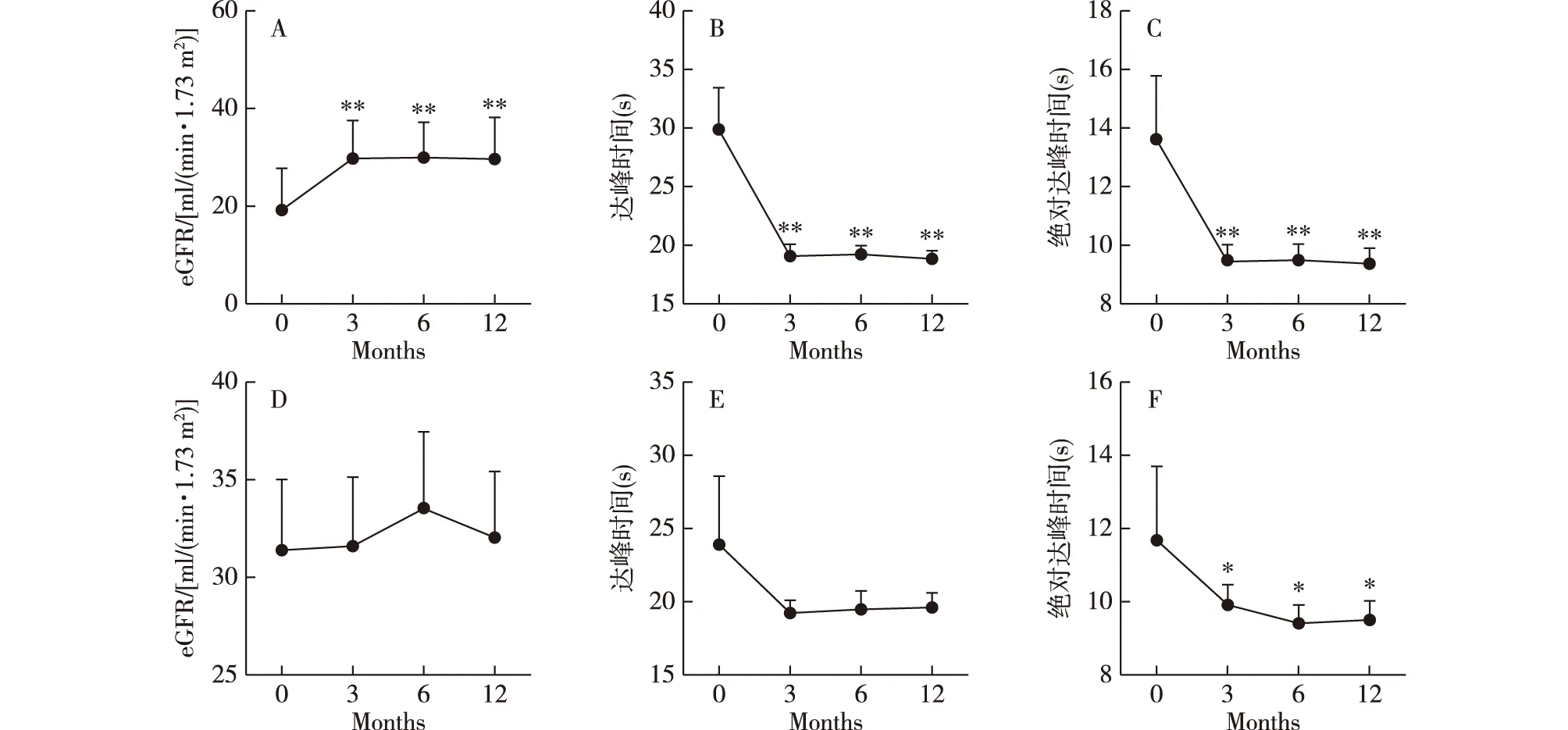
图3 TRAS组采用不同治疗策略治疗前后的比较TRAS:移植肾动脉狭窄;eGFR:估算肾小球滤过率(A,D); 达峰时间(B,E);绝对达峰时间(C,F);血管介入组(A、B、C);保守治疗组(D、E、F);与治疗前(第0个月)相比,*:P<0.05,**:P<0.01
讨 论
传统的多普勒超声是肾移植术后最常用的无创性监测移植肾内血流动力学变化的方法,在TRAS的早期诊断中起重要的作用[14]。但多普勒超声易受操作者主观因素影响较大(取样声束与血流方向的夹角),且它无法定量评估血流灌注,可能给出移植肾血流良好的错觉,而这与TRAS治疗策略的选择密切相关。
CTA是诊断TRAS的金标准,可以直观显示血管解剖形态,但它无法定量评估移植肾微循环灌注的情况,且放射性碘剂会直接影响移植肾细胞的氧合作用[15-16]。Rajan等[17]曾经报道采用放射性造影剂检查后出现移植肾功能损害导致移植肾衰竭的案例。相对比而言,CEUS的造影剂声诺维通过肺脏代谢,具有更高的安全性。Piscaglia等[18]在多中心的分析得出CEUS严重不良事件总体报告率仅为0.008 6%(2/23 188)。本研究中心有超过10年采用CEUS检查移植肾的经验,无一例出现SonoVue造影剂过敏等不良事件。此外,操作方便、重复性高和检查费用低是CEUS的另一优势,大大减轻了患者的经济负担,提高了患者的依从性。本研究显示,CEUS在诊断TRAS狭窄部位具有较高的准确性,与Pan等[19]研究结果相似。因此在移植肾功能严重受损、碘造影剂过敏的患者可考虑采用CEUS诊断及随访。
CEUS动态监测移植肾微血管灌注在移植肾并发症上发挥着重要作用,如排斥反应的类别及药物的疗效[20-21]。Araújo等[22]通过分析组间造影剂到达皮髓质的TTP得出移植肾延迟恢复的不同时期存在血液的分流。Grzelak等[12]发现TRAS患者造影剂到达皮质与髓质的时间明显延长。本研究进一步发现了TRAS组造影剂到达移植肾皮质的TTP、ATTP及MTT较对照组均有延长,造影剂灌注的AUC增大,且与移植肾功能eGFR呈负相关,提示狭窄通过影响移植肾内微循环灌注不同程度造成移植肾功能的损害。
血管介入治疗是解除移植肾解剖狭窄的最直接方法[23]。然而是否需要积极采取手术干预是TRAS的治疗热点。有学者认为部分狭窄的动脉可自行好转,鉴于移植肾造影剂肾病及及手术带来的并发症[8-9],可保守治疗并定期复查。一项对肾动脉狭窄的大型随机对照临床研究(CORAL研究)显示,介入治疗肾动脉狭窄对临床获益不明显[24],其原因可能是狭窄导致的病理生理改变,如顽固性高血压、eGFR降低或移植肾血流灌注不良等改变,较血管解剖狭窄的严重程度更有预测价值。因此,客观评价移植肾的血流灌注对TRAS的治疗策略具有重要临床意义。本研究综合评估TRAS患者临床表现、狭窄率及微循环灌注情况而采取不同的治疗方式,长期随访患者移植肾功能稳定,提示CEUS定量分析移植肾循环灌注状况,可以辅助评估狭窄对移植肾病理改变的严重程度,为临床药物及介入治疗提供影像学依据。
本研究存在一定的局限性。本研究是单中心回顾性研究,样本量相对较少,所获得的血流灌注参数,需要进一步增加患者数量或联合多中心数据研究验证。此外,本研究对患者随访的时间较短,需延长随访时间观察TRAS不同治疗策略的疗效。
小结:CEUS能直观显示移植肾狭窄部位,TIC定量分析能评估TRAS的狭窄是否影响移植肾的微循环灌注,可作为辅助诊断及随访TRAS疗效的可靠方法。此外,由于CTA可引起移植肾造影剂肾病,对于放射性造影剂过敏、移植肾功能不全的患者可考虑采取CEUS密切随访观察。

