维持性血液透析患者左心室舒张功能障碍的危险因素及预测模型
甘言刚 赵明明 滕 洁 夏文亚 张 颖 冯锦红 孙 东
慢性肾脏病(CKD)患者的心血管事件发生率随着肾功能的恶化逐渐增加[1]。心力衰竭和心脏性猝死占很大比例,特别是在终末期肾病(ESRD)患者中[2]。它们都与CKD相关心脏重塑的发生有关,其称为尿毒症性心肌病(uremia cardiomyopathy,UC)[3]。UC以进行性左心室肥厚、纤维化和心肌水肿为特征[4],主要伴有左室舒张功能障碍(left ventricular diastolic dysfunction,LVDD)[5]。LVDD是心血管事件发生的重要决定因素[6]。早期发现及干预LVDD有利于降低心血管事件发生率,改善透析患者预后[7]。研究发现B型脑钠肽(B-type natriuretic peptide,BNP)对维持性血液透析(MHD)患者LVDD具有一定诊断价值[8]。然而,随着肾功能的恶化,容量状态改变及透析清除,可影响患者BNP水平,影响其对LVDD的诊断效能[9]。此外,既往大多数研究对LVDD诊断多是根据E/A比值。CKD患者常存在容量负荷过重,E/A容易受容量负荷的影响导致其对舒张功能判断的准确性下降[10]。因此,本研究拟采用新的LVDD诊断标准,探讨相关危险因素及构建诊断模型以期为临床早期诊治提供参考。
对象与方法
一般资料选取2019~2020年徐州医科大学附属医院血液透析中心MHD患者75例作为本次研究对象。纳入标准:(1)年龄在18~80岁;(2)规律血液透析>3月;(3)每周规律透析3次,每次4h;(4)患者同意,签署知情同意书。排除标准:(1)6个月内新发心肌梗死;(2)严重的心力衰竭,纽约心脏病协会(New York Heart Association,NYHA)Ⅲ~Ⅳ级;(3)严重的心脏瓣膜病;(4)罹患恶性肿瘤;(5)合并严重的感染;(6)近1月内有外科手术病史。本研究经伦理委员会批准。
观察指标研究开始时记录患者相关的人口学特征,包括性别、年龄、身高、体重、体质量指数(BMI)、肾脏基础疾病及合并症。透析前测量患者血压。透前采集患者空腹静脉血。检测项目包括:血红蛋白、血清白蛋白、三酰甘油、低密度脂蛋白、高密度脂蛋白、总胆固醇、血清肌酐、血钙、血磷、全段甲状旁腺激素(intact parathyroid hormone,iPTH)、超敏肌钙蛋白T(high-sensitive cardiac troponin T,hs-cTnT)、氨基末端脑钠肽前体(N-terminal pro-brain natriuretic,NT-proBNP)。尿素清除指数(Kt/V)、超滤率从透析中心常规检测资料中获得。
超声心动图在非透析日由经验丰富的超声科医师进行超声心动图检查。患者左侧卧位,根据美国超声协会的标准进行M型超声及二维超声检查。测量舒张末期左室前后径(left ventricular diastolic diameter,LVDd)、室间隔厚度(interventricular septal thickness,IVST)及左室后壁厚度(left ventricular posterior wall thickness,PWT)、左房直径(left atrial diameter,LAD)。左心房容积是由LAD,使用Canciello等所述的公式[11]计算得出,然后除以体表面积得到左房容积指数。左心室质量由Devereux公式[12]:0.8×1.04×[(LVDd+IVST+PWT)3-LVDd3]+0.6。LVMI为左心室质量与体表面积之比。分别描绘心尖四腔观和两腔观左室舒张末期和收缩末期心内膜曲线,Simpson法计算左心室射血分数(left ventricular ejection fraction,LVEF);血流多普勒测量三尖瓣反流速度(tricuspid regurgitation velocity,TRV)、二尖瓣舒张早期峰流速(E),组织多普勒(TDI)测二尖瓣环室间隔部舒张早期运动速度峰值(e’),并计算E/e’比值。
研究分组根据2016年美国超声心动图学会和欧洲心血管影像协会推荐用于识别舒张功能的四个指标及其临界值分别是:二尖瓣瓣环的 e’速度室间隔部 e’<7 cm/s,E/e’>15,左房容积指数>34 ml/m2,TR峰值流速>2.8 m/s。两者以上均超过临界值,提示舒张功能不全[13]。将患者分为LVDD(n=41)组,及非LVDD(n=34)组。
统计学方法采用《SPSS 23.0》软件进行一般统计学分析处理。计量资料经正态性检验,符合正态分布的资料以均数±标准差描述,差异比较采用t检验,非正态分布资料以中位数表示,应用Mann-Whitney检验。计数资料采用例数和百分比表示,两组间比较采用χ2检验。采用Medcalc软件行ROC曲线分析,确定各指标、预测模型的最佳截断值及其预测价值。二元Logistic回归筛选LVDD的独立危险因素并构建预测模型。P<0.05为差异有统计学意义。
结 果
基本资料入选75例MHD患者其中男性46例,女性29例,平均年龄(52.27±14.52)岁。CKD的病因包括慢性肾小球肾炎35例,糖尿病肾病22例,高血压肾病7例,多囊肾4例,多发性骨髓瘤肾病2例,抗中性粒细胞胞质抗体(ANCA)相关血管炎性肾病1例,痛风性肾病1例,其他原因不明3例。
两组患者临床及实验室检查结果LVDD组年龄、收缩压、全段甲状旁腺激素、hs-cTnT、NT-proBNP、LVMI、TRV及E/e’较非LVDD组增高,血清肌酐、e’减低,差异均有统计学意义(表1)。
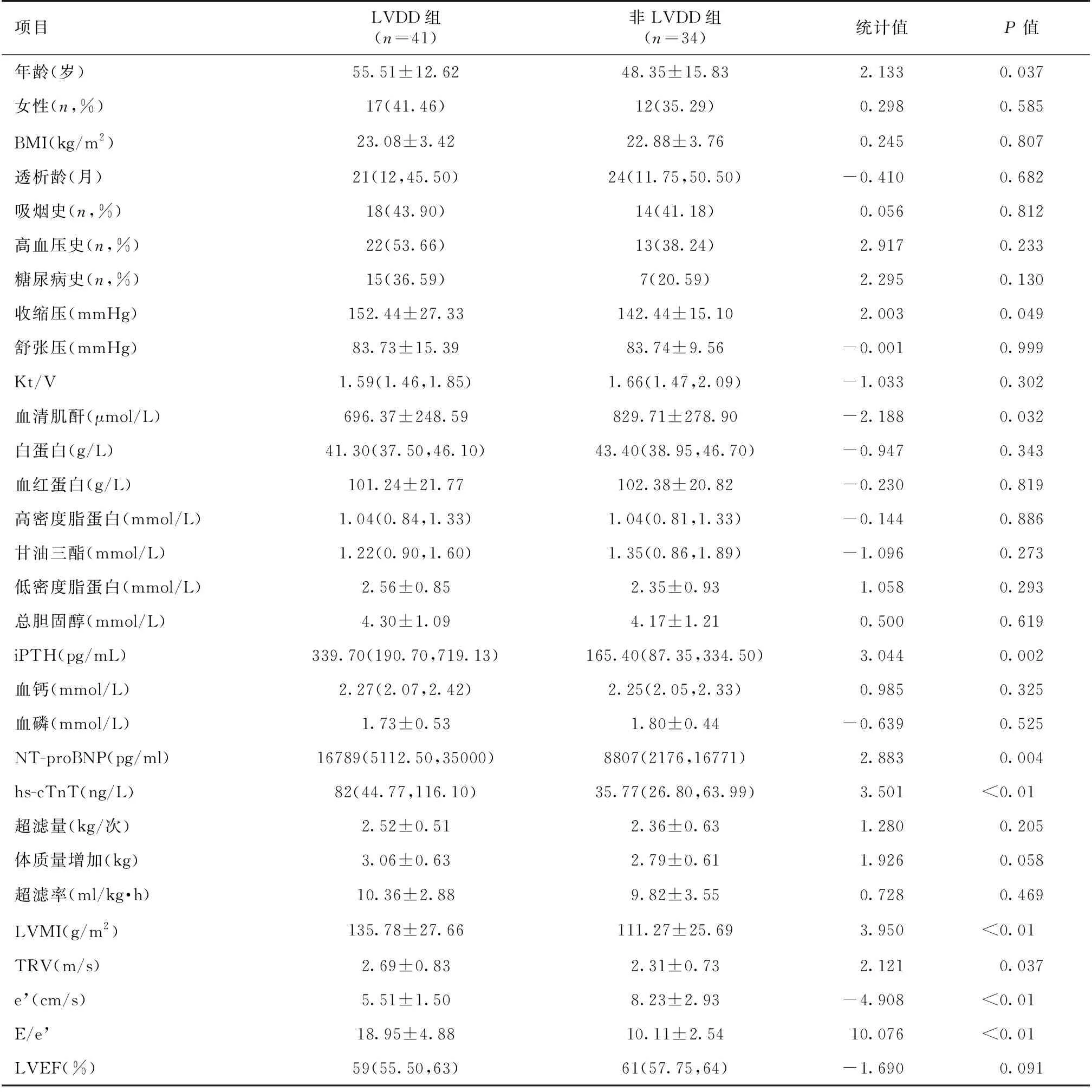
表1 两组患者的人口学资料和实验室检查结果比较
LVDD危险因素分析应用单因素Logistic回归发现(表2),年龄、收缩压、血清肌酐、iPTH、hs-cTnT、NT-proBNP及LVMI为LVDD的危险因素(P<0.05)。在多因素Logistic回归中(表2),纳入单因素回归中P<0.05的变量,结果显示:hs-cTnT、LVMI为LVDD的独立危险因素。
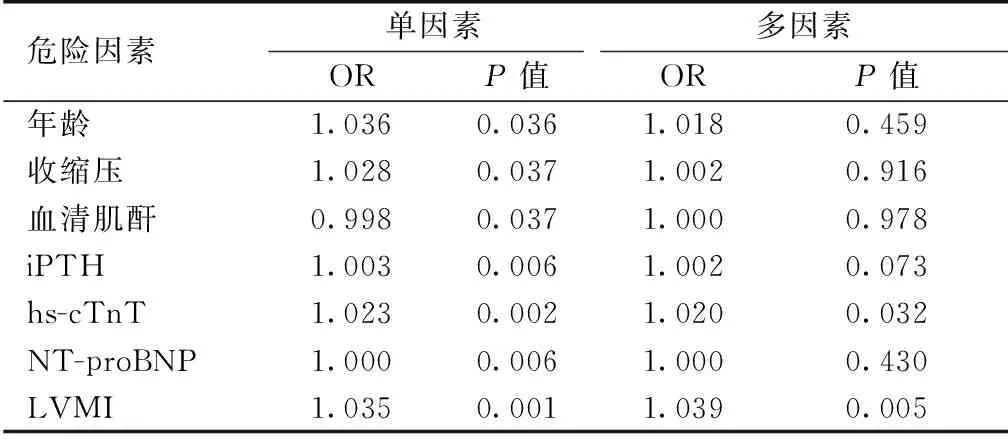
表2 维持性血液透析患者临床相关指标与LVDD的关系(Logistic回归)
预测模型构建及验证用因变量 Y 代表MHD患者发生LVDD的风险,自变量 X 代表可引起LVDD的危险因素。LVDD的独立危险因素X1=hs-cTnT、X2=LVMI为自变量,是否患LVDD为因变量,进行二元Logistic回归分析,建立回归方程:Y=-6.215+0.002×X1+0.038×X2。Y越大患LVDD的风险越大。当危险因素的总分值>0.406 时,诊断的灵敏度为90.24% 、特异度为73.53%。ROC曲线下面积为 0.871,P<0.01。说明此模型对预测 MHD 患者LVDD具有较高的诊断价值(图1)。
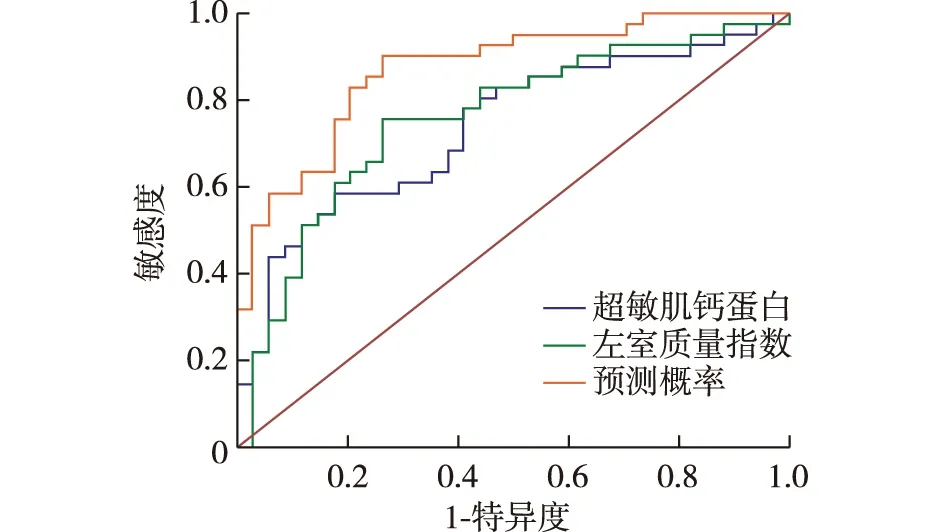
图1 各指标预测左室舒张功能障碍的ROC曲线
各指标对LVDD诊断的ROC曲线采用ROC曲线确定各指标、预测模型的最佳截段值及其预测价值(表3)。
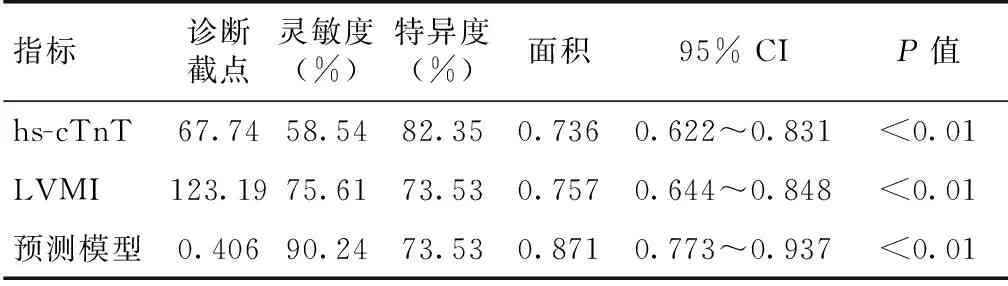
表3 各指标诊断LVDD的ROC曲线下面积
讨 论
LVDD在ESRD患者中很常见,并与其较高的死亡率相关[14]。目前,尚缺乏可明显改善其预后的治疗药物,因此探讨相关影响因素及其机制至关重要[15]。本研究利用MHD患者常见的临床及实验室检查数据,探讨了LVDD的危险因素并建立预测模型。我们的研究发现hs-cTnT、LVMI是LVDD的独立危险因素,预测模型有较好的诊断价值。
肌钙蛋白T(cardiac troponin T,cTnT)是急性心梗的一项具有高敏感及特异性的血清标志物。近年来,临床上常用高敏感度法检测hs-cTnT,在一些无心绞痛和心梗的慢性病患者中也发现其升高。在MHD患者中,血清hs-cTnT升高的比例高达50%~90%,且与心血管事件及全因死亡相关[16]。但是,血清hs-cTnT在MHD患者中的作用尚有争议。本研究发现在无急性心梗及心绞痛的患者中hs-cTnT升高与LVDD相关,是其独立危险因素。Shionimya等[17]研究发现hs-cTnT水平与患者左室舒张末期压力相关。hs-cTnT水平升高与肾脏清除功能下降关联较小[18]。因此,hs-cTnT可更加准确反映心肌细胞受损情况。
左心室肥厚(left ventricular hypertrophy,LVH)在ESRD患者中很常见[19],并且随着LVH的出现,会引起心肌毛细血管生长受限,导致心肌细胞/毛细血管失衡,氧扩散距离增加,心脏对缺血的耐受性降低,从而导致心肌肌钙蛋白的漏出[20]。ESRD常伴动脉僵硬度增加及冠脉钙化,其会导致心肌灌注不足引起cTnT升高[21]。此外,MHD会引起血流动力学的剧烈变化,导致低血压和间歇性局部心肌缺血,导致心肌顿抑(一种特殊类型的缺血-再灌注损伤)[22]。舒张功能不全患者存在心室充盈障碍,在超滤过程中即使是少量的血容量下降也可引起心输出量和血压变化,引起心肌灌注不足,导致心肌损伤[23]。因此,血液透析可导致心肌损伤,出现纤维化、心肌肥厚及舒张功能不全。舒张功能不全反过来会加重心肌损伤形成恶性循环,最终导致患者心脏功能进一步恶化。Jefferies等[24]研究表明,随着HD强度(频率和持续时间)的增加,心肌顿抑的发生率可以降低,而超滤量和心肌顿抑的严重程度存在正相关,而透析频率增加时cTnT水平会降低。Peters等[21]研究发现透析患者超滤量的增加和心输出量的下降可导致cTnT水平升高。本研究中LVDD组超滤量较非LVDD组增加,但差异无统计学意义,可能是由于超滤量变化较大,某一次数值不能很好代表过去一段时间超滤量水平,后续将采用随机对照研究进一步探索超滤量的作用。
BNP主要在心肌细胞受牵拉时大量合成和释放。BNP主要通过与利钠受体结合从而激活鸟苷酸环化酶刺激细胞内第二信使环磷酸鸟苷(CGMP)的产生,进而产生利钠排尿、舒张血管及抑制肾素醛固酮的作用。通过与特定清除受体结合而被清除或被中性内肽酶降解[25]。有研究发现,BNP是预测CKD患者心血管事件的重要生物标志物,是CKD患者失代偿性心力衰竭、冠状动脉疾病、左心室肥大和死亡率的预测因子。BNP、NT-proBNP都是透析患者死亡的预测因子,NT-proBNP半衰期更长且更加依赖于肾脏清除,MHD患者NT-proBNP水平较BNP升高的幅度更高[26]。Tagore等[27]发现BNP比NT-proBNP更加适合评估CKD患者心脏功能。随着肾功能的恶化,容量状态改变及透析清除,可影响患者BNP水平[9]。本研究中发现NT-proBNP升高是LVDD的影响因素,纳入多因素后无统计学意义。因此,相较于收缩性心力衰竭,对于LVDD患者而言,单独采用NT-proBNP一个指标,可能会产生一定的误差。本研究中根据危险因素建立的预测模型有较好的诊断价值,其曲线下面积为0.871。
本研究的局限性在于样本量相对较少,采用横断面设计不能得出因果结论。此外,本研究没有进行长期随访,无法观察LVDD发生心血管事件及心血管死亡的风险。尚需要更多的临床及基础研究进一步探讨可降低hs-cTnT、延缓左室肥厚及改善左心室舒张功能的治疗方法。
综上所述,本研究发现了hs-cTnT、LVMI与LVDD的关系,肯定了其检测的临床意义。该预测模型对LVDD有较好的诊断价值,但其临床意义及价值尚有待更大样本的临床研究的证实。

